12.12:
Elektrolitler: van't Hoff Faktörü
12.12:
Elektrolitler: van't Hoff Faktörü
Elektrolitlerin Koligatif Özellikleri
Bir çözeltinin koligatif özellikleri, çözünen çözünen türlerin kimliğine değil, yalnızca sayısına bağlıdır. Çeşitli koligatif özellikler (donma noktası düşüşü, kaynama noktası yükselmesi, ozmotik basınç) için denklemlerdeki konsantrasyon terimleri, çözeltide bulunan tüm çözünen türlerle ilgilidir. Elektrolit olmayanlar, ayrışma veya eşlik eden diğer herhangi bir işlem olmaksızın fiziksel olarak çözünür. Çözünen her molekül, bir çözünmüş çözünen molekül verir. Bununla birlikte, bir elektrolitin çözünmesi, aşağıdaki iki yaygın örnekte gösterildiği gibi, bu kadar basit değildir:
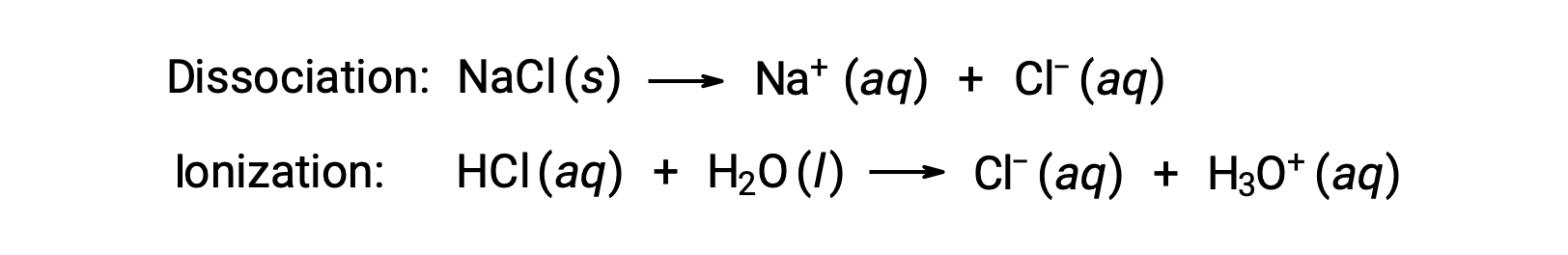
Bu örneklerden ilki göz önüne alındığında ve tam ayrışmanın olduğu varsayıldığında, 1,0 m sulu NaCl çözeltisi, her bir kilogram su için 2,0 mol iyon (1,0 mol Na+ ve 1,0 mol Cl−) içerir ve donma noktası düşüşünün olması beklenir.
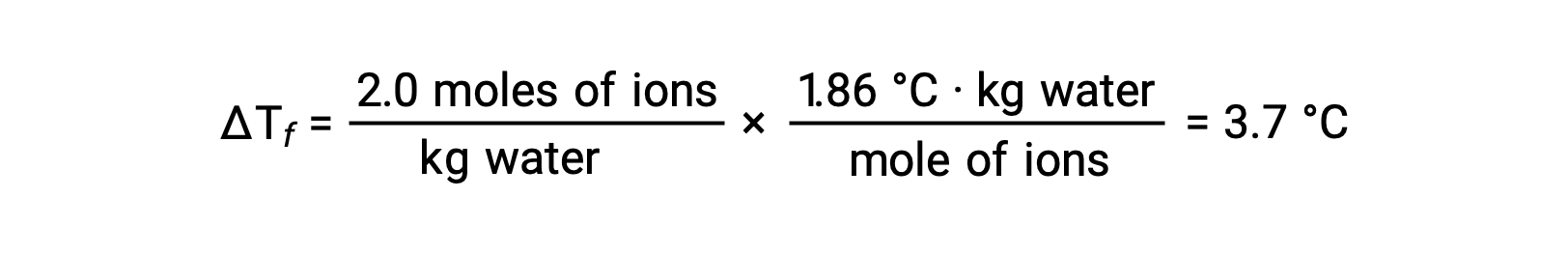
Ancak, bu çözelti gerçekten hazırlandığında ve donma noktası düşüşü ölçüldüğünde, 3,4 °C’lik bir değer elde edilir. Diğer iyonik bileşikler için benzer tutarsızlıklar gözlenir ve ölçülen ve beklenen birleşik özellik değerleri arasındaki farklar tipik olarak çözünen konsantrasyonları arttıkça daha önemli hale gelir. Bu gözlemler, sodyum klorür iyonlarının (ve diğer güçlü elektrolitlerin) çözelti içinde tamamen ayrışmadığını göstermektedir.
Bunu hesaba katmak ve tam ayrışma varsayımına eşlik eden hatalardan kaçınmak için, Nobel ödüllü Alman kimyager Jacobus Henricus van’t Hoff onuruna adlandırılan deneysel olarak ölçülmüş bir parametre kullanılır. Van’t Hoff faktörü (i), çözeltideki çözünen parçacıkların çözünen formül birimlerinin sayısına oranı olarak tanımlanır:

1923’te, kimyagerler Peter Debye ve Erich Hückel, güçlü elektrolitlerin görünen tamamlanmamış iyonizasyonunu açıklamak için bir teori önerdiler. Sulu bir solüsyondaki interiyonik çekiciliğin iyonların çözülmesi ve polar çözücünün yalıtım etkisi ile çok büyük ölçüde azaltılmasına rağmen, tamamen iptal edilmediğini öne sürdüler. Kalan çekimler, iyonların tamamen bağımsız parçacıklar gibi davranmasını engeller. Bazı durumlarda, pozitif ve negatif bir iyon aslında birbirine değebilir ve iyon çifti adı verilen çözülmüş bir birim verebilir. Bu nedenle, aktivite) veya etkili konsantrasyon (herhangi bir belirli iyon türünün gerçek konsantrasyonla belirtilenden daha azdır. Çözelti daha seyreltikçe ve artık interiyonik çekicilikler gittikçe azaldıkça iyonlar gittikçe daha geniş bir şekilde ayrılır. , aşırı derecede seyreltik çözeltilerde, iyonların etkili konsantrasyonları (aktiviteleri) esasen gerçek konsantrasyonlara eşittir. 0,05 m’lik çözeltiler için, NaCl için i değeri 1,9, ideal değer olan 2’dir.
Bu metin bu kaynaktan uyarlanmıştır Openstax, Chemistry 2e, Section 11.4: Colligative Properties.
Suggested Reading
- Van Houten, Josh. "A century of chemical dynamics traced through the Nobel Prizes. 1901: Jacobus van't Hoff." Journal of Chemical Education 78, no. 12 (2001): 1570.
- Harned, Herbert S. "Activity Coefficients And Colligative Properties Of Electrolytes." Journal of the American Chemical Society 44, no. 2 (1922): 252-267.
- Randall, Merle, and Clyve Allen. "The Interpretation Of The Colligative Properties Of Weak Electrolytes." Journal of the American Chemical Society 52, no. 5 (1930): 1814-1823.
