16.11:
Fatores que Afetam a Solubilidade
16.11:
Fatores que Afetam a Solubilidade
Em comparação com a água pura, a solubilidade de um composto iónico é menor em soluções aquosas contendo um ião comum (um também produzido por dissolução do composto iónico). Este é um exemplo de um fenómeno conhecido como efeito de ião comum, que é uma consequência da lei de ação das massas que pode ser explicada utilizando o princípio de Le Chȃtelier. Considere a dissolução do iodeto de prata:
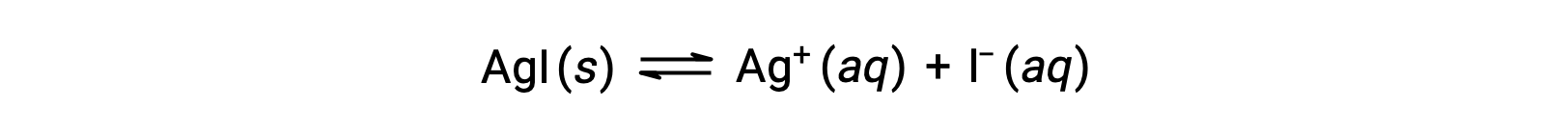
Este equilíbrio de solubilidade pode ser deslocado pela adição de iões de prata ou iodeto, resultando na precipitação de AgI e na diminuição das concentrações de Ag+ e I– dissolvidos. Em soluções que já contêm qualquer destes iões, menos AgI pode ser dissolvido do que em soluções sem estes iões.
Este efeito pode também ser explicado em termos de ação das massas, tal como representado na expressão do produto de solubilidade:
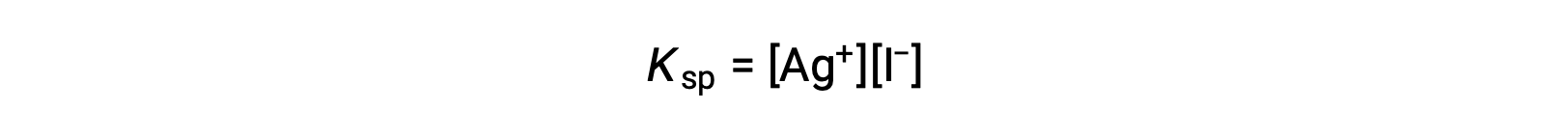
O produto matemático das molaridades dos iões de prata e iodeto é constante em uma mistura de equilíbrio, independentemente da fonte dos iões, e assim um aumento na concentração de um ião deve ser equilibrado por uma diminuição proporcional no outro.
O Papel da Precipitação no Tratamento de Águas Residuais
Os equilíbrios de solubilidade são ferramentas úteis no tratamento de águas residuais realizadas em instalações que podem tratar a água municipal em uma cidade ou município. Especificamente, a precipitação selectiva é utilizada para remover contaminantes das águas residuais antes de serem libertadas para corpos naturais de água. Por exemplo, os iões fosfato (PO43−) estão frequentemente presentes na água descarregada das instalações de fabrico. Uma abundância de fosfato faz com que algas cresçam em excesso, o que afeta a quantidade de oxigénio disponível para a vida marinha, assim como torna a água inadequada para consumo humano.
Uma maneira comum de remover fosfatos da água é pela adição de hidróxido de cálcio, ou cal, Ca(OH)2. À medida que a água se torna mais básica, os iões de cálcio reagem com iões fosfato para produzir hidroxiapatita, Ca5(PO4)3·OH, que depois precipita da solução:
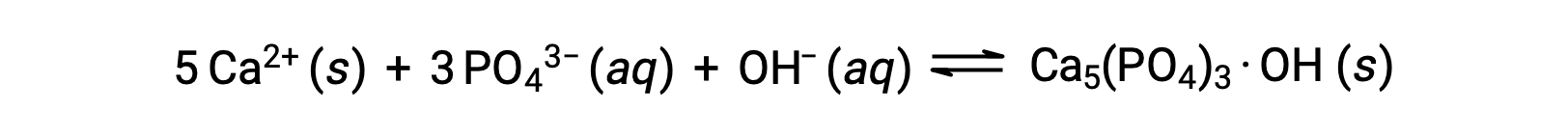
Como a quantidade de iões de cálcio adicionada não excede os produtos de solubilidade para outros sais de cálcio, os aniões desses sais permanecem para trás nas águas residuais. O precipitado é então removido por filtração, e a água é trazida de volta para um pH neutro pela adição de CO2 em um processo de recarbonização. Outros produtos químicos também podem ser utilizados para a remoção de fosfatos por precipitação, incluindo cloreto de ferro(III) e sulfato de alumínio.
Este texto é adaptado de Openstax, Chemistry 2e, Section 15.1: Precipitation and Dissolution.
Suggested Reading
- Koubek, E. "Demonstration of the Common Ion Effect." Journal of chemical education 70, no. 2 (1993): 155.
- Amaral, L. F., I. R. Oliveira, R. Salomão, E. Frollini, and V. C. Pandolfelli. "Temperature and common-ion effect on magnesium oxide (MgO) hydration." Ceramics International 36, no. 3 (2010): 1047-1054.
- Cassens, Jan, Anke Prudic, Feelly Ruether, and Gabriele Sadowski. "Solubility of pharmaceuticals and their salts as a function of pH." Industrial & Engineering Chemistry Research 52, no. 7 (2013): 2721-2731.
