16.11:
Facteurs affectant la solubilité
16.11:
Facteurs affectant la solubilité
Par rapport à l’eau pure, la solubilité d’un composé ionique est moindre dans les solutions aqueuses contenant un ion commun (un autre ion produit également par dissolution du composé ionique). C’est l’exemple d’un phénomène connu sous le nom de l’effet d’ion commun, qui est une conséquence de la loi d’action de masse qui peut être expliquée en utilisant le principe de Le Chȃtelier. Considérons la dissolution de l’iodure d’argent :
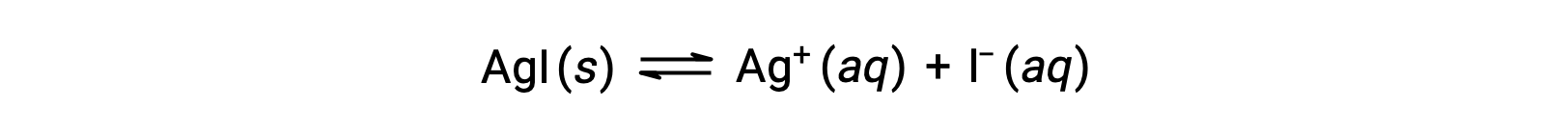
Cet équilibre de solubilité peut être déplacé par l’addition d’ions argent ou iodure, ce qui entraîne la précipitation d’AgI et une diminution des concentrations d’Ag+ et d’I– dissous. Dans les solutions qui contiennent déjà l’un ou l’autre de ces ions, moins d’AgI peut être dissout que dans les solutions sans ces ions.
Cet effet peut également être expliqué en termes d’action de masse tel que représenté dans l’expression du produit de solubilité :
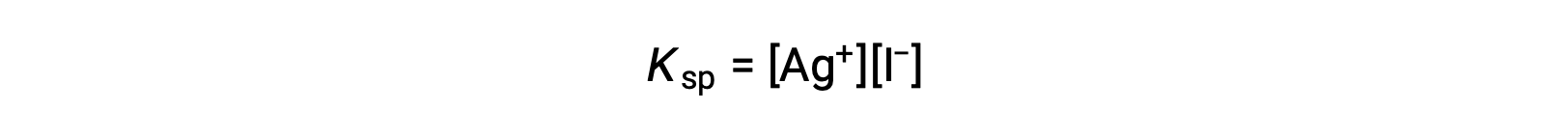
Le produit mathématique des molarités des ions argent et iodure est constant dans un mélange en équilibre, quelle que soit la source des ions, et donc une augmentation de la concentration d’un ion doit être équilibrée par une diminution proportionnelle de l’autre ion.
Le rôle de la précipitation dans le traitement des eaux usées
Les équilibres de solubilité sont des outils importants pour le traitement des eaux usées effectué dans des installations qui peuvent traiter l’eau municipale dans une ville ou une commune. Plus précisément, la précipitation sélective est utilisée pour éliminer les contaminants des eaux usées avant qu’elles ne soient reversées dans les plans d’eau naturels. Par exemple, les ions phosphate (PO43−) sont souvent présents dans l’eau évacuée des sites de production. Une abondance de phosphate provoque la croissance d’un excès d’algues, ce qui a une incidence sur la quantité d’oxygène disponible pour la vie marine et rend l’eau inadaptée à la consommation humaine.
L’ajout d’hydroxyde de calcium, ou de chaux, Ca(OH)2, est une façon courante d’éliminer les phosphates de l’eau. Comme l’eau devient plus basique, les ions calcium réagissent avec les ions phosphate pour produire de l’hydroxylapatite, Ca5(PO4)3·OH, qui précipite ensuite hors de la solution :
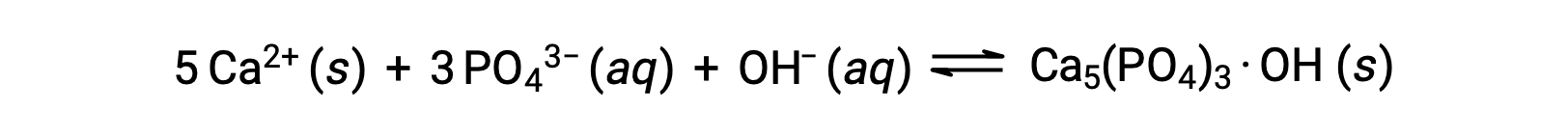
Étant donné que la quantité d’ions calcium ajoutée n’entraîne pas un dépassement des produits de solubilité pour les autres sels de calcium, les anions de ces sels restent dans les eaux usées. Le précipité est ensuite éliminé par filtration, et l’eau est ramenée à un pH neutre par l’addition de CO2 dans un procédé de recarbonatation. D’autres produits chimiques peuvent également être utilisés pour l’élimination des phosphates par précipitation, y compris le chlorure de fer(III) et le sulfate d’aluminium.
Ce texte est adapté de Openstax, Chimie 2e, Section 15.1: Précipitation et dissolution.
Suggested Reading
- Koubek, E. "Demonstration of the Common Ion Effect." Journal of chemical education 70, no. 2 (1993): 155.
- Amaral, L. F., I. R. Oliveira, R. Salomão, E. Frollini, and V. C. Pandolfelli. "Temperature and common-ion effect on magnesium oxide (MgO) hydration." Ceramics International 36, no. 3 (2010): 1047-1054.
- Cassens, Jan, Anke Prudic, Feelly Ruether, and Gabriele Sadowski. "Solubility of pharmaceuticals and their salts as a function of pH." Industrial & Engineering Chemistry Research 52, no. 7 (2013): 2721-2731.
