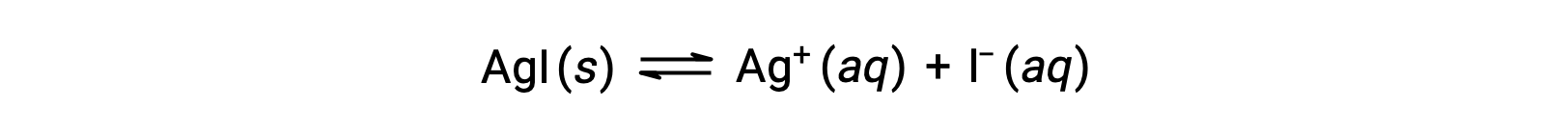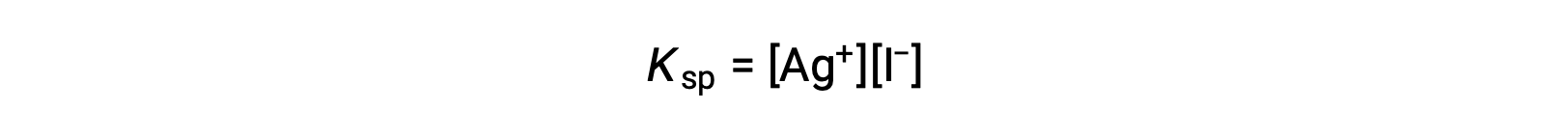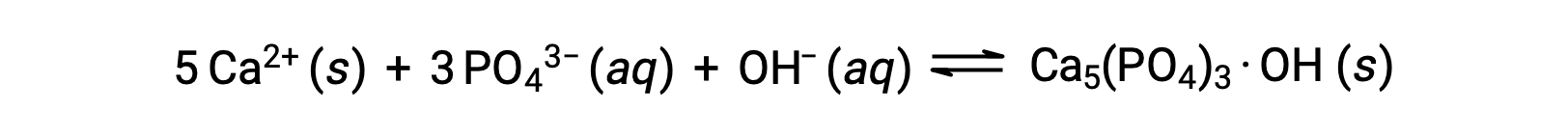16.12: 影响溶解度的因素
与纯水相比,含有普通离子的水溶液 (离子化合物的溶解也产生的离子) 离子化合物的溶解度较低。 这是一个称为同离子效应的现象的示例,这是质量作用定律的结果,可以使用 勒夏特列原理(Le Chatelier's Principle) 来解释。 考虑碘化银的溶解:
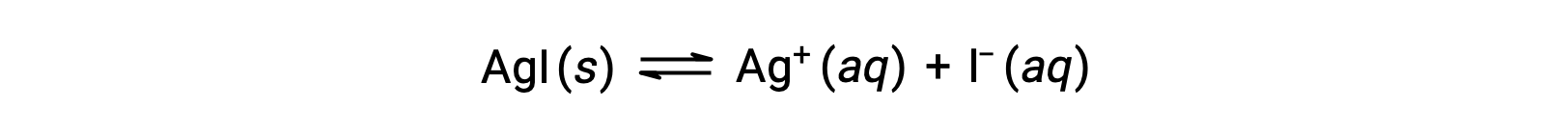
这种溶解平衡可能会因添加银离子或碘化离子而改变,从而导致 AGI 的沉淀和溶解 A3+ 和 I –的浓度降低。 在已经含有这两种离子之一的溶液中,没有这些离子的 AGI 可能比溶液中的溶解更少。
这种影响也可以用溶度积表达式中表示的质量操作来解释:
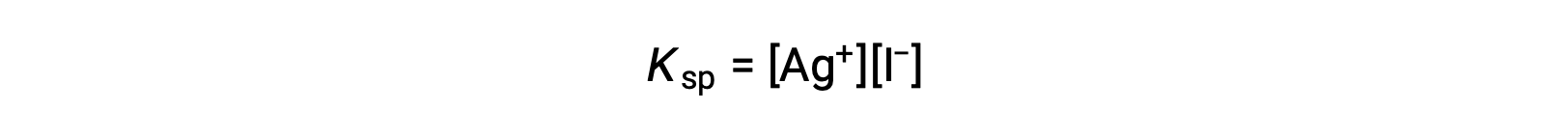
无论离子源如何,银和碘化离子极性的数学生成物在平衡混合物中都是恒定的,因此一个离子的浓度的增加必须通过另一个离子的比例减小来平衡。
沉淀在废水处理中的作用
溶解度平衡是在城市或城镇处理城市水的设施中进行废水处理的有用工具。 具体而言,选择性沉淀用于在废水释放回自然水体之前清除废水中的污染物。磷酸盐离子 (PO43−), 通常存在于从生产设施排出的水中。 大量磷酸盐会导致过量藻类生长,这会影响可用于海洋生物的氧气的数量,并使水不适合人类食用。
从水中去除磷酸盐的一种常见方法是添加氢氧化钙或石灰 Ca(OH)2。 随着水变得更基本,钙离子会与磷酸盐离子发生反应,产生羟基甲酸酯 Ca5(PO4)3·OH,然后从溶液中沉淀:
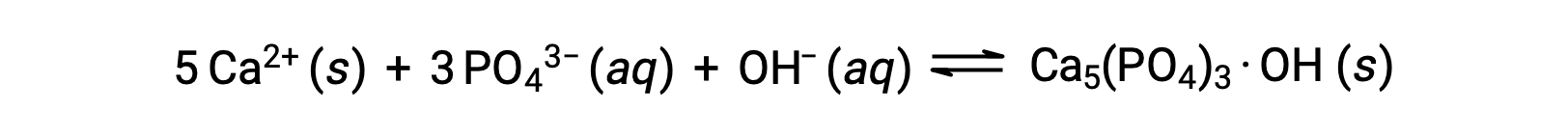
由于添加的钙离子的数量不会导致其他钙盐的溶解度生成物超过,因此这些盐的阴离子留在废水中。 然后通过过滤去除沉淀物,通过在再碳化过程中添加二氧化碳将水带回中性 pH 值。 其他化学品也可用于沉淀去除磷酸盐,包括氯化铁和硫酸铝。
本文改编自 Openstax, 化学 2e, 第15.1节:沉淀和溶解。
建议阅读
- Koubek, E. "Demonstration of the Common Ion Effect." Journal of chemical education 70, no. 2 (1993): 155.
- Amaral, L. F., I. R. Oliveira, R. Salomão, E. Frollini, and V. C. Pandolfelli. "Temperature and common-ion effect on magnesium oxide (MgO) hydration." Ceramics International 36, no. 3 (2010): 1047-1054.
- Cassens, Jan, Anke Prudic, Feelly Ruether, and Gabriele Sadowski. "Solubility of pharmaceuticals and their salts as a function of pH." Industrial & Engineering Chemistry Research 52, no. 7 (2013): 2721-2731.
Tags
Factors Affecting Solubility
Solubility
Ionic Compound
Solute
Solution
Common Ion Effect
PH Of A Solution
Lead(II) Chloride
Sodium Chloride
Ionization
Equilibrium
Undissociated Salt
Concentration
Molar Solubility