16.11:
Факторы, влияющие на растворимость
16.11:
Факторы, влияющие на растворимость
По сравнению с чистой водой растворимость ионного соединения меньше в водных растворах, содержащих общий ион (который также образуется при растворении ионного соединения). Это пример явления, известного как общий ион-эффект, который является следствием закона массового действия, который можно объяснить с помощью принципа Le Chȃtelier. Рассмотрим растворение йодида серебра:
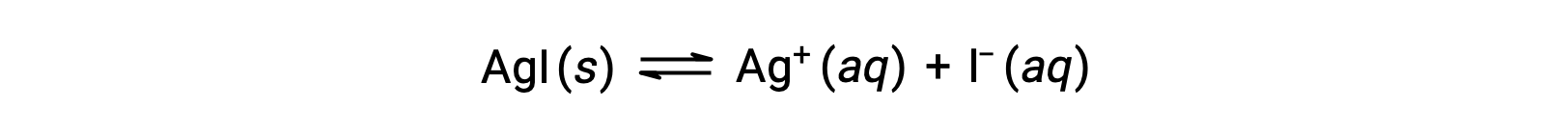
Это равновесие растворимости может быть смещено влево за счет добавления ионов серебра или йодида, что приведет к осадкам AGI и снижению концентраций растворенных AG+ и I–. В растворах, которые уже содержат один из этих ионов, меньше AGI может быть растворено, чем в растворах без этих ионов.
Этот эффект также можно объяснить в терминах массового действия, как показано в выражении продукта растворимости:
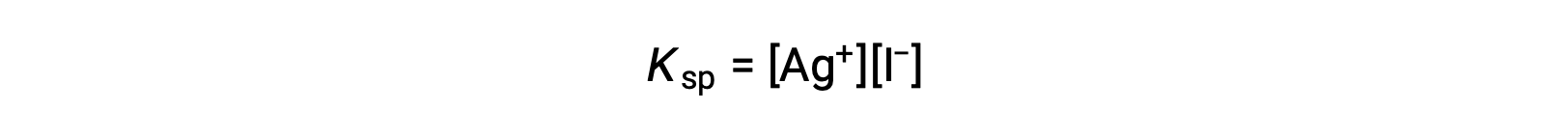
Математическое произведение серебряных и иодид ионных благотворительности является постоянным в равновесной смеси независимо от источника ионов, поэтому увеличение концентрации одного иона должно быть сбалансировано пропорциональным уменьшением другого.
Роль осадков в очистке сточных вод
Равновесие растворимости — это полезные инструменты для очистки сточных вод, которые могут использоваться в городских или городских водоемах. В частности, селективные осадки используются для удаления загрязняющих веществ из сточных вод до их возвращения в природные водоемы. Например, ионы фосфата (PO43) часто присутствуют в воде, сбрасываемых с производственных объектов. Обилие фосфатов вызывает рост избытка водорослей, что влияет на количество кислорода, доступного для морской жизни, а также делает воду непригодной для потребления человеком.
Одним из распространенных способов удаления фосфатов из воды является добавление гидроксида кальция, или извести, Ca(OH)2. По мере того как вода становится более базовой, ионы кальция вступают в реакцию с ионами фосфатов для получения гидроксилапатита CA5(PO4)3·OH, который затем выпадает из раствор:
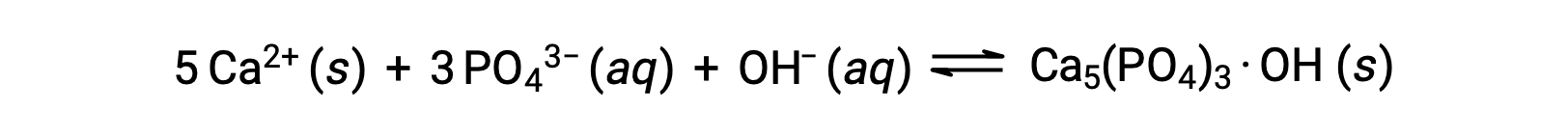
Поскольку количество добавляемого ионов кальция не приводит к превышению растворимых продуктов для других солей кальция, анионы этих солей остаются в сточных водах. После этого осадок удаляется фильтрацией, и вода возвращается к нейтральному рН путем добавления CO2 в процесс очистки. Другие химические вещества могут также использоваться для удаления фосфатов осадками, включая хлорид железа(III) и сульфат алюминия.
Этот текст адаптирован из Openstax, Химия 2е изд., раздел 15.1: Осадки и растворение.
Suggested Reading
- Koubek, E. "Demonstration of the Common Ion Effect." Journal of chemical education 70, no. 2 (1993): 155.
- Amaral, L. F., I. R. Oliveira, R. Salomão, E. Frollini, and V. C. Pandolfelli. "Temperature and common-ion effect on magnesium oxide (MgO) hydration." Ceramics International 36, no. 3 (2010): 1047-1054.
- Cassens, Jan, Anke Prudic, Feelly Ruether, and Gabriele Sadowski. "Solubility of pharmaceuticals and their salts as a function of pH." Industrial & Engineering Chemistry Research 52, no. 7 (2013): 2721-2731.
