16.11:
Factores que Afectan la Solubilidad
16.11:
Factores que Afectan la Solubilidad
En comparación con el agua pura, la solubilidad de un compuesto iónico es menor en soluciones acuosas que contienen un ion común (uno también producido por disolución del compuesto iónico). Este es un ejemplo de un fenómeno conocido como el efecto del ion común, que es una consecuencia de la ley de acción de masas que puede explicarse utilizando el principio de Le Châtelier. Considere la disolución del yoduro de plata:
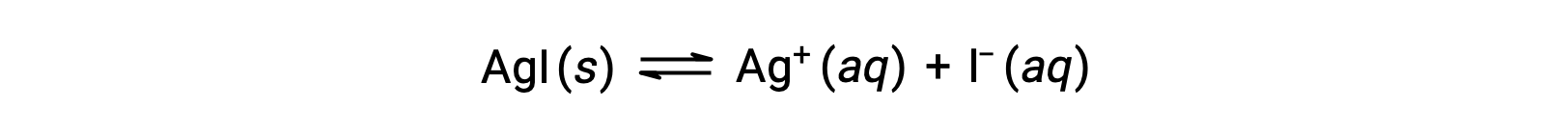
Este equilibrio de solubilidad puede ser desplazado hacia la izquierda por la adición de iones de plata o yoduro, resultando en la precipitación del AgI y concentraciones reducidas de Ag+ y I– disueltos. En soluciones que ya contienen cualquiera de estos iones, se puede disolver menos AgI que en soluciones sin estos iones.
Este efecto también puede explicarse en términos de acción de masas, tal como se representa en la expresión del producto de solubilidad:
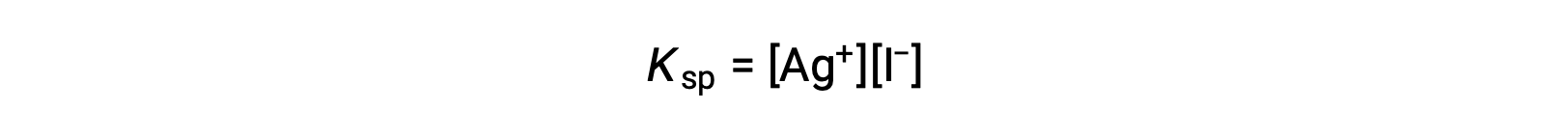
En una mezcla en equilibrio, el producto matemático de las molaridades de los iones de plata y yoduro es constante, independientemente de la fuente de los iones, por lo que un aumento de la concentración de un ión debe equilibrarse con una disminución proporcional en el otro.
El papel de la precipitación en el tratamiento de las aguas residuales
Los equilibrios de solubilidad son herramientas útiles en el tratamiento de las aguas residuales realizado en instalaciones que pueden tratar el agua municipal en una ciudad o un pueblo. Específicamente, la precipitación selectiva se utiliza para eliminar contaminantes de las aguas residuales antes de que sean liberadas nuevamente a cuerpos de agua naturales. Por ejemplo, los iones fosfato (PO43−) suelen estar presentes en el agua servida de las fabricas. La abundancia de fosfato hace que crezca un exceso de algas, lo que afecta la cantidad de oxígeno disponible para la vida marina y hace que el agua no sea apta para el consumo humano.
Una forma común de eliminar los fosfatos del agua es mediante la adición de hidróxido de calcio, o cal, Ca(OH)2. A medida que el agua se hace más básica, los iones de calcio reaccionan con los iones fosfato para producir hidroxiapatita, Ca5(PO4)3·OH, que luego precipita fuera de la solución:
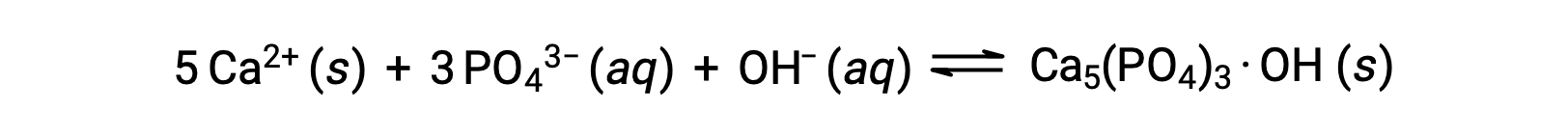
Debido a que la cantidad de ion calcio añadido no excede los productos de solubilidad de otras sales de calcio, los aniones de esas sales permanecen en las aguas residuales. El precipitado se elimina luego por filtración, y el agua vuelve a un pH neutro mediante la adición de CO2 en un proceso de descarbonización. También se pueden utilizar otros productos químicos para la eliminación de fosfatos mediante precipitación, incluyendo el cloruro de hierro (III) y el sulfato de aluminio.
Este texto es adaptado de Openstax, Química 2e, Sección 15.1: Precipitación y Disolución.
Suggested Reading
- Koubek, E. "Demonstration of the Common Ion Effect." Journal of chemical education 70, no. 2 (1993): 155.
- Amaral, L. F., I. R. Oliveira, R. Salomão, E. Frollini, and V. C. Pandolfelli. "Temperature and common-ion effect on magnesium oxide (MgO) hydration." Ceramics International 36, no. 3 (2010): 1047-1054.
- Cassens, Jan, Anke Prudic, Feelly Ruether, and Gabriele Sadowski. "Solubility of pharmaceuticals and their salts as a function of pH." Industrial & Engineering Chemistry Research 52, no. 7 (2013): 2721-2731.
