18.2:
القوة الدافعة الكهربائية
18.2:
القوة الدافعة الكهربائية
تتولد الكهرباء إما عن طريق إلكترونات أو أيونات تتدفق عبر محلول أو وسيط موصل. ويعرف هذا التدفق للإلكترونات أو الشحنة الكهربائية تحديدًا على أنه تيار كهربائي. عندما تتحرك الإلكترونات عبر سلك ، فإنها تولد تيارًا كهربائيًا. يمكن أن نتذكر أنه في تفاعل الأكسدة والاختزال ، تُفقد الإلكترونات وتُكتسب. في تفاعل الأكسدة والاختزال العفوي للزنك مع النحاس، عندما ينغمس الزنك في محلول أيون النحاس ، يتم نقل الإلكترونات من مادة واحدة إلى يحدث آخر.
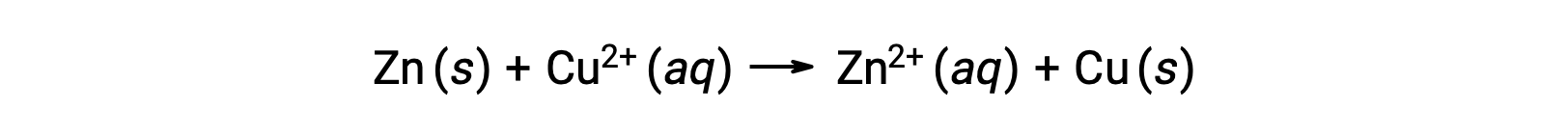
يتأكسد الزنك ، الذي يميل بشكل أكبر إلى فقد الإلكترونات ، إلى أيونات الزنك ، بينما يتم تقليل أيونات النحاس إلى نحاس صلب. ومع ذلك ، فإن هذا التفاعل لا يولد الكهرباء.
التيار الكهربائي وكيفية تدفق الإلكترونات
يحدث نقل الإلكترون مباشرة من عامل الاختزال إلى عامل مؤكسد في محلول. حتى إذا تم عزل مكونات نصف التفاعلات ماديًا في أوعية منفصلة ومتصلة عبر موصل خارجي مثل السلك ، فإن الميل لفقد الإلكترونات واكتسابها بواسطة المواد المتفاعلة لا يزال قائماً. ومع ذلك ، الآن ، تُجبر الإلكترونات على التدفق عبر السلك الذي يربط بين أنصاف ردود الفعل. يشكل تدفق الإلكترون عبر السلك تيارًا كهربائيًا ويمكنه تشغيل الأجهزة الإلكترونية ، مثل المصباح الكهربائي. يقاس التيار الكهربائي بالأمبير. أمبير واحد يساوي تدفق واحد كولوم من الشحنة الكهربائية في الثانية ويساوي6.24 × 10−18 إلكترون في الثانية.
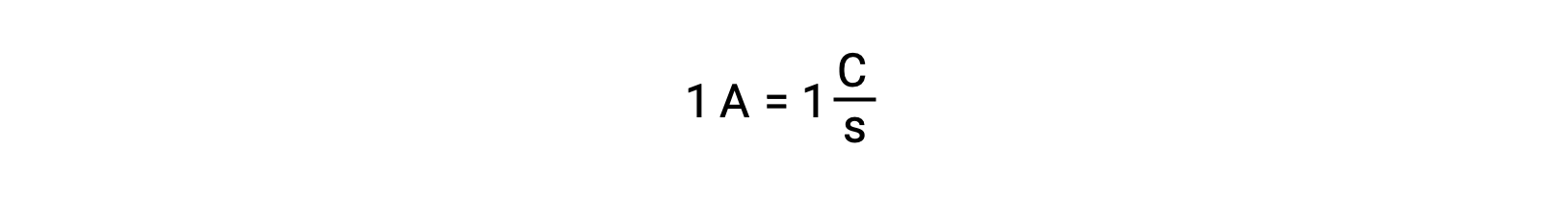
بما أن شحنة الإلكترون1.602 × 10−19 C, 1 أمبير يرتبط بتدفق 6.242 × 1018 إلكترونًا في الثانية.
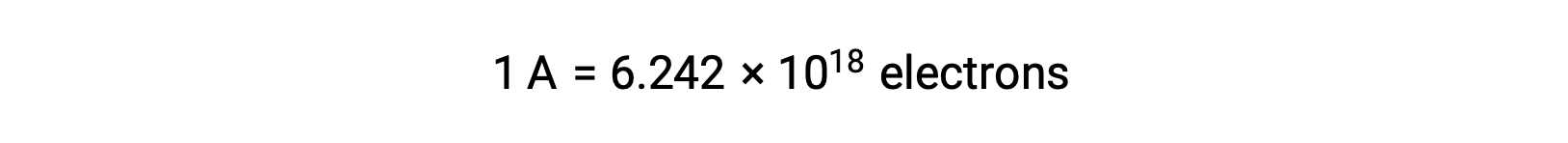
القوة الدافعة للتيار الكهربائي ، والفرق المحتمل ، وقوة القوة الدافعة
يشبه تدفق التيار الكهربائي تدفق المياه إلى أسفل الشلال. الماء مدفوع بالاختلاف في طاقة الجاذبية الكامنة ، في حين أن تدفق الإلكترونات مدفوع بفرق طاقة الوضع الكهربائي بين المواد المتفاعلة. يتم وصف هذا الاختلاف في طاقة الوضع الكهربائي إما بمصطلحات فرق الجهد أو القوة الدافعة الكهربائية (emf) أو جهد الخلية. emf هو مقياس للقوة الدافعة بين مفاعلين والميل إلى نقل الإلكترون.
بعض تفاعلات الأكسدة والاختزال عفوية ، والبعض الآخر ليس كذلك. على سبيل المثال ، يخضع السلك النحاسي لأكسدة تلقائية بواسطة أيونات الفضة (I) ، لكنه يفشل في إنتاج أي تفاعل عند غمره في محلول من أيونات الرصاص (II). يرجع ذلك إلى الاختلاف في نشاط الأكسدة والاختزال للنوعين Ag + ( aq ) و Pb 2+ ( aq ) نحو النحاس: يؤكسد أيون الفضة النحاس تلقائيًا ، لكن أيون الرصاص لا يؤكسد. يمكن قياس هذا الاختلاف في تفاعل الأكسدة والاختزال في الكيمياء الكهربائية باستخدام المصطلح & # 8216 ؛ جهد الخلية & # 8217 ؛؛ المعروف أيضًا باسم & # 8216 ؛ الجهد & # 8217 ؛.
يتم قياس جهد الخلية لاثنين من المتفاعلات المعزولة باستخدام مقياس الفولتميتر الذي يُقرأ بجهد الخلية. يرتبط فولت واحد بجول واحد من الطاقة الكامنة لكل كولوم من الشحنة الكهربائية.
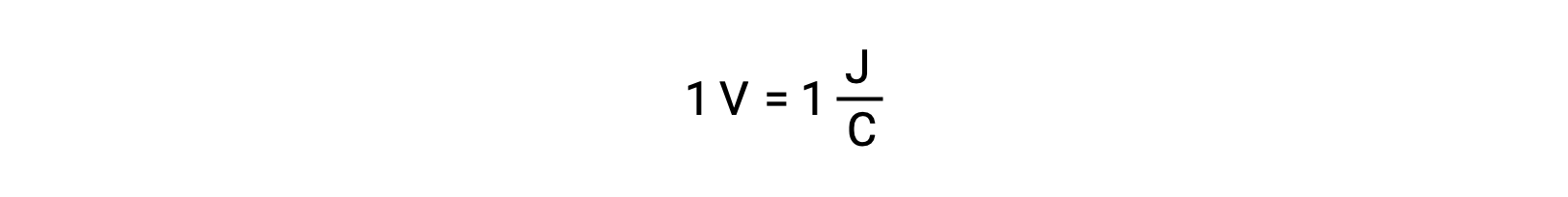
تشير إمكانات الخلية العالية إلى قوة دافعة كبيرة وسهولة أكبر في نقل الإلكترون. أخيرًا ، تعتمد القوة الدافعة الكهربائية ، أو جهد الخلية ، على المتفاعلات & # 8217 ؛ الطبيعة ودرجة حرارة التفاعل وتركيز الأيونات الموجودة في التفاعل.
هذا النص مقتبس من OpenStax, Chemistry 2e, Section 17.3: Electrode and Cell Potentials.
