18.2:
Fuerza Electromotriz
18.2:
Fuerza Electromotriz
La electricidad es generada por electrones o iones que fluyen a través de una solución o un medio conductor. Este flujo de electrones o específicamente de carga eléctrica se define como una corriente eléctrica. Cuando los electrones se mueven a través de un alambre, generan una corriente eléctrica. Se puede recordar que en una reacción redox, los electrones se pierden y se ganan. En la reacción redox espontánea del zinc con cobre, cuando el zinc se sumerge en una solución de iones de cobre, se produce una transferencia de electrones de una sustancia a otra.
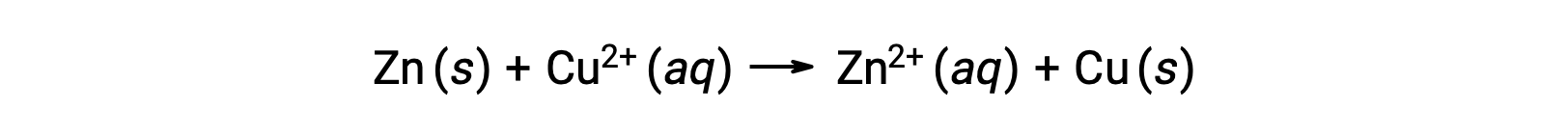
El zinc, que tiene una mayor tendencia a perder electrones, se oxida a iones de zinc, mientras que los iones de cobre se reducen a cobre sólido. Sin embargo, esta reacción no genera electricidad.
Corriente eléctrica y cómo fluyen los electrones
La transferencia de electrones se produce directamente desde un agente reductor a un agente oxidante en una solución. Incluso si los componentes de las semirreacciones están físicamente aislados en vasos separados y conectados a través de un conductor externo como un alambre, la tendencia a perder y ganar electrones por los reactantes persiste. Sin embargo, ahora, los electrones se ven forzados a fluir a través del alambre que conecta las dos semirreacciones. Este flujo de electrones a través del cable constituye una corriente eléctrica y puede alimentar aparatos electrónicos, como una bombilla. La corriente eléctrica se mide en amperios. Un amperio es igual al flujo de un coulomb de carga eléctrica por segundo y es igual a 6,24 × 10−18 electrones por segundo.
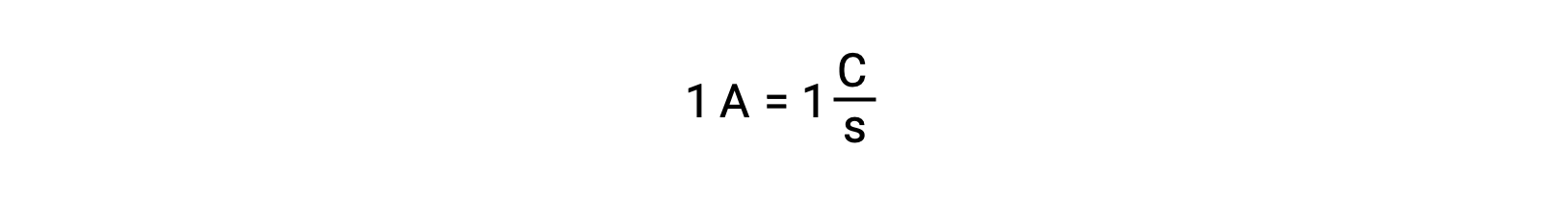
Dado que un electrón tiene una carga de 1,602 × 10−19 C, 1 amperio se correlaciona con el flujo de 6,242 × 1018 electrones por segundo.
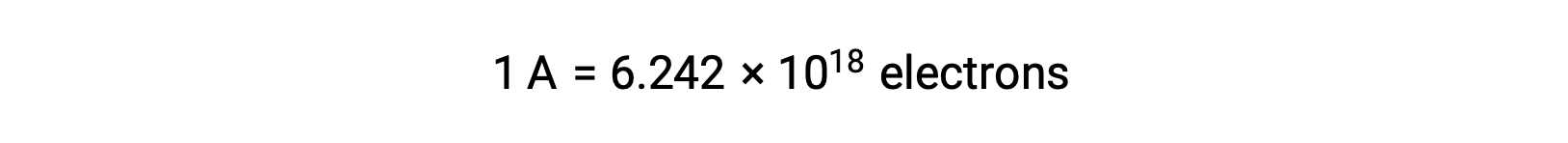
La fuerza impulsora para la corriente eléctrica, la diferencia de potencial y Emf
El flujo de corriente eléctrica es similar al agua que fluye por una cascada. El agua es impulsada por la diferencia en la energía potencial gravitacional, mientras que el flujo de electrones es impulsado por la diferencia en la energía potencial eléctrica entre los reactantes. Esta diferencia en la energía potencial eléctrica se describe ya sea por los términos diferencia de potencial, fuerza electromotriz (fem), o potencial de celda. La fem es una medida de la fuerza impulsora entre dos reactivos y la tendencia a la transferencia de electrones.
Algunas reacciones redox son espontáneas, mientras que otras no. Por ejemplo, un alambre de cobre sufre oxidación espontánea por iones de plata (I), pero no produce ninguna reacción cuando se sumerge en una solución de iones de plomo (II). Esto se debe a la diferencia en la actividad redox de las dos especies, Ag+ (ac) y Pb2+ (ac), hacia el cobre: El ion plata oxida espontáneamente el cobre, pero el ion plomo no. Esta diferencia en la reactividad redox en electroquímica puede cuantificarse utilizando el término ‘potencial de celda’; también conocido comúnmente como ‘voltaje’.
El potencial de celda de dos reactivos aislados se mide con un voltímetro, que se lee en voltaje de la celda. Un voltio se correlaciona con un joule de energía potencial por cada coulomb de carga eléctrica.
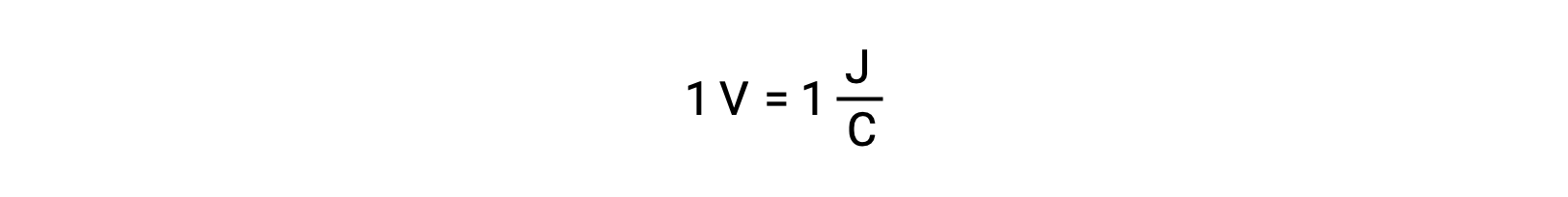
Un alto potencial de celda indica una gran fuerza impulsora y una mayor facilidad de transferencia de electrones. Por último, la fuerza electromotriz, o potencial de celda, depende de la naturaleza de los reactivos, de la temperatura de la reacción y de la concentración de los iones presentes en la reacción.
Este texto es adaptado de OpenStax, Química 2e, Sección 17.3: Potenciales de Electrodos y Celdas.
