18.2:
Elektromotor Kuvvet
18.2:
Elektromotor Kuvvet
Elektrik, bir çözelti veya iletken bir ortamdan akan elektronlar veya iyonlar tarafından üretilir. Bu elektron akışı veya özellikle elektrik yükü bir elektrik akımı olarak tanımlanır. Elektronlar bir tel boyunca hareket ettiğinde, bir elektrik akımı üretirler. Bir redoks reaksiyonunda elektronların kaybolduğu ve kazanıldığı hatırlanabilir. Çinkonun bakır ile spontan redoks reaksiyonunda, çinko bir bakır iyonu çözeltisine daldırıldığında, bir maddeden diğerine elektron transferi meydana gelir.
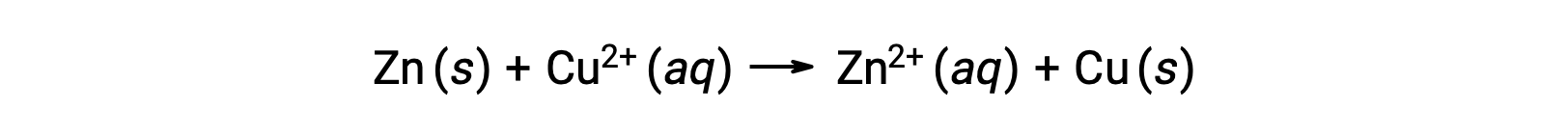
Elektronları kaybetme eğilimi daha yüksek olan çinko, çinko iyonlarına oksitlenirken, bakır iyonları katı bakıra indirgenir. Bununla birlikte, bu reaksiyon elektrik üretmez.
Elektronlar Nasıl Akar ve Elektrik Akımı
Elektron transferi doğrudan bir indirgeyici maddeden bir çözelti içindeki bir oksitleyici maddeye gerçekleşir. Yarı reaksiyonların bileşenleri fiziksel olarak ayrı kaplarda izole edilmiş ve bir tel gibi harici bir iletken vasıtasıyla bağlanmış olsa bile, reaktanların elektron kaybetme ve kazanma eğilimi hala devam etmektedir. Ancak, şimdi, elektronlar iki yarı reaksiyonu bağlayan telden akmaya zorlanır. Telden geçen bu elektron akışı bir elektrik akımı oluşturur ve bir ampul gibi elektronik cihazlara güç verebilir. Elektrik akımı amper cinsinden ölçülür. Bir amper, saniyede bir coulomb elektrik yükünün akışına eşittir ve saniyede 6,24 × 10−18 elektrona eşittir.
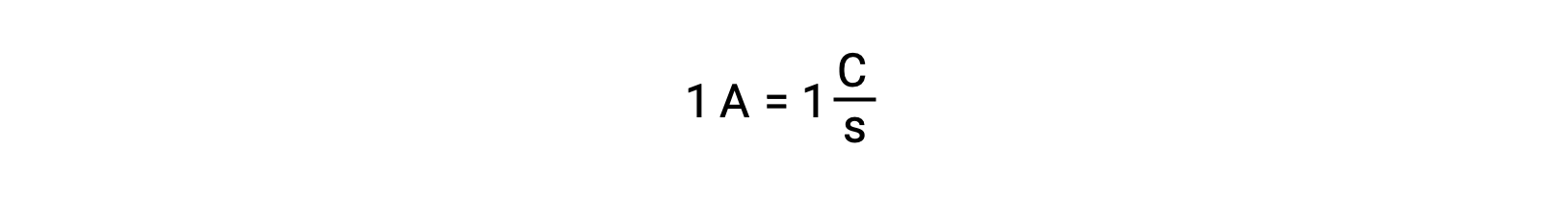
Bir elektron 1,602 × 10−19 C’lik bir yüke sahip olduğundan, 1 amper saniyede 6,242 × 1018 elektron akışı ile ilişkilidir.
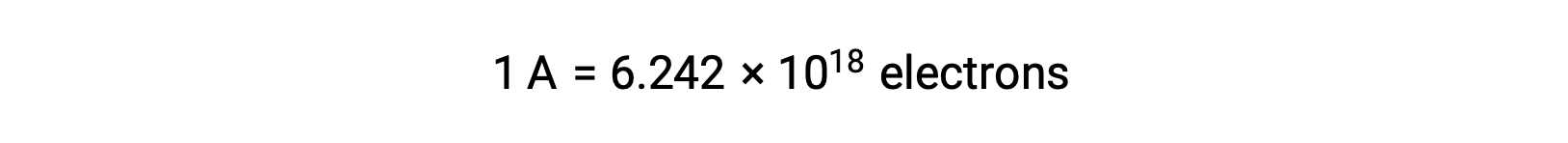
Elektrik Akımı için İtici Kuvvet, Potansiyel Fark ve Emf
Elektrik akımının akışı şelaleden akan suya benzer. Su, yerçekimsel potansiyel enerjideki farklılığa, elektronların akışı ise elektriksel potansiyel enerjinin reaktanlar arasındaki farklılığından kaynaklanır. Elektriksel potansiyel enerjideki bu fark, potansiyel fark, elektromotor kuvvet (emf) veya hücre potansiyeli terimleri ile tanımlanır. Emf, iki reaktif arasındaki itici kuvvetin ve elektron transferi eğiliminin bir ölçüsüdür.
Bazı redoks reaksiyonları spontandır, diğerleri ise değildir. Örneğin, bir bakır tel gümüş(I) iyonları tarafından kendiliğinden oksidasyona uğrar, ancak kurşun(II) iyonlarının bir çözeltisine daldırıldığında herhangi bir reaksiyon vermez. Bu, iki türün, Ag+ (aq) ve Pb+2 (aq)’nin bakıra karşı redoks aktivitesindeki farktan kaynaklanmaktadır: gümüş iyonu kendiliğinden bakırı okside eder, ancak kurşun iyonu oksitlemez. Elektrokimyada redoks reaktivitesindeki bu fark, ‘hücre potansiyeli’ terimi kullanılarak ölçülebilir; yaygın olarak ‘voltaj’ olarak da bilinir.
İki izole reaktan hücre potansiyeli, hücre voltajında okunan bir voltmetre ile ölçülür. Bir volt, bir coulomb elektrik yükü başına bir joule potansiyel enerji ile ilişkilidir.
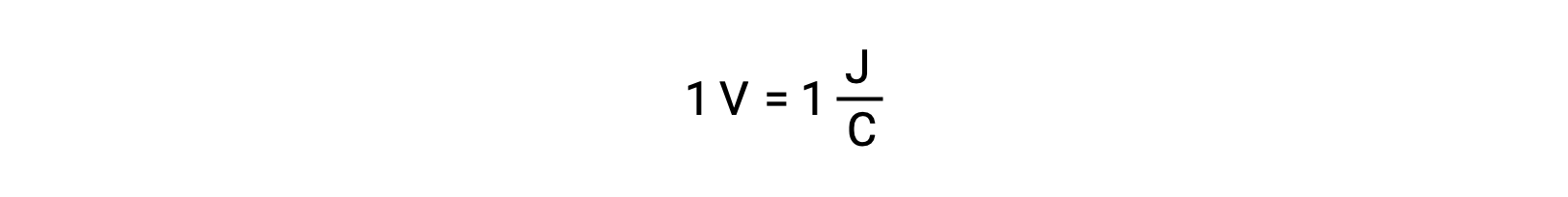
Yüksek bir hücre potansiyeli, büyük bir itici kuvveti ve daha fazla elektron transferi kolaylığını gösterir. Son olarak, elektromotor kuvvet veya hücre potansiyeli, reaktanların doğasına, reaksiyon sıcaklığına ve reaksiyonda bulunan iyonların konsantrasyonuna bağlıdır.
Bu metin bu kaynaktan uyarlanmıştır: OpenStax, Chemistry 2e, Section 17.3: Electrode and Cell Potentials.
