18.2:
Forza elettromotiva
18.2:
Forza elettromotiva
L’elettricità è generata da elettroni o ioni che fluiscono attraverso una soluzione o un mezzo conduttore. Questo flusso di elettroni o carica specificamente elettrica è definito come una corrente elettrica. Quando gli elettroni si muovono attraverso un filo, generano una corrente elettrica. Si può ricordare che in una reazione redox, gli elettroni vengono persi e guadagnati. Nella reazione redox spontanea dello zinco con il rame, quando lo zinco è immerso in una soluzione di ioni di rame, si verifica un trasferimento di elettroni da una sostanza all’altra.
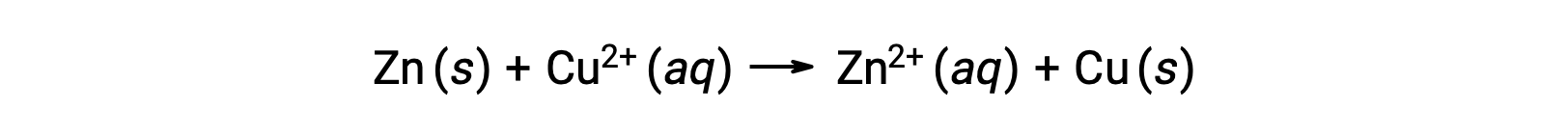
Lo zinco, con una maggiore tendenza a perdere elettroni, viene ossidato in ioni di zinco, mentre gli ioni di rame sono ridotti al rame solido. Tuttavia, questa reazione non genera elettricità.
Corrente elettrica e come scorrono gli elettroni
Il trasferimento di elettroni avviene direttamente da un agente riducente a un agente ossidante in una soluzione. Anche se i componenti delle mezze reazioni sono fisicamente isolati in vasi separati e collegati tramite un conduttore esterno come un filo, persiste ancora la tendenza a perdere e guadagnare elettroni da parte dei reagenti. Tuttavia, ora, gli elettroni sono costretti a fluire attraverso il filo che collega le due mezze reazioni. Questo flusso di elettroni attraverso il filo costituisce una corrente elettrica e può alimentare elettrodomestici elettronici, come una lampadina. La corrente elettrica viene misurata in ampere. Un ampere è uguale al flusso di un coulomb di carica elettrica al secondo ed è uguale a 6,24 × 10−18 elettroni al secondo.
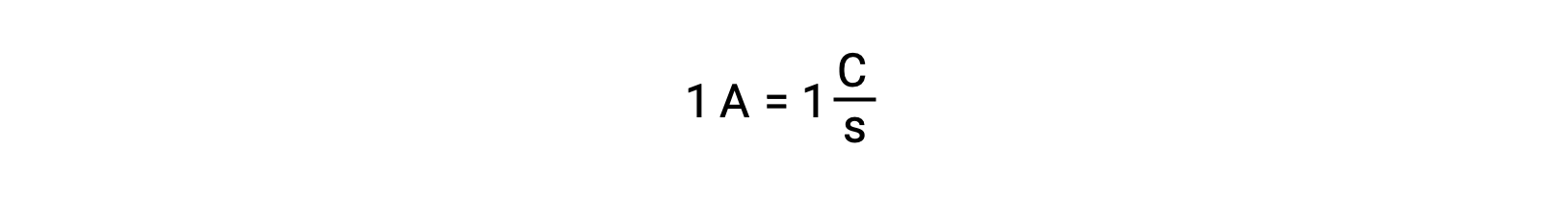
Poiché un elettrone ha una carica di 1,602 × 10−19 C, 1 ampere è correlato al flusso di 6.242 × 1018 elettroni al secondo.
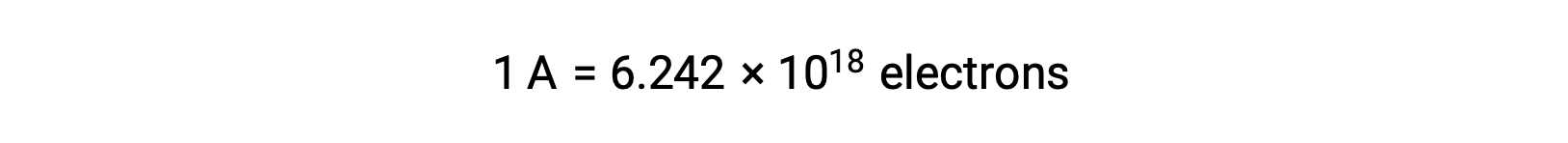
Forza motrice per corrente elettrica, differenza potenziale ed Emf
Il flusso di corrente elettrica è simile all’acqua che scorre lungo una cascata. L’acqua è guidata dalla differenza nell’energia potenziale gravitazionale, mentre il flusso di elettroni è guidato dalla differenza dell’energia potenziale elettrica tra i reagenti. Questa differenza nell’energia potenziale elettrica è descritta dai termini differenza di potenziale, forza elettromotrice (emf) o potenziale cellulare. L’emf è una misura della forza motrice tra due reagenti e della tendenza al trasferimento di elettroni.
Alcune reazioni redox sono spontanee, mentre altre no. Ad esempio, un filo di rame subisce un’ossidazione spontanea da parte di ioni d’argento(I), ma non riesce a produrre alcuna reazione quando è immerso in una soluzione di ioni di piombo(II). Ciò è dovuto alla differenza nell’attività redox delle due specie, Ag+ (aq) e Pb2+ (aq), verso il rame: lo ione argentato ossida spontaneamente il rame, ma lo ione piombo no. Questa differenza di reattività redox nell’elettrochimica può essere quantificata usando il termine “potenziale cellulare”; comunemente noto anche come “tensione”.
Il potenziale cellulare di due reagenti isolati è misurato con un voltmetro, che viene letto in tensione cellulare. Un volt è correlato a un joule di energia potenziale per un coulomb di carica elettrica.
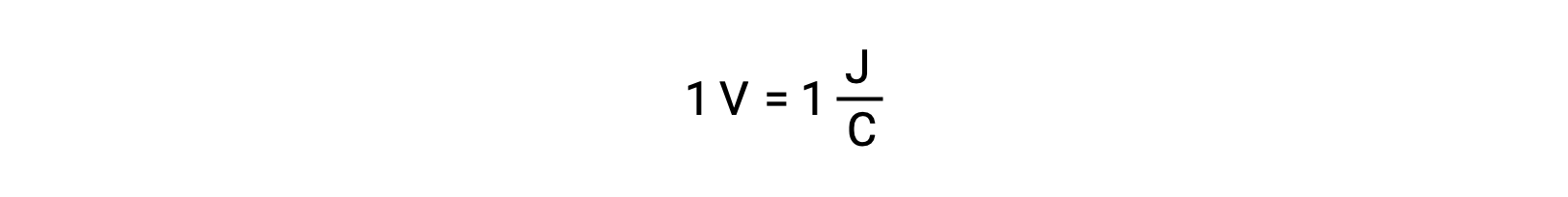
Un alto potenziale cellulare indica una grande forza motrice e una maggiore facilità di trasferimento degli elettroni. Infine, la forza elettromotrice, o potenziale cellulare, dipende dalla natura dei reagenti, dalla temperatura di reazione e dalla concentrazione di ioni presenti nella reazione.
Questo testo è adattato da OpenStax, Chemistry 2e, Sezione 17.3: Elettrodi e potenziali cellulari.
