18.3:
Piles électrochimiques
18.3:
Piles électrochimiques
Réactions chimiques spontanées
Les réactions spontanées d’oxydoréduction se produisent abondamment dans la nature. La réaction chimique qui se produit dans une pile AA jetable alimentant nos télécommandes est un exemple de réaction d’oxydoréduction spontanée. Un autre exemple est l’immersion d’un fil de cuivre enroulé dans une solution aqueuse de nitrate d’argent. La réaction révèle un changement de couleur graduel et visuellement impressionnant, passant de l’incolore au bleu vif, ainsi que la formation d’un précipité gris sur le fil de cuivre. Dans cette expérience, le cuivre subit une oxydation pour former des ions cuivreux, ce qui rend la solution bleue, tandis que les ions argent sont réduits pour former un précipité d’argent sur le fil.
La réaction peut être résumée comme suit :
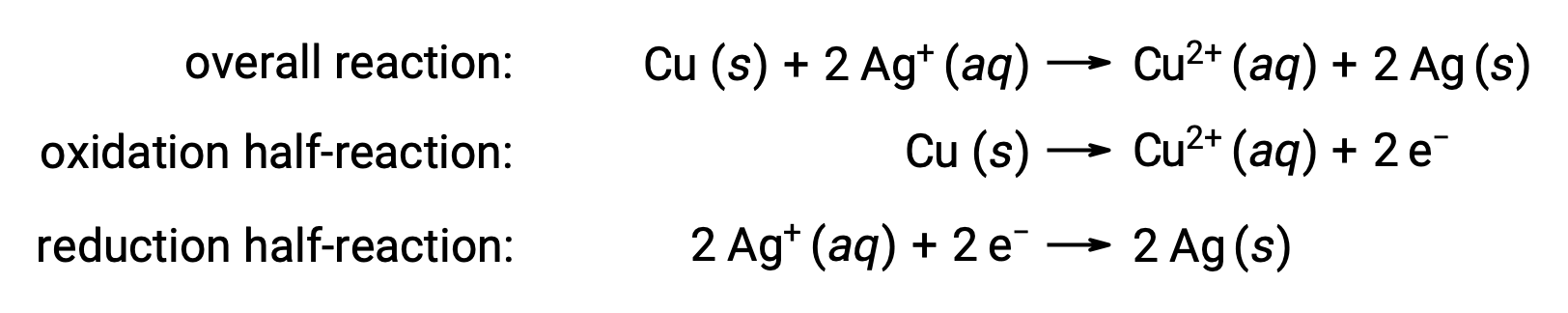
Ici, il y a un transfert direct et spontané des électrons du fil de cuivre vers les ions argent aqueux.
Cellules électrochimiques et cellules galvaniques
Supposons qu’un dispositif contient tous les réactifs et produits d’un système redox, mais empêche tout contact physique entre les réactifs. Par conséquent, le transfert direct d’électrons est empêché ; au lieu de cela, il se produit indirectement par le biais d’un circuit externe qui entre en contact avec les réactifs séparés. Les dispositifs de ce type sont généralement appelés des cellules électrochimiques.
Une cellule électrochimique est un instrument dans lequel un courant électrique est généré par une réaction redox sans qu’il n’y ait de contact direct entre les atomes réagissant. Les cellules électrochimiques dans lesquelles un courant est créé en raison d’une réaction d’oxydoréduction spontanée sont connues sous le nom de cellules galvaniques ou voltaïques (nommées d’après Luigi Galvani et Alessandro Volta).
Composants d’une cellule galvanique
Une cellule galvanique basée sur la réaction spontanée entre le cuivre et l’argent(I) est représentée dans la figure 1. Une cellule galvanique typique se compose de deux demi-cellules, chacune contenant la paire ou le couple d’oxydant-réducteur conjugués d’un seul réactif. La demi-cellule de gauche contient le couple Cu(0)/Cu(II) sous la forme d’une feuille de cuivre solide et d’une solution aqueuse de nitrate de cuivre. La demi-cellule de droite contient le couple Ag(I)/Ag(0) sous forme de feuille d’argent solide et une solution aqueuse de nitrate d’argent. Un circuit externe est connecté à chaque demi-cellule au niveau de sa feuille solide, ce qui signifie que les feuilles de Cu et d’Ag fonctionnent chacune comme une électrode. La réaction se produit à l’interface entre le mélange réactionnel de chaque demi-cellule et son électrode respective. L’anode est l’électrode à laquelle se produit l’oxydation et elle porte une charge négative, tandis que la cathode est l’électrode à laquelle se produit la réduction et elle porte une charge positive.
Les deux demi-cellules sont reliées par un pont salin, qui est un tube en U inversé contenant un gel ou une pâte d’un électrolyte inerte comme le chlorure de potassium ou le nitrate d’ammonium. Le pont de sel aide à maintenir les mélanges de réaction séparés tout en assurant l’équilibre des charges de la réaction. La réaction spontanée dans cette cellule produit des cations Cu2+ dans la demi-cellule de l’anode et consomme des ions Ag+ dans la demi-cellule de la cathode, ce qui provoque un flux compensatoire d’ions inertes provenant du pont salin qui maintient l’équilibre des charges. Le pont salin fournit un flux d’ions inertes, assurant que la réaction se poursuit en neutralisant l’accumulation d’ions positifs et négatifs à l’anode et à la cathode. Par conséquent, les concentrations croissantes de Cu2+ dans la demi-cellule de l’anode sont équilibrées par un afflux de NO3− provenant du pont salin, tandis qu’un flux de Na+ dans la demi-cellule de la cathode compense la diminution de la concentration d’Ag+.
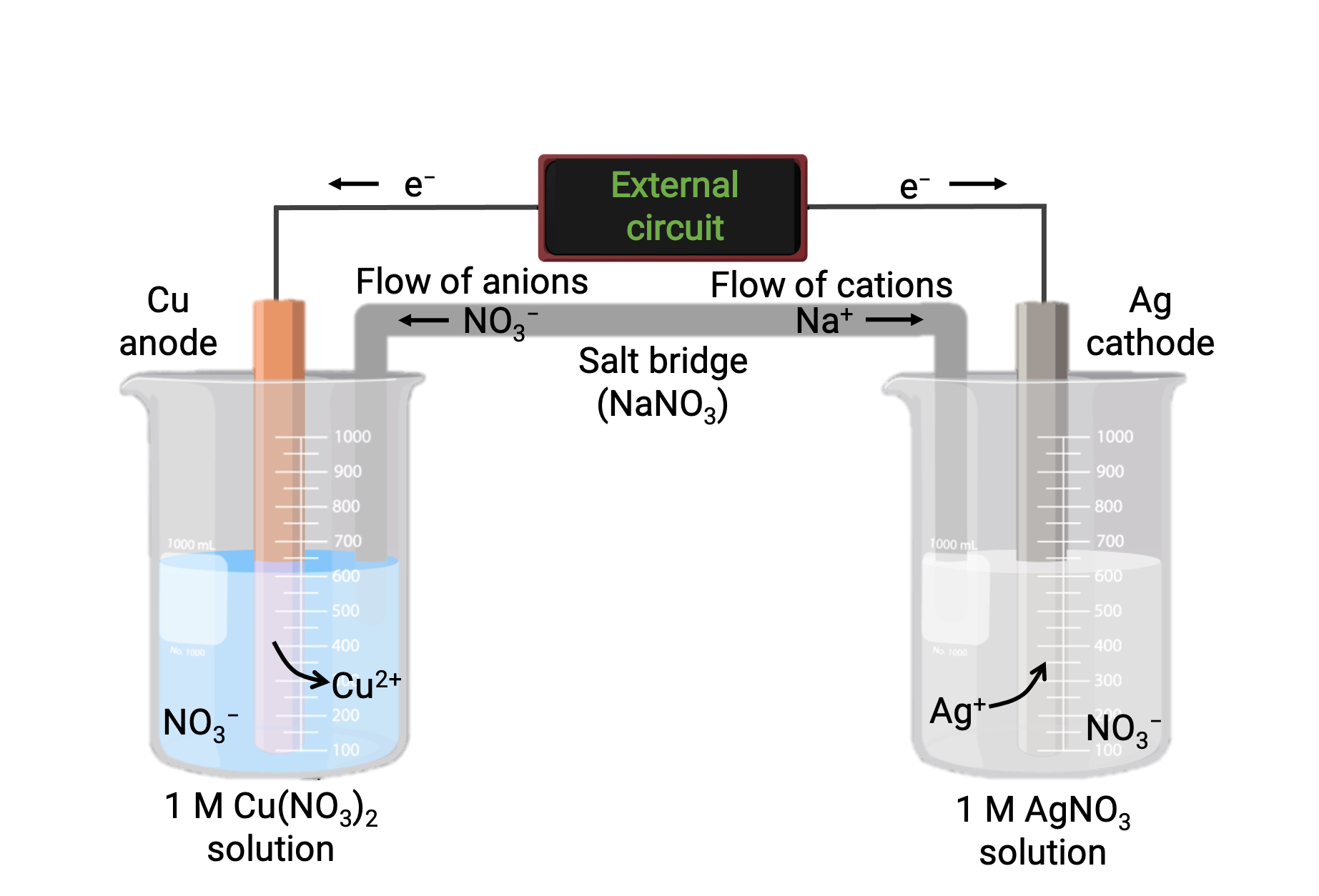
Figure 1 : cellule galvanique basée sur la réaction spontanée entre les ions cuivre et argent(I).
Représentation d’une cellule galvanique à l’aide de schémas de piles ou de notations de cellules
La cellule galvanique est représentée symboliquement à l’aide des schémas de piles ou des notations de cellules.
• Dans les schémas de piles, toutes les interfaces entre les phases des constituants sont représentées par des lignes verticales parallèles.
• Si deux ou plusieurs constituants se trouvent dans la même phase, ils sont séparés par des virgules dans la représentation.
• L’anode est représentée à gauche dans le schéma et la cathode à droite.
• Une double ligne verticale indique un pont salin ou une cloison poreuse entre les deux demi-réactions.
• par convention, le schéma commence par l’anode et se poursuit de gauche à droite, identifiant les phases et les interfaces rencontrées dans la cellule, en terminant par la cathode.
Par exemple, la cellule galvanique ci-dessus se compose d’une anode de cuivre solide immergée dans du nitrate de cuivre(II) aqueux relié par un pont salin à une solution aqueuse de nitrate d’argent(I) dans laquelle est immergée une cathode d’argent solide. La conversion en symbolisme de cet énoncé en suivant les directives ci-dessus conduit au schéma de pile :
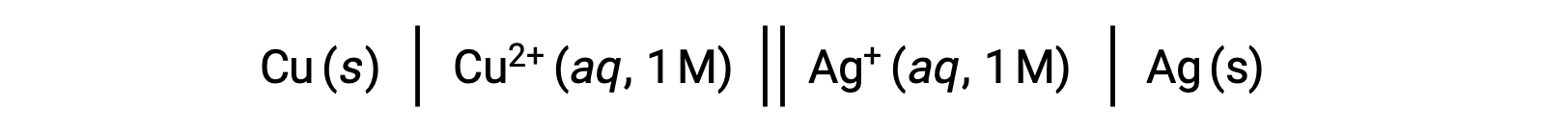
Ce texte est adapté de Openstax, Chimie 2e,17.2 Cellules galvaniques.
