18.3:
ガルバニ電池
18.3:
ガルバニ電池
自発的な化学反応
自然界には、自発的な酸化還元反応が数多く存在します。リモコンに使われている使い捨ての単三電池で起こる化学反応も、自発的な酸化還元反応の一例です。また、コイル状の銅線を硝酸銀の水溶液に浸すと、銅線が徐々に変化します。この反応では、無色から鮮やかな青色に徐々に変化し、灰色の沈殿物が形成されるという、見た目にも印象的な現象が見られます。この実験では、銅が酸化されて1価の銅イオンが生成されて溶液が青くなり、銀イオンが還元されて銅線に銀の析出物ができます。
上記の反応は以下のようにまとめられます。
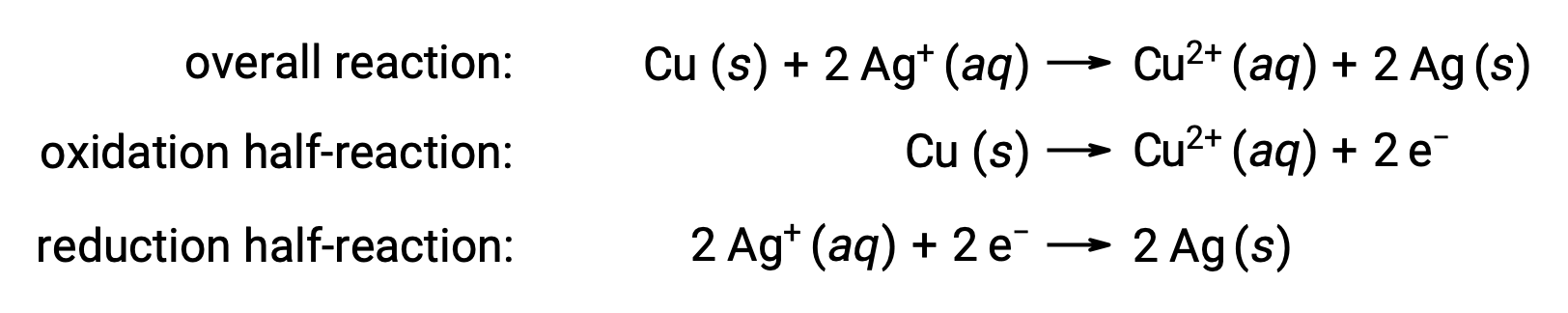
ここでは、銅線から水溶液中の銀イオンへの直接的かつ自発的に電子が移動しています。
電気化学電池とガルバニ電池
あるデバイスに酸化還元系のすべての反応物と生成物が入っていますが、反応物同士が物理的に接触しない状況を考えます。このとき、電子の直接的な移動は妨げられ、代わりに、分離した反応物に接触する外部回路を介して間接的に電子が移動します。このタイプのデバイスは、一般的に「電気化学電池」と呼ばれます。
電気化学電池とは、反応する原子が直接接触することなく、酸化還元反応によって電流を発生させるデバイスのことです。自発的な酸化還元反応によって電流が発生する電気化学電池は、ガルバニ電池やボルタ電池(ルイジ・ガルバニとアレッサンドロ・ボルタにちなんで命名)と呼ばれています。
ガルバニ電池の構成要素
Figure 1は、銅と銀(I)の自発的な反応を利用したガルバニ電池を示しています。典型的なガルバニ電池は、2つの半電池で構成されており、それぞれの半電池には、1つの反応物質の酸化還元共役ペアが入っています。左側の半電池には、固体の銅箔と硝酸銅の水溶液からなるCu(0)/Cu(II)の共役対が入っています。右側の半電池には、固体の銀箔と硝酸銀の水溶液からなるAg(I)/Ag(0)の共役対が入っています。それぞれの半電池には固体箔の部分に外部回路が接続されており、銅箔と銀箔がそれぞれ電極として機能します。反応は、各半電池の反応混合物とそれぞれの電極の界面で起こります。陽極は酸化が起こる電極で負の電荷を帯びており、陰極は還元が起こる電極で正の電荷を帯びています。
2つの半電池は、塩化カリウムや硝酸アンモニウムなどの不活性電解質のゲルやペーストを入れた逆U字管である塩橋によって接続されています。塩橋は、反応混合物を分離して反応の電荷バランスを保つために利用されます。この電池での自発的な反応により、陽極の半電池ではCu2+イオンが生成され、陰極の半電池ではAg+イオンが消費され、その後塩橋からの不活性イオン供給により電荷が補償されます。塩橋は不活性イオンを供給し、陽極と陰極に蓄積した正と負のイオンを中和して反応を継続させます。すなわち、陽極の半電池内で増加するCu2+の濃度は、塩橋からのNO3−の供給によって電荷補償され、一方、陰極の半電池内で減少するAg+の濃度は、塩橋からのNa+の供給によって電荷補償されます。
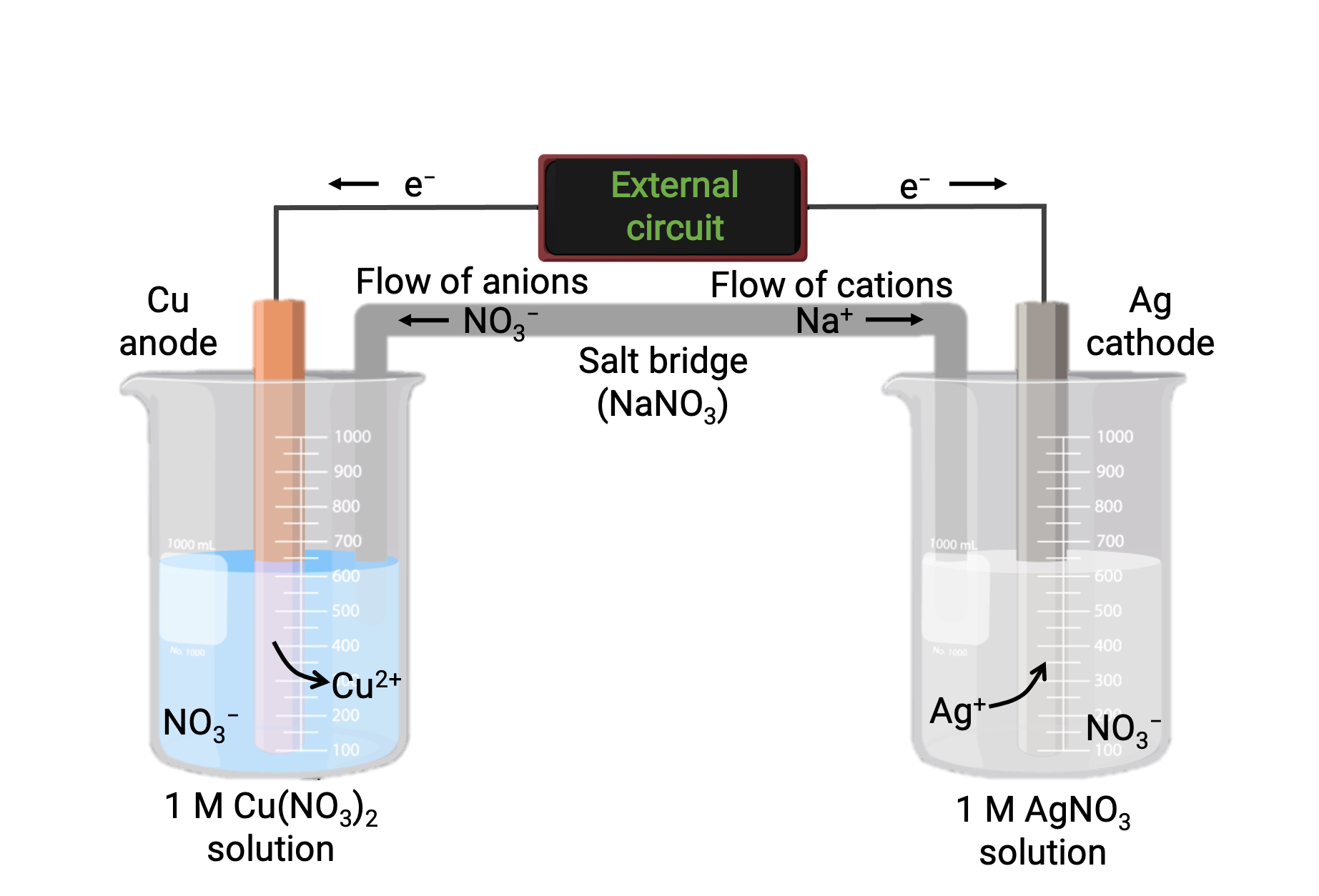
Figure 1:銅イオンと銀(I)イオンの自発的な反応を利用したガルバニ電池
回路図や電池表記法を用いたガルバニ電池の表式化
ガルバニ電池は、電池回路図や電池表記法を用いて表式化できます。
• 電池の回路図では、各相間のすべての要素を垂直の平行線で区切ります。
• 同一相に複数の構成要素が存在する場合、カンマで区切ります。
• 回路図の左側を陽極、右側を陰極とします。
• 二重の縦線は、2つの半反応の間にある塩橋または多孔質の仕切りを示します。
• 慣例的に、回路図は陽極から始まり、左から右へと進み、セル内の相と各構成要素を経由し、陰極で終わります。
例えば、上記のガルバニ電池は、固体の銅陽極が硝酸銅(II)水溶液に浸され、塩橋を介して固体の銀陰極が浸された硝酸銀(I)水溶液に接続されています。この文章を上記のガイドラインに沿って記号化すると、電池の回路図ができます。
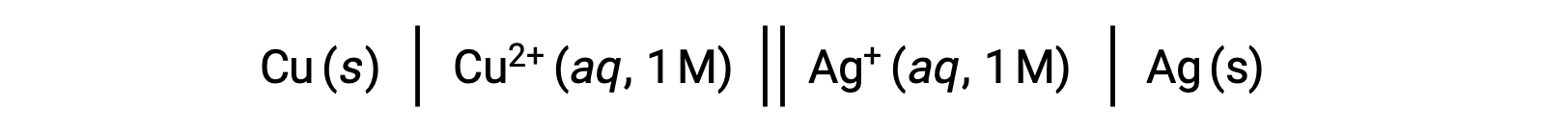
上記の文章は以下から引用しました。 Openstax, Chemistry 2e,17.2 Galvanic Cells.
