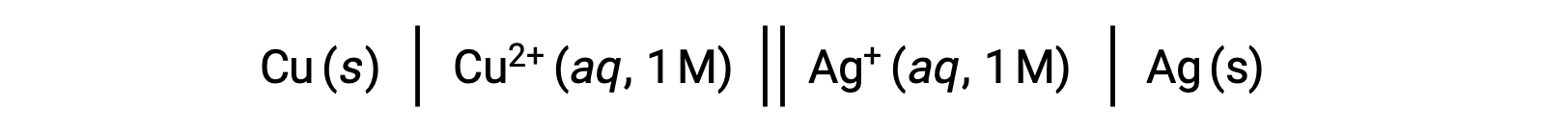18.3:
볼타 전지/갈바니 전지
18.3:
볼타 전지/갈바니 전지
자발적인 화학 반응
자연에서 자발적인 레독스 반응이 풍부하게 발생합니다. 리모컨에 전력을 공급하는 일회용 AA 배터리에서 발생하는 화학 반응은 자발적인 레독스 반응의 한 예입니다. 또 다른 예는 코일 구리 와이어를 수성 은 질산염 용액에 침수하는 것입니다. 반응은 무색에서 밝은 파란색으로 점진적이고 시각적으로 인상적인 색상 변화와 구리 와이어에 회색 침전물의 형성을 보여줍니다. 이 실험에서 구리는 산화를 거치어 용액을 파란색으로 렌더링하는 큐러스 이온을 형성하고 은 이온은 와이어에 은 침전을 형성하도록 감소합니다.
반응은 다음과 같이 요약할 수 있습니다.
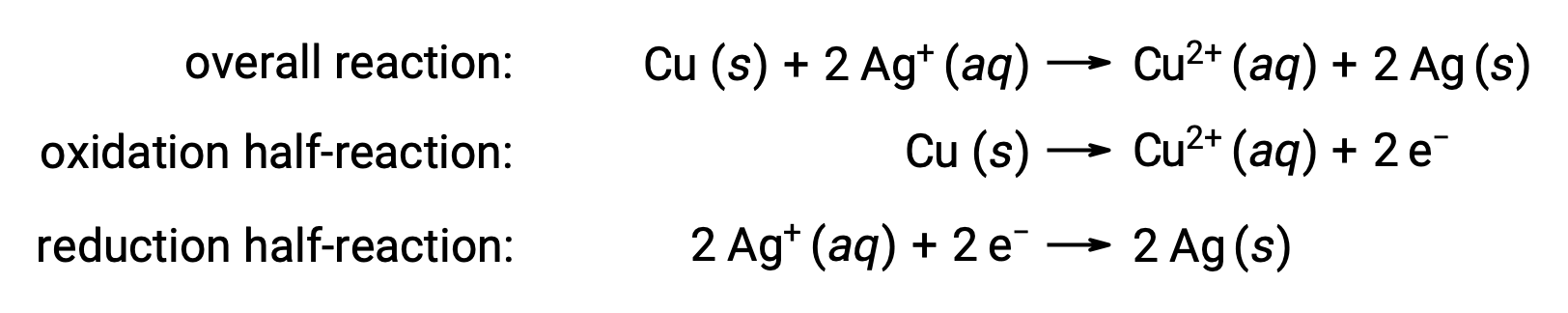
여기서, 구리 와이어에서 수성 은이온으로 전자의 직접적이고 자발적인 전달이 있다.
전기 화학 세포 및 갈바닉 세포
장치에 레독스 시스템의 모든 반응제와 제품이 포함되어 있지만 반응제 간의 물리적 접촉을 방지한다고 가정합니다. 따라서 전자의 직접 전달이 방지됩니다. 대신 분리된 반응체에 접촉하는 외부 회로를 통해 간접적으로 이루어집니다. 이 유형의 장치는 일반적으로 전기 화학세포라고합니다.
전기화학전지는 반응원자 사이의 직접적인 접촉 없이 레독스 반응에 의해 전류가 생성되는 기기이다. 자발적인 레독스 반응으로 인해 전류가 생성되는 전기 화학 세포는 갈바닉 또는 볼타이크 세포로 알려져 있습니다 (루이지 갈바니와 알레산드로 볼타의 이름을 따서 명명됨).
갈바닉 셀의 성분
구리와 은(I) 사이의 자발적인 반응을 기반으로 하는 갈바닉 세포가 도 1에 묘사된다. 전형적인 갈바닉 세포는 두 개의 반 세포로 구성되며, 각각 단일 반응제의 레독스 컨쥬게이트 쌍 또는 커플을 함유하고 있습니다. 왼쪽의 반셀에는 단단한 구리 호일 형태의 Cu(0)/Cu(II) 커플과 구리 질산염의 수성 용액이 포함되어 있습니다. 오른쪽 반셀에는 Ag(I)/Ag(0) 커플이 고체 실버 호일과 수성 은 질산염 용액이 포함되어 있습니다. 외부 회로는 고체 호일의 각 반셀에 연결되므로 Cu및 Ag 호일 각 함수를 전극으로 의미합니다. 반응은 각 반세포 반응 혼합물과 각각의 전극 사이의 인터페이스에서 발생합니다. 양극은 산화가 발생하는 전극이며 음전하를 운반하며 음극은 감소가 발생하는 전극이며 양전하를 부담합니다.
두 개의 반 세포는 염화칼륨 또는 질산 암모늄과 같은 불활성 전해질의 젤 또는 페이스트를 포함하는 반전된 U-tube인 소금 다리에 의해 연결됩니다. 소금 다리는 반응의 충전 균형을 보장하면서 반응 혼합물을 분리하는 데 도움이됩니다. 이 세포의 자발적인 반응은 양극 반 세포에서 Cu2+ 양이온을 생성하고 음극 반세포에서 Ag+ 이온을 소비하여 전하 균형을 유지하는 염교에서 불활성 이온의 보상 흐름을 초래합니다. 소금 다리는 불활성 이온의 흐름을 제공하여 양극과 음극에서 양성 및 음이온의 축적을 중화하여 반응이 계속되도록합니다. 따라서 양극 반 세포에서 Cu2+의 농도가 증가하면 염교에서 NO3−의 유입에 의해 균형을 이루고, 음극 반 세포로 Na+의 흐름은 감소Ag+ 농도를 보상합니다.
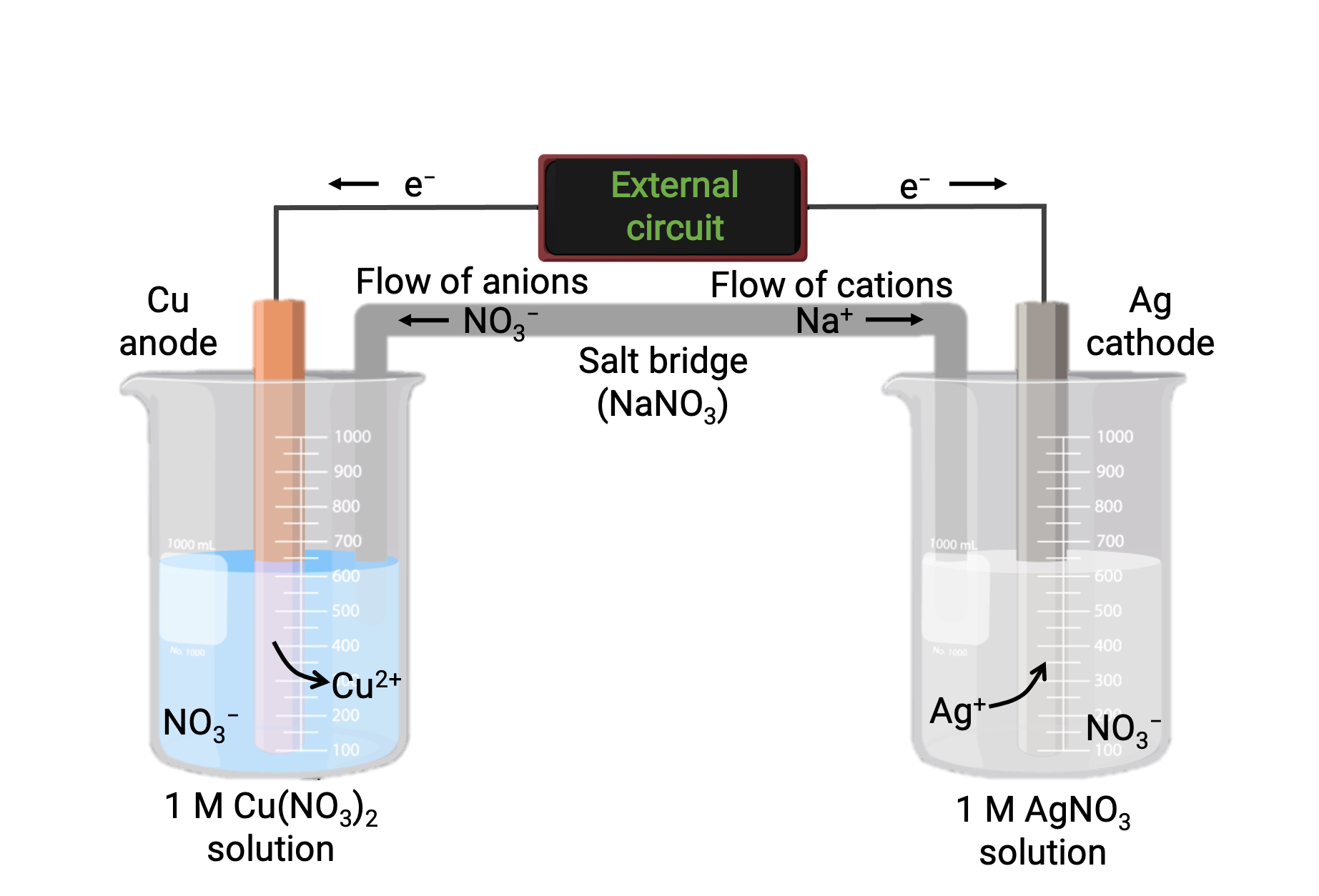
그림 1: 구리와 은(I) 이온 사이의 자발적인 반응을 기반으로 하는 갈바닉 셀.
세포 회로도 또는 세포 표기고를 사용하여 갈바닉 세포의 표현
갈바닉 세포는 세포 회로도 또는 세포 표기표를 사용하여 상징적으로 표현됩니다.
• 셀 회로도에서 구성 요소 단계 사이의 모든 인터페이스는 수직 병렬 선으로 표시됩니다.
• 두 개 이상의 구성 요소가 동일한 단계에 있는 경우 쉼표를 사용하여 표현에서 분리됩니다.
• 양극은 회로도의 왼쪽과 오른쪽에 음극을 나타낸다.
• 이중 수직 선은 두 반 반응 사이의 염교 또는 다공성 분할을 나타냅니다.
• 규칙에 의해, 회로도는 양극으로 시작하고 세포 내에서 발생하는 단계와 인터페이스를 식별, 왼쪽에서 오른쪽으로 진행, 음극으로 끝나는.
예를 들어, 상기 갈바닉 셀은 염교를 통해 연결된 수성 구리(II) 질산염에 침지된 고체 구리 양극으로 이루어져 있으며, 이는 고체 은 음극인 수성 은(I) 질산염 용액이다. 이 문체를 위의 지침에 따라 상징으로 변환하면 세포 회로도가 생성됩니다.