18.3:
Гальванические / гальванические элементы
18.3:
Гальванические / гальванические элементы
Спонтанные химические реакции
Спонтанные окислительно-восстановительные реакции происходят обильно в природе. Химическая реакция одноразовой батареи типа AA, питающей наши пульты дистанционного управления, является примером спонтанной окислительно-восстановительных реакций. Другим примером является погружение витой медной проволоки в водный нитрат серебра раствор. Реакция показывает постепенное, визуально впечатляющее изменение цвета с бесцветного на ярко-синий и образование серой осадки на медной проволоке. В этом эксперименте медь подвергается окислению, образуя дикобразы, которые делают раствор синей, в то время как ионы серебра редуцируются, образуя серебряный осадок на проволоке.
Реакция может быть резюмированы следующим образом:
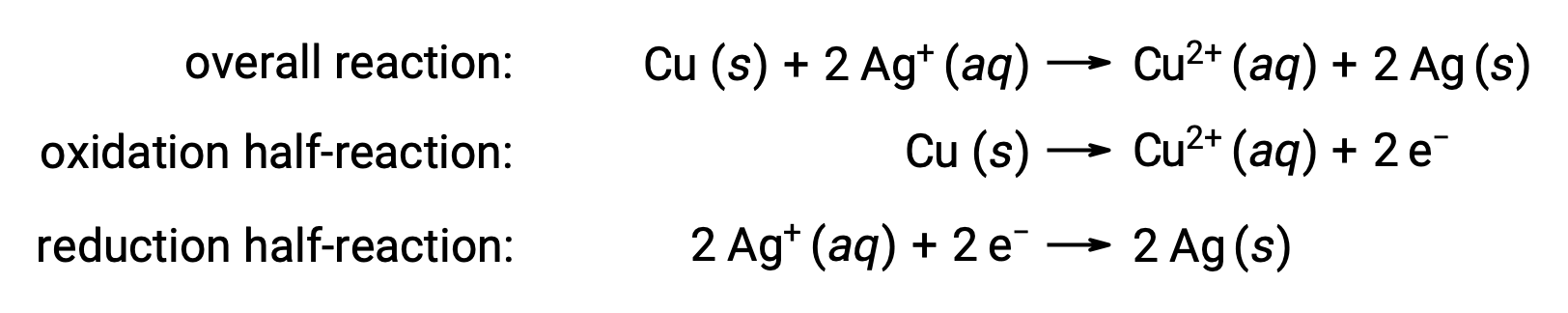
Здесь происходит прямая и спонтанная передача электронов от медной проволоки к водным ионам серебра.
Электрохимические клетки и галванские клетки
Предположим, что устройство содержит все реагенты и продукты системы ОВП, но не допускает физического контакта между реагенты. Таким образом, прямая передача электронов предотвращается; вместо этого она происходит косвенно через внешнюю цепь, которая контактирует с разделенным реагенты. Устройства такого типа обычно называются электрохимическими клетками.
Электрохимическая клетка — это инструмент, в котором электрический ток генерируется окислительно-восстановительных реакций без прямого контакта между реакционным атомами. Электрохимические клетки, в которых создается ток вследствие спонтанной окислительно-восстановительных реакций, известны как гальванические или вольтаические клетки (названные в честь Луиджи Галвани и Алессандро Вольта).
Компоненты галванской ячейки
Гальваническая ячейка, основанная на спонтанной реакции между медью и серебром(i), показана на рисунке 1. Типичная гальваническая ячейка состоит из двух полуячеек, каждая из которых содержит пары окислительно-восстановительных сопряжений, или пары, одного реагент. В полуклетке слева находится пара Cu(0)/Cu(II) в виде сплошной медной фольги и водного раствор из нитрата меди. Правая полуячейка содержит пару AG(I)/AG(0) как цельную серебряную фольгу и водный нитрат серебра раствор. Внешний контур подключается к каждой полуячейке на твердой фольге, что означает, что медная и AG фольга работает как электрод. Реакция происходит на стыке между каждой полуклеточной реакционной смесью и соответствующим электродом. Анод является электродом, при котором происходит окисление и он несёт отрицательный заряд, в то время как катод является электродом, при котором происходит снижение, и он несет положительный заряд.
Два полуэлемента соединены солевым мостом, который представляет собой перевернутую U-образную трубку, содержащую гель или пасту инертного электролита, например хлорид калия или нитрат аммония. Соляной мостик помогает сохранять реакционные смеси раздельными, обеспечивая при этом баланс заряда реакции. Спонтанная реакция в этой ячейке приводит к катиям Cu2+ в полуклетке анода и поглощает ионы AG+ в полуклетке катода, что приводит к компенсаторному потоку инертных ионов из соляного моста, который поддерживает баланс заряда. Соляной мост обеспечивает поток инертных ионов, обеспечивая продолжение реакции путем нейтрализации накопления положительных и отрицательных ионов на аноде и катоде. Таким образом, увеличение концентрации Cu2+ в полуклетке анода уравновешивается притоком No3– от солевого моста, а поток Na+ в полуклеточный катод компенсирует снижение концентрации AG+.
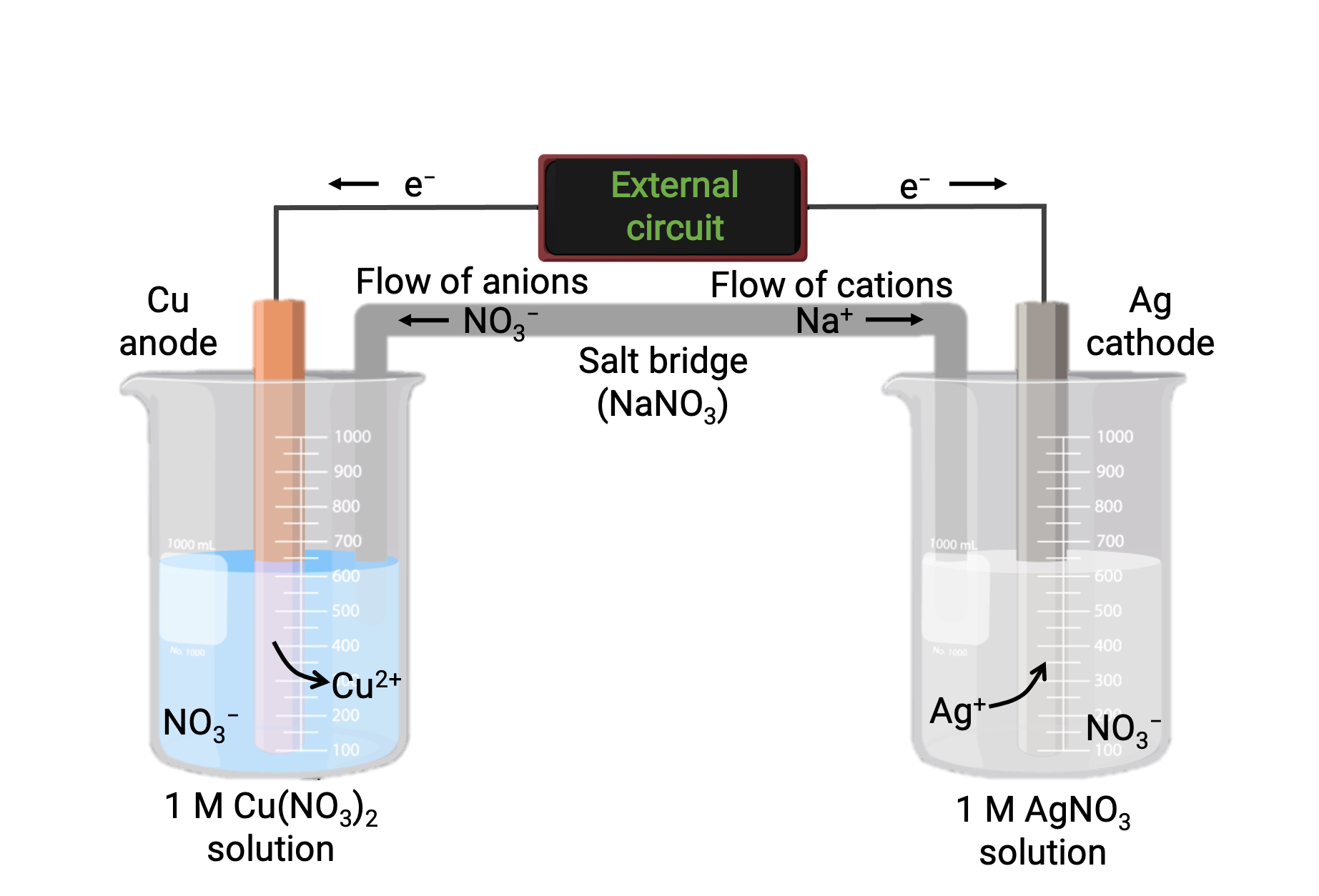
Рисунок 1: Гальваническая ячейка, основанная на спонтанной реакции между ионами меди и серебра(i).
Представление Galvanic Cell с использованием схем ячеек или обозначений ячеек
Гальваническая ячейка представлена символически с помощью схем ячеек или обозначений ячеек.
• на схемах ячеек все интерфейсы между фазами компонентов представлены вертикальными параллельными линиями.
• если на одной фазе существуют два или более компонентов, они разделяются запятыми.
• анод представлен слева от схемы, а катод — справа.
• двойная вертикальная линия обозначает соляной мостик или пористый раздел между двумя полуреакциями.
• по условному определению, схема начинается с анода и идет слева направо, идентифицируя фазы и интерфейсы, встречающиеся в клетке, заканчивающиеся катодом.
Например, вышеуказанная гальваническая ячейка состоит из твердотельного медного анода, погруженного в водный нитрат меди(II), соединенный через солевой мост с водным нитратом раствор, погруженным в который является твердым серебряным катодом. Преобразование этого утверждения в символизм в соответствии с приведенными выше инструкциями приводит к схематическому изображению клеток:
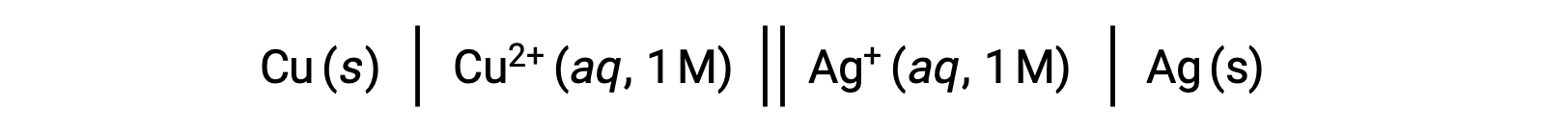
Этот текст адаптирован из Openstax, Химия 2е изд.,17.2 Галванских клеток.
