18.3:
Celdas Voltaicas/Galvánicas
18.3:
Celdas Voltaicas/Galvánicas
Reacciones químicas espontáneas
Las reacciones redox espontáneas ocurren abundantemente en la naturaleza. La reacción química que se produce en una pila AA desechable que alimenta nuestros controles remotos es un ejemplo de reacción redox espontánea. Otro ejemplo es la inmersión de alambre de cobre enrollado en una solución acuosa de nitrato de plata. La reacción muestra un cambio de color gradual, visualmente impresionante, de incoloro a azul brillante y la formación de un precipitado gris en el alambre de cobre. En este experimento, el cobre sufre oxidación para formar iones cuprosos, lo que hace que la solución sea azul, mientras que los iones de plata se reducen para formar un precipitado de plata en el alambre.
La reacción se puede resumir de la siguiente manera:
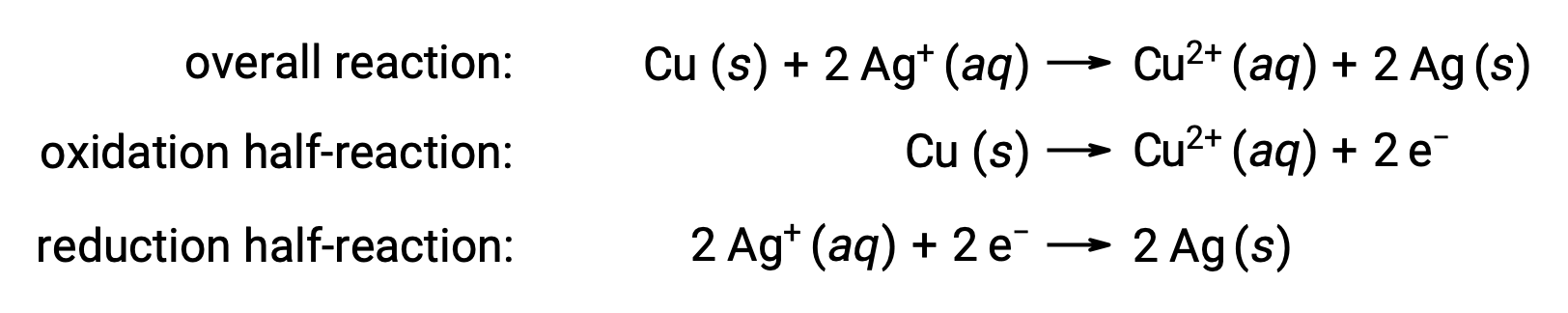
Aquí, hay una transferencia directa y espontánea de electrones desde el alambre de cobre a los iones acuosos de plata.
Celdas electroquímicas y celdas galvánicas
Supongamos que un dispositivo contiene todos los reactivos y productos de un sistema redox, pero evita el contacto físico entre los reactivos. Por lo tanto, se evita la transferencia directa de electrones; en su lugar, se produce indirectamente a través de un circuito externo que entra en contacto con los reactivos separados. Los dispositivos de este tipo se denominan generalmente celdas electroquímicas.
Una célula electroquímica es un instrumento en el cual una corriente eléctrica es generada por una reacción redox sin contacto directo entre los átomos que reaccionan. Las celdas electroquímicas en las que se crea una corriente debido a una reacción redox espontánea se conocen como celdas galvánicas o voltaicas (nombradas por Luigi Galvani y Alessandro Volta).
Componentes de una celda galvánica
En la Figura 1 se muestra una celda galvánica basada en la reacción espontánea entre cobre y plata (I). Una celda galvánica típica consta de dos medias celdas, cada una de las cuales contiene un par redox conjugado, o una pareja, de un solo reactivo. La media celda de la izquierda contiene el par Cu(0)/Cu(II) en forma de lámina de cobre sólida y una solución acuosa de nitrato de cobre. La media celda derecha contiene el par Ag(I)/Ag(0) como lámina de plata sólida y una solución acuosa de nitrato de plata. Se conecta un circuito externo a cada media celda en su lámina sólida, lo que significa que cada lámina de Cu y Ag funcionan como un electrodo. La reacción se produce en la interfaz entre la mezcla de reacción de cada celda y su respectivo electrodo. El ánodo es el electrodo en el que se produce la oxidación y tiene una carga negativa, mientras que el cátodo es el electrodo en el que se produce la reducción y tiene una carga positiva.
Las dos medias celdas están conectadas por un puente salino, que es un tubo en forma de U invertida que contiene un gel o pasta de un electrolito inerte como cloruro de potasio o nitrato de amonio. El puente salino ayuda a mantener separadas las mezclas de reacción, al tiempo que garantiza el equilibrio de carga de la reacción. La reacción espontánea en esta celda produce cationes Cu2 en la media celda del ánodo y consume iones Ag+ en la media celda del cátodo, lo que resulta en un flujo compensatorio de iones inertes del puente salino que mantiene el equilibrio de carga. El puente salino proporciona un flujo de iones inertes, asegurando que la reacción continúe neutralizando la acumulación de iones positivos y negativos en el ánodo y el cátodo. Por lo tanto, el aumento de las concentraciones de Cu2+ en la media celda del ánodo se equilibra mediante un influjo de NO3− desde el puente salino, mientras que un flujo de Na+ en la media celda del cátodo compensa la disminución de la concentración de Ag+.
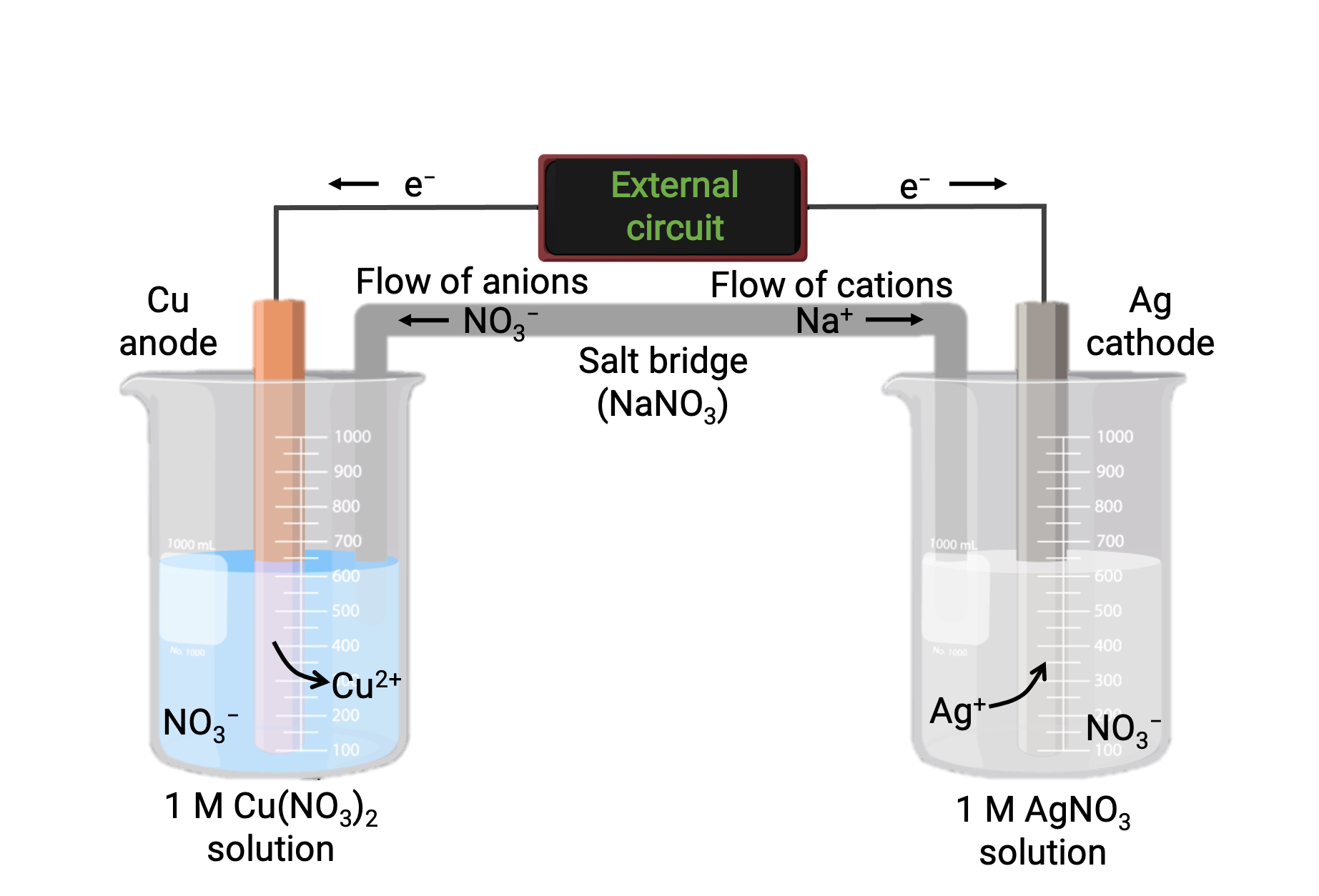
Figura 1: Una celda galvánica basada en la reacción espontánea entre los iones cobre y plata (I).
Representación de una celda galvánica mediante esquemas de celdas o notaciones de celdas
La celda galvánica se representa simbólicamente mediante esquemas de celda o notaciones de celda.
• En los esquemas de celdas, todas las interfaces entre las fases de los componente están representadas mediante líneas paralelas verticales.
• Si existen dos o más componentes en la misma fase, se separan en la representación mediante comas.
• El ánodo se representa a la izquierda del esquema y el cátodo a la derecha.
• Una línea vertical doble indica un puente salino o un tabique poroso entre las dos semirreacciones.
↮ Por convención, el esquema comienza con el ánodo y procede de izquierda a derecha, identificando las fases e interfaces encontradas dentro de la celda, terminando con el cátodo.
Por ejemplo, la celda galvánica anterior consiste en un ánodo de cobre sólido sumergido en nitrato acuoso de cobre (II) conectado a través de un puente salino a una solución acuosa de nitrato de plata (I) sumergida en un cátodo sólido de plata. La conversión de esta declaración en simbolismo siguiendo las directrices anteriores da como resultado el esquema de celda:
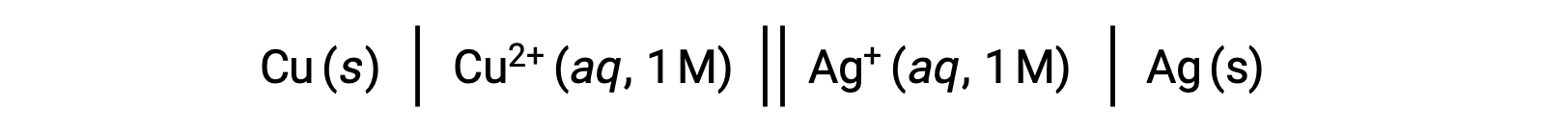
Este texto es adaptado de Openstax, Química 2e,17.2 Celdas Galvanicas.
