Summary
La voie classique est activée par l'anticorps et culmine dans la lyse des cellules cibles. Le CH
Abstract
Le système du complément est un groupe de protéines qui lorsqu'il est activé conduire à la lyse des cellules cibles et facilite la phagocytose par opsonisation. Composants du complément individuel peuvent être quantifiés mais cela ne donne aucune information quant à l'activité de la voie. Le CH
Protocol
Préparation de la solution saline tamponnée 5x véronal (VBS)
- Pour préparer la Saline véronal Buffered (VBS), trois solutions distinctes doivent être préparées.
- Préparer la solution en dissolvant une 21.25gm de NaCl et d'0.94gm barbitone de sodium dans 350ml d'eau distillée. Les concentrations finales de NaCl et de sodium sont barbitone 1,02 et 13mm respectivement.
- Préparer la solution 2 en dissolvant 1.44gm des barbitone dans 125ml d'eau distillée chaude. La concentration finale de barbitone est 62.5mm.
- Préparer une solution 3 en dissolvant 20.33gm de MgCl 2 et 4.41gm de CaCl2 dans 100 ml d'eau distillée. La concentration finale de MgCl 2 et CaCl 2 est 2.18m et 440mm respectivement.
- Mélanger les solutions 1 et 2 et laisser refroidir à température ambiante.
- Une fois la solution combinée a refroidi, ajouter 1,25 ml de la solution 3 et ajuster le pH à 7.3 au 7.5 en utilisant HCl 1M.
- Ajuster le volume final à 500 ml d'eau distillée pour préparer une solution stock de 5x.
- Pour préparer une solution 1x travail, diluer le stock de 01h05 à l'eau distillée.
Sensibilisation des hématies de mouton avec hémolysine
- Préparer l'hémolysine tout d'abord en le diluant avec VBS 01:50
- Pour ajouter 4ml de SRBC 6ml de VBS et mélanger délicatement par inversion
- Centrifuger à 600g x 5 minutes
- Jeter le surnageant et laver les cellules une autre 2 fois
- Après le lavage final, centrifuger les cellules à 5 minutes x 900g pour emballer les cellules
- Jeter le surnageant et remettre les cellules en quantité suffisante VBS pour préparer une solution de 10% soit 0,5 ml de cellules sont resuspendues dans emballée 5 ml de tampon
- Goutte à goutte ajouter un volume égal d'hémolysine (lapin anti-mouton d'anticorps des globules rouges) pour les cellules tout en tourbillonnant en continu
- Incuber à 30 ° C pendant 30 minutes dans un bain d'eau
- Mélanger délicatement les cellules toutes les 15 minutes
- Sensibilisé SRBC peut être stockée pendant la nuit à 4 ° C
CH 50 test
- Etiquette d'une série de tubes en double avec 1:08, 1:16, 1:32, 1:64 et 1:128.
- Préparer une série de deux dilutions successives de contrôle et de sérum à tester en VBS, en double exemplaire à chaque
- Départ à 01h04 (100ml de sérum + 300ml VBS) et le transfert de 200ml d'échantillon dans le tube suivant étiquetés.
- Mélanger soigneusement entre les dilutions et 200ml transfert à la dilution suivante avec une pointe de pipette propre.
- Répétez jusqu'à ce que tous les cinq dilutions sont faites.
- Jeter 200ml de la finale 1:128 dilution.
- Ajouter 200ml de SRBC sensibilisés suspendus à tous les tubes.
- Etiquette deux tubes séparés que de blanc et ajouter 200 ml d'sensibilisés SRBC VBS + 200ml. Ces tubes mesurent lyse spontanée de la GRM en VBS.
- Etiquette encore deux tubes séparés que lyse totale et ajouter 200 ml d'sensibilisés SRBC + 200ml d'eau distillée.
- Mélanger délicatement tous les tubes.
- Incuber à 37 ° C pendant 30 minutes dans un bain-marie le mélange après 15 minutes.
- Centrifuger les échantillons à 1500 g pendant 5 minutes pour sédimenter les globules rouges.
- Transfert de 100 ml de surnageant de chaque tube à un puits dans une plaque de 96 puits à fond plat.
- Ajouter 100ml d'eau distillée dans chaque puits.
- Lire l'absorbance des échantillons à 540nm en utilisant un spectrophotomètre assiette.
Calculs
- Calculer l'absorbance moyenne pour chaque échantillon
- Soustraire l'absorbance BLANC (lyse spontanée) de tous les échantillons
- Calculez le% de lyse pour chaque dilution en utilisant la formule suivante:

- Tracer le pourcentage de lyse (axe vertical) en fonction de la dilution du sérum sur l'axe horizontal.
- Calculer la dilution nécessaire pour 50% d'hémolyse pour le contrôle et le sérum à tester (figure 2).
Les résultats représentatifs:
La vidéo comprend un exemple de résultats représentatifs. En pratique, un sérum de contrôle est également géré dans le même temps que le sérum à tester et est traitée de la même manière. Ci-dessous (Tableau 1) sont des données de l'échantillon à partir d'un échantillon testé le sérum. Les données sont manipulées selon l'équation présentée au paragraphe 5.3.
| Exemple | OD 540 | Moyenne | ||
| Vierge | 0.042, 0.044 | 0,043 | ||
| Lyse totale | 0.183, 0.183 | 0,183 | ||
| De dilution | OD 540 | Moyenne | Mean-Blank | % De lyse |
| 01:08 | 0.200, 0.219 | 0,210 | 0,168 | 116 |
| 01:16 | 0.179, 0.173 | 0,176 | 0,134 | 93 |
| 01:32 | 0.134, 0.110 | 0,122 | 0,08 | 55 |
| 1:64 | 0.053, 0.066 | 0,059 | 0,017 | 12 |
| 1:128 | 0.044, 0.045 | 0,045 | 0,003 | 2 |
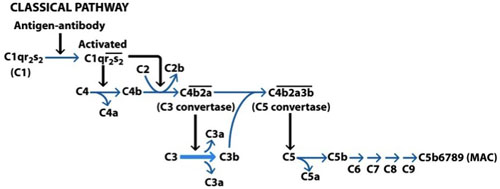
Figure 1. L'activation de la voie classique du complément. La voie classique est activée par la fixation des immunoglobulines M (IgM) ou des immunoglobulines G (IgG) sur la surface d'une cellule cible. La portion Fc de l'Ab se lie à C1q, C1r est activé, ce qui active à son tour une autre molécule de C1r qui, ensemble, d'activer deux molécules de C1s. C1s clive désormais C4 qui expose le site de liaison pour C2, qui est aussi clivé. La liaison du C4b et C2a conduit à la formation d'un complexe appelé C3-convertase. Ce complexe clive C3 formant désormais C3a et C3b, dont certains se combinent avec la C3 convertase de former une C5 convertase. Ce complexe agit maintenant sur C5, avec le C5b résultant liant à C6 ouverture de la formation du complexe d'attaque membranaire (MAC). C5b6 agit sur C7, qui agissent en son tour sur le C8 et C9 en fin de compte aboutir à la formation de la finale de MAC. (Goldsby et al, 2003).
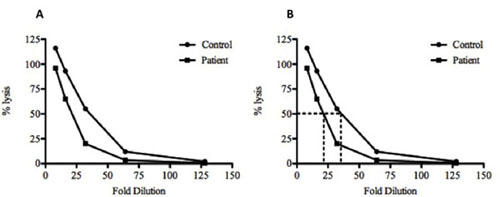
Figure 2. Tracé des données d'échantillon et le calcul du CH50 pour un contrôle et des échantillons de sérum à tester. (A), le pourcentage calculé (%) lyse de la fois le contrôle (•) et test () des échantillons de sérum sont tracées contre le facteur de dilution. (B) Pour le calcul de la lyse de 50%, une ligne est tracée à partir de la valeur pour cent à 50% jusqu'à son intersection avec la ligne graphique, puis une ligne verticale est tiré vers le bas pour la dilution. Dans cet exemple, une dilution de 35 fois du contrôle et de 21,6 fois la dilution du sérum à tester sont nécessaires pour atteindre 50% de lyse. Ces données indiquent qu'il ya moins de compléter présents dans le sérum à tester par rapport à la commande car il nécessitait moins de dilution avant la lyse de 50% a été atteint. L'échantillon de contrôle montre également la lyse> 100% à la dilution 1:8. Ceci est probablement dû à une lyse incomplète des SRBC par l'eau distillée et plus efficace par la lyse des composants du complément.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Le CH 50 dosage est soumis à de nombreuses interférences. Certains SRBC sont plus fragiles que d'autres, ce qui entraîne une hémolyse spontanée qui n'est pas lié à compléter l'activité. L'affinité des anticorps de lapin varie d'un lot à et d'un fabricant à l'autre, ce qui affecte la quantité d'anticorps qui se lie à la GRM. En outre, le processus de sensibilisation SRBC avec des résultats d'anticorps dans les cellules avec différentes quantités de revêtement d'anticorps de la GRM. Prélèvement et stockage sont une importante source potentielle d'erreur. Composants du complément C1q, par exemple, C3, C4 et C5 sont extrêmement labiles, la manipulation des échantillons afin approprié est essentiel. Une exposition prolongée à la chaleur va diminuer l'activité du complément et produire des fragments inactifs de composants du complément. Pour détecter que de nombreuses sources d'erreur possible, il est essentiel de tester un sérum de contrôle avec une valeur connue CH 50 à chaque fois que le dosage est effectué et à reproduire la valeur acceptée de la commande connue sérum. Une façon de déterminer s'il ya des différences entre les différents lots de SRBC et hémolysine est de tester le matériel de test de nouveaux contre un échantillon standard de sérum à plusieurs reprises et ensuite déterminer s'il ya des changements dans le niveau basal d'hémolyse ou de la valeur de CH 50 pour le sérum de contrôle.
Subscription Required. Please recommend JoVE to your librarian.
Acknowledgments
L'auteur tient à remercier Mlle Lora Matthews pour l'exécution de la technique et de M. Paul Berger pour la cinématographie. Ce projet a été financé par l'Université d'Australie du Sud, le programme de médecine de laboratoire.
Materials
| Name | Company | Catalog Number | Comments |
| Sheep red blood cells | CSL | 2490201 | Use at 1% final |
| Serum | Human serum | ||
| Rabbit Anti-Sheep Haemolytic serum (RBCs), Unconjugated | AbD Serotec | C12HSB | |
| 96 well flat bottom plate | Sarstedt Ltd | 83.1839 | |
| Veronal buffered saline | Use at 1x final | ||
| Waterbath | |||
| Plate reader | |||
| 37°C room/incubator |
References
- Goldsby, R. A., Kindt, T. J., Osborne, B. A., Kuby, J. Immunology. , W.H. Freeman. (2003).




