Summary
La via classica è attivata da anticorpi e culmina nella lisi delle cellule bersaglio. Il CH
Abstract
Il sistema del complemento è un gruppo di proteine che, quando attivato portare a bersaglio la lisi cellulare e facilita la fagocitosi attraverso opsonisation. Componenti complementari individuali possono essere quantificati comunque questo non fornisce alcuna informazione circa l'attività della via. Il CH
Protocol
Preparazione di 5x Veronal Buffered Saline (VBS)
- Per preparare il veronal Buffered Saline (VBS), tre soluzioni separate devono essere preparati.
- 1 Preparare la soluzione sciogliendo 21.25gm di NaCl e 0.94gm Barbitone di sodio in 350 ml di acqua distillata. Le concentrazioni finali di NaCl e sodio Barbitone sono 1,02 e 13 mm rispettivamente.
- Preparare la soluzione 2 sciogliendo 1.44gm di Barbitone in 125ml di acqua distillata calda. La concentrazione finale di Barbitone è 62,5 mm.
- 3 Preparare la soluzione sciogliendo 20.33gm di MgCl 2 e 4.41gm di CaCl 2 in 100 ml di acqua distillata. La concentrazione finale di MgCl 2 e CaCl 2 è 2.18m e 440mm rispettivamente.
- Mix di soluzioni 1 e 2 e raffreddare a temperatura ambiente.
- Una volta che la soluzione combinata si è raffreddato, aggiungere 1.25ml di soluzione al 3 e regolare il pH a 7,3-7,5 usando HCl 1M.
- Regolare il volume finale di 500ml con acqua distillata per preparare una soluzione 5x magazzino.
- Per preparare una soluzione 1x di lavoro, diluire il magazzino 1:05 con acqua distillata.
Sensibilizzazione dei globuli rossi di pecora con emolisina
- Preparare il emolisina da prima che diluendo 1:50 con VBS
- Per 4ml di SRBC aggiungere 6 ml di VBS e mescolare delicatamente per inversione
- Centrifugare a 600g x 5 minuti
- Eliminare il supernatante e lavare le cellule altre 2 volte
- Dopo l'ultimo lavaggio, centrifugare le cellule a 900g x 5 minuti per confezionare le cellule
- Eliminare il supernatante e risospendere le cellule in VBS sufficiente per preparare una soluzione al 10% cioè 0,5 ml di cellule confezionati sono risospese in 5 ml di tampone
- Goccia a goccia aggiungere un volume equivalente di emolisina (coniglio anti-pecora rossa anticorpi di globuli rossi) per le cellule, mentre vorticose continua
- Incubare a 30 ° C per 30 minuti in un bagno d'acqua
- Mescolare delicatamente le cellule ogni 15 minuti
- Sensibilizzate SRBC possono essere memorizzati notte a 4 ° C
CH 50 test
- Etichetta una serie di tubi in duplice copia con 1:8, 1:16, 1:32, 1:64 e 1:128.
- Preparare una serie di due diluizioni seriali di controllo e di siero in esame in ogni VBS in duplice copia
- Inizia 1:4 (100 ml di siero + 300 ml VBS) e il trasferimento da 200 ml di campione nella provetta etichettata successiva.
- Mescolare accuratamente tra le diluizioni e 200ml trasferimento alla diluizione successiva con un puntale fresca.
- Ripetere fino a quando tutti e cinque diluizioni sono fatti.
- Eliminare 200ml dalla finale 1:128 diluizione.
- Aggiungere 200 ml di sospensione SRBC sensibilizzati a tutti i tubi.
- Etichetta due tubi separati come BLANK e aggiungere 200 ml di sensibilizzati SRBC + 200 ml VBS. Questi tubi misurerà lisi spontanea del SRBC in VBS.
- Etichetta altri due tubi separati come lisi TOTALE e aggiungere 200 ml di sensibilizzati SRBC + 200 ml di acqua distillata.
- Mescolare delicatamente tutti i tubi.
- Incubare a 37 ° C per 30 minuti a bagnomaria mescolando dopo 15 minuti.
- Centrifugare i campioni a 1.500 g per 5 minuti per sedimentare i globuli rossi.
- Trasferimento 100ml di surnatante da ciascuna provetta per un pozzo in un piatto fondo ben 96 piatti.
- Aggiungere 100 ml di acqua distillata in ciascun pozzetto.
- Leggere l'assorbanza dei campioni a 540nm utilizzando uno spettrofotometro piatto.
Calcoli
- Calcolare l'assorbanza media per ogni campione
- Sottrarre l'assorbanza del bianco (lisi spontanea) da tutti i campioni
- Calcolare la lisi% per ogni diluizione utilizzando la seguente formula:

- Tracciare la lisi percentuale (asse verticale) contro la diluizione del siero sull'asse orizzontale.
- Calcolare la diluizione necessaria per il 50% emolisi per il controllo e siero (Fig. 2).
Rappresentante dei risultati:
Il video contiene un esempio di risultati rappresentativi. In pratica, un siero di controllo viene eseguito anche allo stesso tempo come il siero in esame e viene trattato nella stessa maniera. Qui di seguito (Tabella 1) è un dato campione da un campione testato siero. I dati sono manipolati secondo l'equazione presentata in 5.3.
| Campione | OD 540 | Dire | ||
| Vuoto | 0,042, 0,044 | 0,043 | ||
| Lisi totale | 0,183, 0,183 | 0,183 | ||
| Diluizione | OD 540 | Dire | Significa-Blank | % Lysis |
| 01:08 | 0,200, 0,219 | 0,210 | 0,168 | 116 |
| 01:16 | 0,179, 0,173 | 0,176 | 0,134 | 93 |
| 01:32 | 0,134, 0,110 | 0,122 | 0,08 | 55 |
| 1:64 | 0,053, 0,066 | 0,059 | 0,017 | 12 |
| 1:128 | 0,044, 0,045 | 0,045 | 0,003 | 2 |
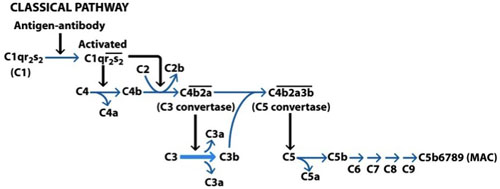
Figura 1. Attivazione della via classica del complemento. La via classica è attivata dal legame con immunoglobuline M (IgM) o immunoglobuline G (IgG) sulla superficie della cellula bersaglio. La porzione Fc della Ab lega al C1q, C1r è attivata e questo a sua volta attiva un'altra molecola di C1r che, insieme, attivare due molecole di C1s. C1s si unirà ora C4 che espone il sito di legame per la C2, che è anche spaccati. Il legame di C4b e C2a porta alla formazione di un complesso chiamato C3 convertasi. Questo complesso si unirà ora C3 formando C3a e C3b, alcune delle quali si combinano con la C3 convertasi formando una C5 convertasi. Questo complesso agisce ora in C5, con la conseguente C5b legame con C6 di avviare la formazione del complesso di attacco alla membrana (MAC). C5b6 agisce sul C7, che a loro volta agiscono su C8 e C9 in ultima analisi, causando la formazione della finale MAC. (Goldsby et al, 2003).
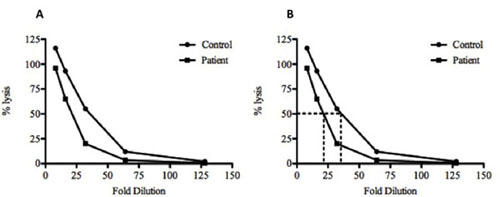
Figura 2. Rappresentazione grafica dei dati di esempio e il calcolo del CH50 per un controllo e campione di siero. (A), la percentuale calcolata (%) lisi sia del controllo (•) e test () campioni di siero sono tracciati contro il fattore di diluizione. (B) Per calcolare la lisi del 50%, viene disegnata una linea dal valore percentuale del 50% fino ad intersecare con le linee del grafico e poi una linea verticale viene disegnata fino alla diluizione. In questo esempio, è 35 volte diluizione del controllo e il 21,6 volte diluizione del siero in esame sono tenuti a raggiungere il 50% lisi. Questi dati indicano che c'è meno complemento presenti nel siero in esame rispetto al controllo, come ha richiesto meno di diluizione prima 50% lisi è stato raggiunto. Il campione di controllo mostra anche> 100% lisi alla diluizione 1:8. Questo è molto probabilmente dovuto alla lisi incompleta del SRBC dall'acqua distillata e più efficiente lisi dai componenti del complemento.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Il CH 50 saggio è soggetta a molte interferenze. Alcuni SRBC sono più fragili di altre, con conseguente emolisi spontanea che non è correlata a completare l'attività. L'affinità degli anticorpi di coniglio varia da lotto a lotto e da un costruttore all'altro, questo influisce sulla quantità di anticorpo che si lega alla GRP. Inoltre, il processo di sensibilizzazione SRBC con risultati anticorpi nelle cellule con quantità diverse di rivestimento degli anticorpi del GRP. Raccolta dei campioni e conservazione sono un'importante fonte potenziale di errore. Componenti del complemento ad esempio C1q, C3, C4 e C5 sono estremamente labili, trattamento dei campioni in modo corretto è un fattore critico. L'esposizione prolungata al calore si riduce l'attività complementare e produrrà frammenti inattivi di componenti del complemento. Per rilevare come molte fonti di errore possibile, è fondamentale per il test di un siero di controllo con una nota CH 50 un valore ogni volta che viene eseguito il test e per riprodurre il valore accettato del controllo siero. Un modo per determinare se ci sono differenze tra i diversi lotti di SRBC e emolisina è quello di testare nuovi materiali di prova contro un campione standard di siero più volte e quindi determinare se ci sono variazioni del livello basale di emolisi o nel valore 50 CH per il siero di controllo.
Subscription Required. Please recommend JoVE to your librarian.
Acknowledgments
L'autore desidera ringraziare la signorina Lora Matthews per eseguire la tecnica e il signor Paolo Pastore per la cinematografia. Questo progetto è stato finanziato dalla University of South Australia, il programma di Medicina di Laboratorio.
Materials
| Name | Company | Catalog Number | Comments |
| Sheep red blood cells | CSL | 2490201 | Use at 1% final |
| Serum | Human serum | ||
| Rabbit Anti-Sheep Haemolytic serum (RBCs), Unconjugated | AbD Serotec | C12HSB | |
| 96 well flat bottom plate | Sarstedt Ltd | 83.1839 | |
| Veronal buffered saline | Use at 1x final | ||
| Waterbath | |||
| Plate reader | |||
| 37°C room/incubator |
References
- Goldsby, R. A., Kindt, T. J., Osborne, B. A., Kuby, J. Immunology. , W.H. Freeman. (2003).




