Summary
고전 경로는 항체에 의해 활성화되고 대상 세포 용해에 culminates 있습니다. CH
Abstract
보완 시스템은 세포 용해를 대상으로 이끌 활성화되고 opsonisation 통해 phagocytosis을 용이하게 단백질의 그룹입니다. 개인 보완 구성 요소가 있지만 이것은 경로의 활동에 같은 정보를 제공하지 않습니다 계량하실 수 있습니다. CH
Protocol
5 배 Veronal 버퍼 살린 (VBS)의 준비
- Veronal 버퍼 살린 (VBS)를 준비하려면, 별도의 세 가지 솔루션을 준비해야합니다.
- 증류수의 350ml에 나트륨 Barbitone의 NaCl과 0.94gm의 21.25gm을 용해하여 용액 1을 준비합니다. NaCl과 나트륨 Barbitone의 최종 농도는 각각 1.02M과 13mM 있습니다.
- 뜨거운 증류수의 125ml에 Barbitone의 1.44gm을 용해하여 용액 2를 준비합니다. Barbitone의 최종 농도는 62.5mM입니다.
- 증류수의 100ml에 CaCl 2 MgCl 2 4.41gm의 20.33gm을 용해하여 용액 세를 준비합니다. MgCl 2, CaCl 2의 최종 농도는 각각 2.18M과 440mM입니다.
- 믹스 솔루션 1, 2 룸 온도 냉각.
- 통합 솔루션이 냉각되면, 솔루션 3 1.25ml를 추가하고 1M HCL을 사용하여 7.3-7.5 수있는 산도를 조정합니다.
- 배 재고 솔루션을 준비하는 증류수로 500ml로 최종 볼륨을 조정합니다.
- 1X 작업 솔루션을 준비하려면, 증류수와 주식 1:5 희석.
haemolysin와 양 적혈구의 Sensitisation
- 첫째 VBS로 1시 50분를 diluting하여 haemolysin 준비
- SRBC의 위해 4ml는 VBS의 6ml를 추가하고 부드럽게 반전에 의해 믹스
- 600g X 오분에서 원심 분리기
- 뜨는을 취소하고 세포를 다른 2 번 씻어
- 최종 세척 후, 세포를 싣고 900g X의 오분의 세포를 원심 분리기
- 뜨는을 취소하고 포장 세포의 10 % 즉, 솔루션 0.5ml를 준비하는 충분한 VBS에있는 세포를 resuspend는 버퍼의 5 ML에 resuspended 아르
- 지속적으로 소용돌이 치는 동안 세포 haemolysin의 동일한 음량을 (토끼 안티 양 적혈구 세포 항체) 추가 Dropwise
- 물 목욕 30 분 30 ° C에서 알을 품다
- 부드럽게 세포 매 십오분 믹스
- Sensitised SRBC 4에서 하룻밤 저장할 수 있습니다 ° C
CH 50 검정
- 1시 8분, 1시 16분, 1시 32분, 1:64 및 1:128와 중복의 튜브 일련의 라벨.
- 중복 각 VBS의 제어 및 시험 혈청의 두 배 시리얼 dilutions 일련의 준비
- 1시 4분 (100ml + 300ml 혈청 VBS)에서 시작하고 다음 표시된 튜브에 시료의 200ml를 전송할 수 있습니다.
- 신선한 피펫 팁과 다음 희석에 dilutions 및 전송 200ml 사이에 철저히 섞는다.
- 다섯 dilutions이 이루어질 때까지 반복합니다.
- 최종 1:128 희석에서 200ml를 폐기하십시오.
- 모든 튜브에 정지 sensitized SRBC의 200ml를 추가합니다.
- 라벨 두 개의 튜브로 빈과 sensitized SRBC + 200ml VBS의 200ml를 추가합니다. 이러한 튜브는 VBS의 SRBC의 자발적인 용해를 측정합니다.
- TOTAL 용해와 같은 다른 두 개의 튜브 라벨과 sensitized SRBC + 200ml 증류수의 200ml 추가합니다.
- 부드럽게 모든 튜브를 섞는다.
- 37 ° C 십오분 후 혼합 waterbath 30 분 알을 품다.
- 퇴적물 RBCs를 5 분 1천5백g에서 샘플을 원심 분리기.
- 96 잘 플랫 바텀 플레이트에 잘 각 튜브의 표면에 뜨는의 100ml를 전송합니다.
- 각 잘하는 증류수의 100ml를 추가합니다.
- 플레이트 분광 광도계를 사용하여 540nm에서 샘플 흡광도를 읽어보십시오.
계산
- 각 샘플에 대한 평균 흡광도를 계산
- 모든 샘플에서 빈 흡광도 (자발적인 용해)을 빼기
- 다음 수식을 사용하여 각 희석에 대한 %의 용해를 계산 :

- 수평축에 혈청 희석 대 비율 용해 (수직 축)를 플롯.
- 제어 및 시험 혈청 (그림 2) 50 % haemolysis에 필요한 희석을 계산합니다.
대표 결과 :
비디오는 대표적인 결과의 예를 포함하고 있습니다. 연습에서는 컨트롤 혈청 또한 시험 혈청 동시에 실행하고 같은 방식으로 처리됩니다. 아래 (표 1) 검사 혈청 샘플에서 예제 데이터입니다. 데이터는 5.3에서 제시한 공식에 따라 조작할 수 있습니다.
| 견본 | OD 540 | 평균 | ||
| 공백 | 0.042, 0.044 | 0.043 | ||
| 총 용해 | 0.183, 0.183 | 0.183 | ||
| 노동 희석 | OD 540 | 평균 | 평균 - 빈 | %의 용해 |
| 1시 8분 | 0.200, 0.219 | 0.210 | 0.168 | 116 |
| 1시 16분 | 0.179, 0.173 | 0.176 | 0.134 | 93 |
| 1시 32분 | 0.134, 0.110 | 0.122 | 0.08 | 55 |
| 1:64 | 0.053, 0.066 | 0.059 | 0.017 | 12 |
| 1:128 | 0.044, 0.045 | 0.045 | 0.003 | 2 |
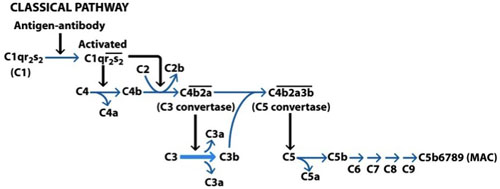
그림 1. 고전적인 보완 경로의 활성화. 고전 경로가 대상 세포의 표면에 결합 면역 글로불린 - M (IgM) 또는 면역 글로불린 - G (IgG)에 의해 활성화됩니다. AB의 FC 부분은 C1q에 바인딩, C1r가 활성화되고 이것은 차례로 함께 C1s 두 분자를 활성화 C1r의 다른 분자를 활성화합니다. C1s 지금도 죽습니다 C2에 대한 구속력이 사이트를 노출 C4를 클리브스. C4b 및 C2A의 바인딩은 C3의 convertase로 불리는 복잡한 형성에 이르게한다. 이 복잡한 이제 C5의 convertase을 형성 C3의 convertase와 결합 일부의 C3 성형 C3a와 C3b를 클리브스. 이 복잡한 이제 막 공격 복잡한 (MAC)의 형성을 시작 C6에 바인딩 결과 C5b과 C5의 역할을합니다. C8 설정 행위의 궁극적 C9에 대한 최종 MAC의 형성에 결과 C7에 C5b6 행위. (Goldsby 외, 2003).
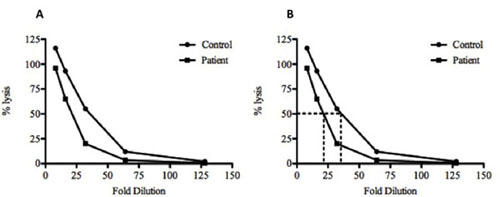
그림 2. 샘플 데이터하려하고 제어 및 테스트 혈청 샘플에 대한 CH50을 계산. (A), 컨트롤 (•) 및 테스트 () 혈청 샘플을 모두 계산된 비율 (%)가 용해는 희석 요인이 역모를 꾸몄다됩니다. 이 그래프 라인과 교차 다음 수직선이 희석로 그려진까지 (B) 50 % 용해를 계산하려면, 라인은 50 % %의 가치에서 도출됩니다. 이 예제에서는 테스트 혈청의 제어 및 21.6 배 희석의 35 배 희석은 50 %의 용해를 달성해야합니다. 이 데이터는 50 %의 용해에 도달되기 전에 덜 희석 필요한 컨트롤에 비해 테스트 혈청에있는 적은 보완이있다는 것을 나타냅니다. 컨트롤 샘플도 1시 8분 희석시> 100 % 용해를 보여줍니다. 이것은 대부분 보완 구성 요소로 증류수와보다 효율적으로 용해하여 SRBC의 불완전한 용해에 의한 것입니다.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
CH 50 검정은 많은 interferences의 적용을받습니다. 일부 SRBC는 활동을 보완하기 위해 무관 자연 haemolysis의 결과로, 다른 사람보다 더 연약하고 있습니다. 토끼 항체의 친화도는 많은에서 많은 한 제조 업체에서 다른 다릅니다, 이것은 SRBC에 바인딩 항체의 양을 영향을 미칩니다. 또한, 항체 코팅 SRBC의 다양한 양의와 세포 항체 결과 SRBC을 sensitizing의 과정. 표본 수집 및 저장 오류의 중요한 잠재적인 소스입니다. 보완 구성 요소 예 : C1q, C3, C4 및 C5 매우 불안 정한 있으므로 적절한 샘플 처리가 중요합니다. 더위에 장시간 노출은 보완 작업을 감소하고 보완 구성 요소의 비활성 조각을 생산합니다. 가능한 오류의 많은 소스로 감지하기 위해서는 알려진 CH 50 가치 분석을 수행할 때마다 제어 혈청을 검사하고 알려진 혈청 컨트롤의 허용 값을 재현하는 것이 중요합니다. haemolysis의 기초 수준이나 CH 50 가치의 변화가있는 경우 SRBC와 haemolysin의 다른 일괄 사이에 차이가 있는지 확인하는 한 가지 방법은 혈청 여러 번의 표준 샘플에 대한 새로운 시험 자료를 시험하고 결정하는 것입니다 컨트롤 혈청.
Subscription Required. Please recommend JoVE to your librarian.
Acknowledgments
저자는 촬영에 대한 기술과 미스터 폴 목사는 수행 미스 로라 매튜스를 감사하고 싶습니다. 이 프로젝트는 사우스 오스트 레일 리아 대학, 연구소의 의학 프로그램에 의해 투자되었다.
Materials
| Name | Company | Catalog Number | Comments |
| Sheep red blood cells | CSL | 2490201 | Use at 1% final |
| Serum | Human serum | ||
| Rabbit Anti-Sheep Haemolytic serum (RBCs), Unconjugated | AbD Serotec | C12HSB | |
| 96 well flat bottom plate | Sarstedt Ltd | 83.1839 | |
| Veronal buffered saline | Use at 1x final | ||
| Waterbath | |||
| Plate reader | |||
| 37°C room/incubator |
References
- Goldsby, R. A., Kindt, T. J., Osborne, B. A., Kuby, J. Immunology. , W.H. Freeman. (2003).




