Summary
Ofixerade frysta vävnadsprover inbäddade i Optimal Cutting Temperature-medium (OCT) kan användas för att studera naturliga distribution och glykosylering av utsöndrat slem. I detta tillvägagångssätt vävnadsbehandling är minimal och den naturliga presentation av glykolipider, muciner och glykan-epitopema bevaras. Vävnadssnitt kan analyseras genom immunhistokemi med användning av fluorescens eller kromogen detektion.
Abstract
Muciner är komplexa och kraftigt glykosylerat O-bundna glykoproteiner, som innehåller mer än 70% kolhydrat vikt 1-3. Utsöndrade muciner, som produceras av bägarceller och magslemhinnan, ge byggnadsställningen för en mikrometer tjockt slem skikt som linjer epitel i tarmen och luftvägarna 3,4. Förutom muciner, slem skikt innehåller även antimikrobiella peptider, cytokiner, och immunoglobuliner 5-9. Det slemlager är en viktig del av värdens medfödd immunitet, och bildar den första försvarslinjen mot invaderande mikroorganismer 8,10-12. Som sådan, är slem föremål för åtskilliga interaktioner med mikrober, både patogener och symbionter och utsöndrade muciner utgör en viktig gränssnitt för dessa interaktioner. Studiet av sådana biologiska interaktioner innebär vanligtvis histologiska metoder för mjukpapper insamling och färgning. De två vanligaste histologiska metoder för vävnad insamling och preservring på kliniken och i forskningslaboratorier är: formalin fixering följt av paraffininbäddning och vävnader frysning, följt av inbäddning i kryo-skyddsmedel medier.
Paraffininbäddade vävnadsprover producerar delar med optimala egenskaper för histologisk visualisering, inklusive klarhet och väldefinierade morfologi. Men under paraffininbäddning processen ett antal epitoper blir förändras och för att studera dessa epitoper, vävnadssnitten måste bearbetas ytterligare med en av många metoder epitopretrieval 13. Utsöndrade muciner och lipider extraheras från vävnaden under paraffin-inbäddade clearing steg, som kräver förlänga inkubering med organiska lösningsmedel (xylen eller Citrisolv). Därför är detta tillvägagångssätt är optimalt för studier med fokus på natur och distribution av muciner och slem in vivo.
Däremot frysning vävnader i optimal skärtemperaturen (oktober) inbäddningsmedium enhåligheter uttorkning och clearing av provet och upprätthåller provet hydrering. Detta möjliggör bättre bevarande av det hydratiserade slem skiktet, och sålunda medger studiet av de många roller muciner i epitelial biologi. Eftersom denna metod kräver minimal bearbetning av vävnaden, är vävnaden bevaras i ett mera naturligt tillstånd. Därför frysta vävnader avsnitt kräver ingen ytterligare behandling före färgning och kan lätt analyseras med immunohistokemi metoder.
Vi visar bevarandet av mikrometer tjocka utsöndras slemlager i frysta kolon prover. Detta skikt är drastiskt när samma vävnader inbäddade i paraffin. Vi visar också immunofluorescensfärgning av glykan epitoper på muciner med växtlektiner. Fördelen med denna metod är att det inte kräver användning av speciella fixativ och tillåter användning av frysta vävnader som redan kan bevaras i laboratoriet.
Protocol
1. Tissue Ingjutning i oktober
- Bered en frysning bad genom tillsats av torr is till 2-metylbutan i ett grunt frigolitlåda.
- Skörda vävnaden, och försiktigt fuktig på ett silkespapper för att torka överskottsvätska. Vid användning snabbfrystes vävnad (vävnad som frystes i flytande kväve), låta vävnaden värmas upp till -20 ° C genom att placera den i en kryo-mikrotom kammare.
- Tillsätt en liten mängd oktober till Peel-A-Way frysning mögel, precis tillräckligt för att täcka formens botten.
- Placera vävnaden i formen, se till vävnaden vilar på botten av formen vid den önskade orienteringen. När frysta, kommer vävnaden blocket vara sektioneras antingen från botten eller från sidorna.
- Täck vävnaden med oktober, och placera formen i frysning badet. ULT föreningen blir vit som vävnaden fryser.
- När frysta, skala formen av frusna blocket och plats i en markant fryspåse.
- De frysta blocken kan hållasvid -80 ° C tills användning.
2. Vävnad Sektionering
- Placera vävnad block i kryo-mikrotom kammare, och låta dem komma -20 ° C (ca 30 min).
- Skär en 3-5 um tjock sektion, och placera en positivt laddad glasskiva ovanpå sektionen. Vävnaden kommer att följa bilden.
- Lufttorka vävnaderna under 30-60 min.
- Objektglasen kan användas i detta skede, eller de kan hållas vid -80 ° C för framtida användning.
3. Vävnadsfärgning
- Bilder som lagrades vid -80 ° C: Låt bilderna tina och lufttorka i rumstemperatur i 30 min.
- Fixera glasen med 10% buffrad formalin under 30 minuter vid rumstemperatur.
- Tvätta tre gånger i PBS eller TBST-buffert för varje tvätt doppa skivorna 10 gånger i 250 ml buffert. PBS-buffert kan användas för immunofluorescensfärgning dock för kromogena detektion med alkaliskt fosfatas-conjugpade antikropp bör TBST användas, eftersom fosfat i PBS hämmar alkaliska fosfataser.
- Vävnadssnitt bilder är nu redo att färgas.
4. Använda Histokemiska Fläckar som Alcian Blue och perjodsyra Schiff att upptäcka Slem
- Alcian blue stain:
- Skölj objektglasen i vatten, inkubera i 3% ättiksyra under 3 min vid rumstemperatur.
- Stain med Alcian blue pH 2,5 lösning under 30 min vid rumstemperatur.
- Tvätta objektglasen i rinnande kranvatten under 10 minuter, skölj i DI vatten.
- Motfärga i Nuclear Fast Red under 5 min vid rumstemperatur.
- Tvätta objektglasen tre gånger i avjoniserat vatten.
- Perjodsyra Schiff fläck:
- Skölj objektglasen i vatten, inkubera i nyberedd 1% perjodsyra under 5 min.
- Tvätta tre gånger i avjoniserat vatten, doppa en gång i miliQ vatten.
- Stain med Schiffs reagens under 15 minuter vid rums temperature.
- Tvätta objektglasen i rinnande kranvatten under 10 minuter, skölj i DI vatten.
- Motfärga i Surgipath Hematoxylin under 30 sekunder vid rumstemperatur.
- Tvätta objektglasen tre gånger i avjoniserat vatten.
- Inkubera glider 30 sek i Scotts kranvatten vid rumstemperatur.
- Tvätta tre gånger i avjoniserat vatten.
- Dehydratisera och rensa objektglasen genom att inkubera 1 min i 95% etanol, följt av tre snabba förändringar i 100% etanol, och tre förändringar i Citrisolv, 2 min vardera. Allt vid rumstemperatur.
- Montera bilder på täckglas med hartsartade medium (Cytoseal 60).
5. Använda Lektiner och antikroppar (tabell 1) för att detektera glykan epitoper genom histokemisk metoder
- För fluorescensdetektion av tre glykanstrukturer epitoper med lektiner, blockera objektglasen med 1% BSA i PBS under 10-30 min vid rumstemperatur.
- Eftersom en biotinylerad lektin används, blockera endogen biotin genom inkubering 15 min med 0,1%Avidin, följt av 15 min inkubation med 0,01% biotin vid rumstemperatur.
- Tvätta objektglasen i PBS efter varje blockerande steg.
- Nyligen framställa en blandning av 1 | ig / ml rodamin-konjugerad succinylerade vetegroddagglutinin (sWGA), 1,3 pg / ml biotinylerad Sambucus nigra agglutinin (SNA) och 5 pg / ml fluorescein-konjugerad Jacalin i HEPES / NaCl-buffert (10 mM HEPES, 150 mM NaCl, pH 7,5).
- Placera glasen på en plan yta eller i en färgning rutan och lager lektin blandningen ovanpå. Blandningen volym kan reduceras genom att försiktigt placera parafilm på vätskan, planar parafilm vätskan och förhindrar avdunstning.
- Inkubera 1 h vid rumstemperatur i mörker.
- Tvätta objektglasen tre gånger med PBS.
- Layer objektglasen med 0,7 pg / ml streptavidin-konjugerat CY5 (för att detektera den biotinylerade-SNA), och inkubera under 30 minuter vid rumstemperatur i mörker.
- Tvätta objektglasen tre gånger med PBS.
- Motfärga kärnor med 0,1 & mU, g / ml DAPI.
- Montera glider på täckglas med vattenhaltigt medium, såsom VectaMount monteringsmedel (eller något vattenhaltiga media).
6. Kontroll för Lektin färgning Specificitet
- Lektin färgning specificitet styrs antingen genom specifik enzymatisk klyvning av mål-glykan epitop före färgning eller genom konkurrens med små molekyler.
- Enzymatisk klyvning för Sambucus nigra agglutinin (SNA) bindningsspecificitet
- Späd Arthrobacter ureafaciens sialidas (AUS) till 250 mU / ml i 50 mM natriumacetat pH 5,5.
- Tillsätt vatten till botten av en tom spets-box kommer detta bildar en fuktig kammare under inkubation.
- Placera objektglasen möter upp på övre facket i spetsen-box, lager 150-200 ul AUS lösningen på bilden och täck med ett täckglas. Undvik luftbubbla.
- Stäng lock och inkubera vid 37 ° C under 2,5 timmar.
- Tvätta objektglasen tre gånger i PBS vid rumstemperaturenturen för att ta bort alla fria sialinsyror. Dessa bilder ska vara negativt för SNA färgning.
- Konkurrenskraftiga hämmare för Jacalin och succinylerad vetegroddagglutinin (sWGA) specificitet
- Alikvotera 200 pl av lektin blandningen framställd i steg 5,4 till två Eppendorf ampuUer.
- Tillsätt 200 mM Melibiose (Jacalin hämmare) till en av de flaskor och kitin-hydrolysat på 1:10 utspädning (sWGA hämmare) till den andra flaskan.
- Overlay negativa kontrollobjektglas med inhibitorer innehållande blandningen och inkubera 1 timme vid rumstemperatur samtidigt som resten av bilderna. Dessa bilder ska vara negativt för Jacalin eller sWGA färgning, respektive.
7. Representativa resultat
En jämförelse mellan vävnadsprover bäddades in i paraffin för frusna vävnader inbäddade i kryo-skyddsmedel medium (OCT) avslöjade slående skillnad i att bevara och kvaliteten på färgning för Mucin glykoproteiner. Vävnadsfärgning med histokemiska färgämnen som Alcian Blue och perjodsyra Schiff, ger väldigt olika resultat i jämförbara vävnadssnitt från frysta eller paraffin inbäddade prov (figur 1). Det verkar som det organiska lösningsmedlet (xylen eller Citrisolv) som används under paraffininbäddning processen påverkar fördelningen av utsöndrade muciner på epitel liksom avlägsna mycket av glykolipider från proverna (figur 2). Som ett resultat, visas slemskiktet kollapsade på slemhinnan cellerna och är främst i bägarceller. Flash frysning av vävnader i kryo-skyddsmedel media (oktober) underhålls prov hydrering och bevarade de utsöndrade muciner lagret dimensioner. Den paraffininbäddning processen påverkat andra slem-associerade glykaner och glykolipider på ett liknande sätt. Glykan fördelning undersöktes med lektiner, som rutinmässigt används för glykan detektion (Figur 3) och antikroppar mot epitoper finns påmuciner och glykolipider (Figur 6). Eftersom lektinbindning inte är väl definierad och påverkas av den rumsliga fördelningen av glykaner samt glykan strukturen 14,15, är det viktigt att tillämpa lämpliga åtgärder för lektin färgning. Här visar vi två metoder för att kontrollera lektin färgning på de testade vävnaderna: enzymatisk klyvning och kompetitiv hämning. Klyvning av glykanen epitoperna gjordes genom att digerera vävnadssnittet med glykan-specifika enzymer, t.ex. bakteriell sialidas som kontroll för sialinsyra bindning av SNA (fig. 4). I de fall där specifika enzym (t.ex. glykosidas) inte är tillgänglig för att ta bort glykan epitopen studeras, kan lektin specificitet bekräftas genom att en kompetitiv hämmare som Melibiose för Jacalin färgning eller kitin-hydrolysat för sWGA färgning (Figur 5).
Vi visar här att snabbfrystes vävnadsprover, som är rutinertinely erhållits i kliniken och i forskningslaboratorier, kan ytterligare inbäddade i oktober och används för att studera mucin glykoproteiner och de många glykaner som finns på dem.
| Lektin / Ab | Källa | Större specificitet |
| LFA | Limax flavus (gul snigel) | Terminal Sia |
| MAA * | Maackia amurensis (Amur Maackia) | Siaα2-3Galβ1-R / 3-O-sulfat på Galβ1-R |
| SNA | Sambucus nigra (fläder) | Siaα2-6Gal / Siaα2-6GalNAc |
| WGA | Triticum vulgaris (vetegroddar) | GlcNAcβ1-4GlcNAcβ1-4GlcNAc / Sia |
| sWGA | Succinylerade Triticum vulgaris (vetegroddar) | GIcNAc & beta, 1-4GlcNAcβ1-4GlcNAc |
| PNA | Arachis hypogaea (Peanut) | Galβ1-3GalNAc (omodifierad T-antigen) |
| Jacalin | Artocarpus integrifolia (Jacalin) | Galβ1-3GalNAc finns på O-länkade glykaner |
| ECA | Erythrina cristagalli (Coral Tree) | Galβ1-4GlcNAc |
| TKH2 | Antikropp | Siaa2-6GalNAc (STN) på O-länkade glykaner |
| CA19-9 | Antikropp | Siaa2-3Galβ1-4 (Fuca1-3) GlcNAc (SLE a) |
| SNH3 | Antikropp | Siaa2-3Galβ1-3 (Fuca1-4) GlcNAc (SLE x) |
Förkortningar: Ab, antikroppar, Sia, Sialinsyra, Gal, galaktos, GalNAc,
Tabell 1. En partiell lista av lektiner och antikroppar för glykanstrukturer epitoper.
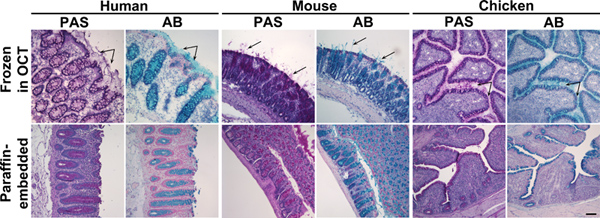
Figur 1. Alcian Blue och perjodsyra Schiff färgning av frysta och paraffininbäddade kolon vävnader. Vävnadssnitt av människa, mus eller kyckling prover kolon frysta i oktober (övre panelen) eller bäddas in i paraffin (nedre panelen) färgades med perjodsyra Schiff (PAS) eller Alcian Blue (AB). Dessa reagenser fläcken slem rosa eller blå, respektive. Övre panel: I frusna vävnader, förutom muciner i bägarceller, var utsöndrat slem också gentemotbelt (pilar). Lägre panel: I paraffininbäddade vävnader, var slem färgning begränsad till bägarceller. Kärnor motfärgades med Surgipath (PAS) eller Mayers (AB) hematoxylin. Skala stapel visar 100 nm. Klicka här för att se större bild .

Figur 2. Citrisolv inkubation resulterar i väsentlig förlust av muciner. Seriella sektioner av frysta prover kyckling ileum fixerades i 10% buffrad formalin och hålls hydratiserad (vänster panel), dehydratiserades i etanol genom sekventiell inkubation i 70%, 90% och 100% etanol under 20 minuter varje (mellersta fältet), eller dehydratiseras i etanol och rensas med Citrisolv under 1 timme (höger panel). Dehydratiserade prover rehydratiserades tillbaka till PBS innan hematoxylin och eosin (H & E) eller Alcian blue-färgning. Etanol uttorkning och Citrisolv clearing förbättrad vävnad Morphology (t.ex. övre raden, mitten och höger bild kontra vänster bild). Etanol uttorkning hade ingen signifikant effekt på Alcian blue-färgning (mellersta raden, jämföra vänster och mitten bilder). Däremot minskade Citrisolv inkubation Alcian blue-färgning och begränsade den till bägarceller (mittenraden, höger bild) i ett mönster som liknade den som sågs i paraffininbäddade vävnader (figur 1). Dessa uppgifter tyder på att den starka färgning av slem granulat i paraffininbäddade prover beror på krympande och kondensering av slem i gobletceller under clearing steget. Den svagare och mindre tät färgning av slem i frysta OKT-inbäddade vävnaderna återspeglar en mer naturlig fördelning av slem i vävnaden. Högre förstoringar av inramade områden är markerade med pilar. Skala staplar indikerar 50 pm (övre och mellersta rader) och 10 nm (nedersta raden).

Figur 3. Bindning avlektiner till glykan epitoper på frysta och paraffininbäddade vävnader. Chicken tunntarmen (ileum) prover frysta i oktober (övre paneler) eller bäddas in i paraffin (lägre paneler) undersöktes med Jacalin (blå), sWGA (grön) och SNA (röd ). Högre förstoringar av inramade områden är markerade med pilar. I frusna vävnader Jacalin bindning till O-kopplade glykaner avslöjade strukturer som tycktes vara sipprar från bägarceller i lumen (Jacalin, övre panel, pilar). I motsats, var Jacalin bindning till paraffininbäddade vävnader begränsad till bägarceller (Jacalin, nedre panelen, pilar) och till villi tarmluddet (nedre vänstra bilden, pil). sWGA färgning av β1-4GlcNAc delvis samlokaliserade med bindningen av Jacalin lektin i både frusna vävnader (övre panel, pilar), och i paraffininbäddade vävnader (nedre panelen, pilar). I motsats, är SNA lektinbindning till α2-6 länkade sialinsyror intracellulär (SNA, pilspetsar), och inte sam-lokaliseras med Jacalin (färgbild, SNA i rött markerade med en pil, Jacalin i blått märkt med streckad pil). Skala staplar indikerar 100 nm (vänster bild) och 20 nm (förstorade inramad områden).

Figur 4. Enzymatisk klyvning kontroll för sialsyra färgning med SNA. Chicken tunntarmen prover inkuberades med 250 mU / ml Arthrobacter ureafaciens sialidas (AUS) eller med 50 mM natriumacetat, pH 5,5 buffert under 2,5 h vid 37 ° C. AUS behandling avskaffar färgning med biotinylerat SNA, bekräftar SNA bindningsspecificitet till sialinsyror. Skala stapel visar 100 nm.

Figur 5. Kompetitiv hämning kontroll för glykan färgning med Jacalin och sWGA. Kyckling tunntarmen (ileum) prover inkuberades med en Jacalin och sWGA blandning i närvaro av specifika LECtenn-hämmare: melibios (mellersta kolumnen), Kitin-hydrolysat (högra spalten) eller utan inhibitor (A och D). Övre panel: (vänster) Jacalin färgning utan hämmare. (Mitten) Jacalin färgning hämmades av Melibiose. (Höger) Kitin-hydrolysat inte hämmade Jacalin färgning. Nedre panelen: (vänster) sWGA färgning utan inhibitor. (Mitten) Melibiose inte hämmade sWGA färgning. (Höger) sWGA färgning inhiberades av Chitin-hydrolysat. Denna inhibering bekräftar den specifika interaktionen av lektiner med vävnaderna. Asterisker märke bild av färgning inhibering. Skala stapel visar 100 nm.

Figur 6. Detektering av sekretoriska muciner, glykolipider och glykan epitoper i frysta mänskliga kolorektal cancer vävnader. Kolorektal cancer biopsier från villösa cancer och slemhinnor karcinom var snabbfrystes i flytande kväve och inbäddade i oktober Vävnadssektioner inkuberades under 1 timmemed antikroppar mot det utsöndrade mucin MUC5AC, sialyl-Lewis a - glykan epitop funnen på gangliosider (kolorektal cancer markör CA 19-9), och sialyl-Tn - riklig glykan epitop på muciner (detekterad med TKH2 antikropp), följt av 30 min inkubation med biotinylerad åsne-anti-mus-IgG sekundär antikropp, och 30 min inkubation med peroxidas-konjugerat streptavidin. Ytterligare vävnader inkuberades under 1 timme med den biotinylerade lektiner SNA och sWGA, följt av 30 min inkubation med peroxidas-konjugerat streptavidin. Peroxidas färgning har utvecklats med AEC-kit. Svart skala stapel anger 200 nm.
Discussion
Bevarande av slem och glykan epitoper i frusna vävnader är överlägsen den hos vävnader som var inbäddade i paraffin. Vi visade bevarandet av utsöndrad slem skikt (figurerna 1 och 3) och fördelningen av tre glykaner strukturer (figur 3) i frysta vävnader jämfört med paraffininbäddade vävnader. Specialiserade fixativ, såsom Carnoys lösning (60% etanol, 30% kloroform, 10% ättiksyra) har 17 utvecklats för optimal konservering av slemskiktet i vävnadsprover. Optimalt bör denna lösning användas för att samla vävnadsprover som är avsedda för slem studier och visades bevara slätt utseende av slem skikt 16-17. Slem skiktet i ofixerade frysta prover inbäddade i oktober verkar robust och i vissa områden kan lossna från vävnaden, men den totala tjocklek är i överensstämmelse med vad som observerats i vävnader som har åtgärdats med Carnoys lösning och embedded i paraffin 16-17. Till exempel är det slem skiktet i frusen human kolon vävnadssektion ~ 100 nm (figur 1), vilket är inom det område som rapporteras för Carnoy's-fast human kolon prov 55,4 ± 2,5 ^ m (intervall 7,7 till 204,8 um) 16.
Det har varit känt under årtionden att etanol uttorkning resulterar i ~ 30% krympning av biologiska prover 18, och att organiska lösningsmedel såsom xylen, Citrisolv och kloroform lipider extrakt, glykolipider och, i viss utsträckning, proteiner från vävnaderna 13. Tissue behandling för paraffininbäddning innefattar följande steg: fixering (10% buffrad formalin), uttorkning (ökande etanol koncentration) och clearing (Citrisolv eller xylen). Genom att imitera dessa steg på ofixerade frusna vävnadssektioner, visade vi att Citrisolv extraherar slem från frysta vävnadssektioner resulterar i vävnad morfologi som liknar den av paraffininbäddade vävnader (Figure 2, högra panelen). I motsats, var slem skiktet inte ändras genom inkubering med formalin eller etanol (figur 2, vänster och paneler center). Detta tyder på att clearing steget av standard paraffininbäddning förfarande, som kräver långvarig inkubering i Citrisolv / xylen, resulterar i kollaps slemlager. Formalin fixering skadar inte slem skiktet och frysta vävnader sektioner som fixerades med formalin kan lätt färgas med lektiner och antikroppar mot glykaner, glykolipider och proteiner (figur 2, 3 och 6). Dessa effekter kan vara försumbar för studien av membranbundna proteiner och vävnad patologi, men de är förödande för starkt hydratiserade strukturer såsom det utsöndrade slemmet skiktet. Emellertid histologiska studier av muciner fortfarande genomförs mestadels med paraffininbäddade prover, i vilka slem skiktet bevarande är suboptimal. Djupgående analyser av slemlager sammansättning såsom den exakta identiteten av sigcreted eller membranbundna MUC glykoprotein kombinationer kräver särskilda antikroppar och masspektrometri för identifiering av protein stamnät. Bevarande av slemlager är men den initiala kravet på sådana studier.
Många laboratorier har vävnadsprover frysts i oktober som samlats i det förflutna för olika projekt, kan dessa vävnader lätt användas för att studera muciner, glykolipider och glykan fördelning eliminerar behovet av att samla vävnader i speciella fixativ som är unikt för slem bevarande. Frysta vävnader genomgår minimal behandling och därför den naturliga fördelningen av glykaner, som är hydratiserade i naturen, bevaras. Detta är särskilt viktigt i sfären av mikrobiella värd-interaktioner. Kunskap om naturalistisk utbredningen och mängden av utsöndrade muciner och de många strukturer glykan dekorera dessa "barriär" molekyler kommer att vara avgörande för förståelsen värdförsvar, mikrobiell exploatering och patogenerär.
Disclosures
Inga intressekonflikter deklareras.
Acknowledgments
Författarna vill tacka Nicole M. Nemeth (University of Georgia) och Jeanne M. Fair (LANL) för deras hjälp med att skörda kyckling vävnader och Steven A. Springer för hans hjälp under inspelningen. Vården av alla fåglar i denna studie var i enlighet med National Institutes of Health riktlinjer för human användning av försöksdjur och alla protokoll godkändes av Institutional Animal Care och kommittéer användning vid Los Alamos National Security, LLC, som driver Los Alamos nationellt laboratorium enligt kontrakt nr DE-AC52-06NA25396 med US Department of Energy. Vården av möss i studien är i enlighet med UCSD godkänd djur protokoll. Mänskliga vävnader erhölls som en del av UCSD godkända IRK-protokollet. Detta arbete stöddes av bidrag 118.645 från University of California Lab Avgift President Program (PG) och bidrag NS047101 från National Institute of neurologiska sjukdomar och Stroke (Neuroscience Mikroskopi Delad Facility, UC San Diego).
Materials
| Name | Company | Catalog Number | Comments |
| 2-methyl butane | Fisher Scientific | 03551-4 | |
| AEC peroxidase substrate kit | Vector Labs | SK-4200 | |
| Alcian Blue | Sigma-Aldrich | A3157 | |
| Anti-CA 19-9 monoclonal antibody | Calbiochem | CA1003 | |
| Anti-MUC5AC monoclonal antibody | Millipore | MAB2011 | |
| Avidin-Biotin blocking kit | Vector Labs | SP-2001 | |
| Biotinylated donkey anti-mouse antibody | Jackson Immunoresearch | 90863 | |
| Biotinylated SNA | Vector Labs | B-1305 | |
| Bovine serum albumin | Sigma-Aldrich | A4503 | |
| Chitin-hydrolysate | Vector Labs | SP-0090 | |
| Cryostat microtome | Leica Microsystems | Leica CM 1800 | |
| Hematoxylin | Surgipath Medical Ind. | 3801570 | |
| Hydrogen peroxide 30% | Fisher Scientific | H325-100 | |
| Jacalin-FITC | Vector Labs | FL-1151 | |
| Mayer's Hematoxylin | Sigma-Aldrich | MHS32 | |
| Melibiose | Sigma-Aldrich | M5500 | |
| Nuclear Fast Red | Vector Labs | H-3403 | |
| OCT compound | VWR International | 25608-930 | |
| Peroxidase conjugated streptavidin | Jackson Immunoresearch | 94638 | |
| Schiff reagent | Electron microscopy sciences | 26052 | |
| sWGA-Rhodamine | Vector Labs | RL1022S | |
| TKH2 monoclonal antibody | ATCC | HB-9654 | |
| VectaMount aqueous mounting media | Vector Labs | H-5501 | |
| Cytoseal 60 | Thermo Scientific | 8310-4 | |
| Peel-A Way molds | Polysciences Inc. | 18646A-1 |
References
- Slayter, H. S., Wold, J. K., Midtvedt, T. Intestinal mucin of germ-free rats. Biochemical and electron-microscopic characterization. Carbohydr. Res. 222, 1-9 (1991).
- Lamblin, G. The carbohydrate diversity of human respiratory mucins: a protection of the underlying mucosa. Am. Rev. Respir. Dis. 144, S19-S24 (1991).
- Corfield, A. P., Carroll, D., Myerscough, N., Probert, C. S. Mucins in the gastrointestinal tract in health and disease. Front. Biosci. 6, D1321-D1357 (2001).
- Turner, J. R. Intestinal mucosal barrier function in health and disease. Nat. Rev. Immunol. 9, 799-809 (2009).
- Lievin-Le Moal, V., Servin, A. L. The front line of enteric host defense against unwelcome intrusion of harmful microorganisms: mucins, antimicrobial peptides, and microbiota. Clin. Microbiol. Rev. 19, 315-337 (2006).
- Kim, Y. S., Ho, S. B. Intestinal goblet cells and mucins in health and disease: recent insights and progress. Curr. Gastroenterol. Rep. 12, 319-330 (2010).
- Nochi, T., Kiyono, H. Innate immunity in the mucosal immune system. Curr. Pharm. Des. 12, 4203-4213 (2006).
- Vareille, M., Kieninger, E., Edwards, M. R., Regamey, N. The airway epithelium: soldier in the fight against respiratory viruses. Clin. Microbiol. Rev. 24, 210-229 (2011).
- McGuckin, M. A., Linden, S. K., Sutton, P., Florin, T. H. Mucin dynamics and enteric pathogens. Nat. Rev. Microbiol. 9, 265-278 (2011).
- Knowles, M. R., Boucher, R. C. Mucus clearance as a primary innate defense mechanism for mammalian airways. J. Clin. Invest. 109, 571-577 (2002).
- Johansson, M. E. The inner of the two Muc2 mucin-dependent mucus layers in colon is devoid of bacteria. Proc. Natl. Acad. Sci. U.S.A. 105, 15064-15069 (2008).
- Hooper, L. V., Macpherson, A. J. Immune adaptations that maintain homeostasis with the intestinal microbiota. Nat. Rev. Immunol. 10, 159-169 (2010).
- Hayat, M. A. Microscopy, Immunohistochemistry, and Antigen Retrieval Methods: For Light and Electron Microscopy. Hayat, M. A. , Kluwer Academic/Plenum Publishers. New York, NY. 53-70 (2002).
- Cohen, M., Hurtado-Ziola, N., Varki, A. ABO blood group glycans modulate sialic acid recognition on erythrocytes. Blood. 114, 3668-3676 (2009).
- Cohen, M., Varki, A. The sialome--far more than the sum of its parts. OMICS. 14, 455-464 (2010).
- Ota, H., Katsuyama, T. Alternating laminated array of two types of mucin in the human gastric surface mucous later. Histochemical J. 24, 86-92 (1992).
- Matsuo, K., Ota, H., Akamatsu, T., Sugiyama, A., Katsuyama, T. Histochemistry of the surface mucous gel layer of the human colon. Gut. 40, 782-789 (1997).
- Boyde, A., Maconnachie, E. Treatment with lithium salts reduces ethanol dehydration shrinkage of glutaraldehyde fixed tissue. Histochemistry. 66, 181-187 (1980).



