Introduction
ポストカラム誘導体化(PCD)と結合された高速液体クロマトグラフィー(HPLC)は、分析研究室で多くの問題を解決するのに有用である強力なツールです。これは、利用可能な検出器1,2のスイートとさもなければ検出不能である化合物を検出し、選択的検出および定量3-5の下限を許可または標的分析物のシグナルを増加させることができることを避けるために、標的分析物を誘導体化マトリックス効果6。一般的に使用されるPCD反応は、9,10またはフルオレサミン11,12ニンヒドリン、2,2-ジフェニルと反応性酸素種(ROS)の誘導体をオルト-フタルアルデヒド7-9を有するアミノ酸などのアミンとの反応を含みます1- picrylhydrazilラジカル(DPPH•)13,14、または2,2'-アジノ-ビス(3-ethylbenzothiazoline -6-スルホン酸(ABTS)15,16、および硫黄cを誘導体化するためにヨウ化アジド試薬の使用ontaining化合物17,18。
HPLCシステム6を有するPCD反応の使用には多くの欠点は、しかし、存在します。主にこれらの間混合し、8を発生するための反応時間を可能にする誘導体化試薬(単数または複数)の添加の時点と検出器との間の反応コイルの使用です。これらの反応は、多くの場合、HPLCシステム19の残りの部分の容積に比べて有意である500μlあるいはそれ以上の容積を有するループ。これらの大量の反応の使用は、反応ループの存在なしで観察されるものと比較して増加したピークの広がりをもたらすループ。これは、定量および検出の高い限界が短く、幅の広いピークになると負のクロマトグラフィー分解能をもたらす。1および図 2は 、様々なポストカラム反応ループのボリュームの追加に起因するピーク形状の悪化を強調表示します。この分析94%メタノールおよび6%のMilli-Q水の移動相組成を用いて行きました。移動相の流速は1ml /分であり、注入量は20μlであったと分析波長は265 nmでした。千μlに20μlのからデッドボリュームを変化させるコイルはPCD法における反応ループデッドボリュームの影響をシミュレートするために、カラムと検出器との間に挿入しました。これらのループは、0.5 mmの内径のステンレス鋼管から調製しました。実験は、コントローラ(SCL-10AVP)からなるHPLCシステム上で実施した、低圧グラジエントバルブ(FCL-10ALVP)、ポンプ(LC-20AD)、インジェクター(SIL-10ADVP)、およびPDA検出器( SPD-M10ADVP)。移動相は、従来のHPLCシステムに導入する脱気装置を通してポンプ輸送しました。分離250ミリメートル×内径4.6 mm 5ミクロンカラムを用いて行きました。実験条件は、最近、文献に発表されているPCD反応の典型であるように選択しました。
ザ最も簡単なのは、最も一般的なポストカラム反応器の設定は、効果的に液体を流すことができ、反応が起こることができ、それを通して細長いチューブである非セグメント管状反応器と呼ばれます。このシステムピークに広がりがないだけで、システムに追加デッドボリュームだけでなく、飯島ら 8によって強調されているように、管の内径に依存しています。また、コイル形状が観察されたブランドの広がりで役割を果たしています。スチュワート20は、反応器の巻取りがデッドボリュームを最小化することができることを意味し、より良好な混合が得られ、二次流れのプロファイルを変更することを述べました。 21コイルニット開管を使用するときにピークの広がりが重要ではないことを述べました。ピークの広がりが大きすぎる場合は、反応器の他のタイプも20,22と考えることができます。これらは床反応器またはセグメント流反応器を含むことができます。これらの反応器は、そうでなければrequirだろう遅い反応のために特に有用です電子大きな反応がループします。非セグメント化された管状反応器は、PCDのアプリケーションで使用される原子炉の中で最も一般的なタイプであるため、この記事の残りの部分は、反応器のセットアップのこのタイプを扱います。
反応流(RF)列の設計は、移動相が外側に位置し、半径方向の中央列の領域または3のポートに配置された単一のポートのいずれかを介してカラムを出る(または入力)することを可能にするマルチポートエンドフィッティングを組み込んカラムの壁領域( 図3参照 )。これらの二つの流れを順番にカラム壁に張り出し、外側多孔質フリットに囲まれている不透過性のリングに囲まれている中央の多孔質フリットを含むエンドフィッティングを用いて分離されています。中央不透過性リングクロスフローに2多孔性領域の間では不可能です。
反応流クロマトグラフィーの間に、誘導体化試薬(複数可)は一つ又はTWに移動相の流れ方向に対してポンピングされます反応流列の外側ポートのO。カラム溶出液は、外側のフリットで誘導体化試薬(複数可)と混合し、無料の外側ポートを介して検出器に渡されます。反応流は、単一の試薬誘導体(誘導体化試薬のための1ポート、1ポートは、検出器とブロックされた1ポートに、カラム溶離液を通過させるように)またはデュアル試薬系誘導体化試薬とを1ポート(2ポートのいずれかのために使用することができます)検出器にカラム溶離液を通過させます。中央ストリームからの流れは、いずれかの誘導体化されていないカラム溶離液、効果的に多重化検出23、または無駄に渡さを検出するために使用することができます。
RF-PCDクロマトグラフィーを実行するときに利用可能である一つの主要なチューニング技術は、中央と周辺の流れの比率です。各誘導体化のための最適な比率は、中央フローが検出されたり無駄に渡されるかどうかなど、多くの要因に依存します。したがって、最適な比率が決定された後正確な流量比は、各ランが実行される前に達成されることが保証されるべきです。
フリットの使用が一般的にゼロデッドボリュームのTピースまたは低デッドボリュームを採用し、従来の混合技術と比較して、より効率的な混合でRF-PCD結果の列溶離液流と誘導体化試薬を混合することが見出されていますW-作品は、2つのストリームを混合します。これは、比較的小さな反応ループの使用、または全く反応ループのさえ排除を可能にしました。伝統的なポストカラム誘導体化法に比べてシャープなピークで反応ループサイズの結果の減少。これは、全てのカラム溶離液のが誘導体化されるという事実にもかかわらず、対雑音比より高いシグナルが観察され、したがって検出及び定量化の下限を達成することができる、ということを意味します。
反応流クロマトグラフィーは、PCD反応の適応の困難を克服するために開発されました現代のHPLCカラムやシステムへの、による大容量の反応ループを採用する必要性に起因する大規模なポストカラムデッドボリュームに広げるバンドに起因する効率の特に損失。従来のPCDと比較して、RF-PCDで、より効率的な混合プロセスは、より小さな反応ループ量が観測された分離効率の上昇につながる使用されてもよいことを意味します。さらに、RF-PCDクロマトグラフィーは両方の増加したシグナルを示し、従来のPCD法に比べて検出および定量の下限をもたらす従来のPCDの技術に比べ、ノイズを減少させました。従来のPCD法に比べてRF-PCDのさらなる利点は、RF列の中央のポートだけでなく、列の周辺領域から溶出する誘導体化されたストリームから溶出する非誘導体化ストリームを監視する機能です。 RF-PCDは、従来のPCDの方法に比べて多くの利点が表示され、比較的新しいが、有望な技術です。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
注意:( すなわち 、メタノールのためのMSDS)は、使用する前に、すべての材料および試薬のための材料安全データシート(MSDS)をご参照ください。溶剤および高速液体クロマトグラフィー(HPLC)を溶離液を取り扱うときは、すべての適切な安全対策を使用することを確認してください。 HPLC、分析天びんと検出器計測器の技術的管理の適切な使用を確保し、個人用保護具(安全眼鏡、手袋、白衣、完全長ズボン、およびクローズドつま先の靴)を使用することを保証します。
注:このプロトコルは、目的の化学化合物の性質に固有の異なる試薬と反応流ポストカラム誘導体化の3つの方法(RF-PCD)技術、それぞれについて説明します。 ROSの解析については、「DPPH•を使用してROSの1検出」に進み、第一級アミンの分析については、「カミンを使用して、第一級アミンの2検出」、およびフェノール化合物の分析のために」セクションに移動を参照してください3 。フェノール類の検出4-aminoantipyreneとフェリシアン化カリウム」を使用して。全体に超純水( 例えば 、ミリQ水)を使用します。
注:RF列の接続が主な違いは、RF列の端金具の数であると従来のHPLCカラムとほぼ同じ方法で達成されます。 HPLCシステムに標準的なHPLCカラムを接続するために使用される継手は、HPLCシステムへRF列を接続するために使用されることが可能です。
DPPHを用いたROSの1検出•
- HPLC機器の設定
- 移動相としてのラインB上のラインA上の水100%と100%のメタノールでHPLC機器を準備します。メーカーの要件に従ってポンプをパージします。
- 図4(a)に示すように 、HPLC楽器の部品や追加の誘導体化ポンプを設定します。
- 520ナノメートルの波長で分析するために、UV-Visの検出器を設定します。
- の設定RFコラム
- HPLC機器へのRFカラムの入口を接続します。
- RF列の中央のポートをコンセントに0.13ミリメートルのIDチューブの15cmの長さを接続します。
- 0.13ミリメートルのIDチューブの15cmの長さを使用して、UV-Visの検出器に流出ペリフェラルポートに接続します。
- RFのカラムの出口上のペリフェラルポートにDPPH•ポンプラインを接続します。
- 列のストッパーを用いたRFカラムの出口に未使用のペリフェラルポートをブロックします。
- 100%メタノール- 1分ml -1の100%の線BにまでHPLCポンプの流量をもたらします。
- 内径4.6mm×100mmの長列の10分間、100%メタノールを移動相でカラムを平衡化します。この時間は、ユーザが使用することができる他の列の寸法に応じてスケーリングされるべきです。
- DPPH•試薬の調製
- メタノールにDPPH•の0.1mg / mlの溶液を調製します。 10分間DPPH•試薬を含有するフラスコを超音波処理します。
- 光への曝露を防止するために箔でフラスコをカバーしています。
- メーカーの要件に従って準備されたDPPH•試薬とDPPH•ポンプをパージします。
- RFのカラム出口のチューニング
- 正確に2清潔で乾燥した船の重量を量ります。周辺機器など、中央およびその他のような1つの容器にラベルを付けます。
- 1.0分間、中央ラベル付き容器に中央ポートから出る廃液を収集します。
- 中央ポート容器を再計量し、次のように中央のポートからの流れの重量を計算します。
中央港の重量(g)=中央ポート船(グラム)の最終重量 - 中央ポート容器の初期重量(g) - 繰り返しは、UV-VisのRFカラムの周辺ポートに接続し、ペリフェラルポート容器としての重みを計算されて出た廃液用の1.4.2と1.4.3ステップ次のとおりです。
ペリフェラルポートの重量(g)=ペリフェラルポート容器(G)の最終重量 - ペリフェラルポート容器の初期重量(g) - 次のように中央と周辺機器ポートからの流れの割合を計算します。
中央ポートの%中央ポート=重量(g)/(中央ポートの重量(g)+ペリフェラルポート(G)の重量)×100
ペリフェラルポート%のペリフェラルポート=重量(g)/(中央ポートの重量(g)+ペリフェラルポート(G)の重量)×100 - 中央流と周辺の流れの間のセグメンテーション比が30:70(:末梢中央)であることを確認してください。中央流が30%以上である場合には、中央のポートの出口0.13ミリメートルIDチューブの長さを追加することによって、出る流量を減少させます。中央流が30%未満である場合には、中央ポートから0.13ミリメートルのチューブの長さを減少させます。
- 1.4.6への手順を繰り返し1.4.1 30:70(中央:周辺)のセグメンテーション比がまで達成されています。
- Dの流量を設定します0.5ミリリットル分-1へのPPH•試薬ポンプ。
注:DPPH•試薬で設定RF列は現在、分析の準備ができています。サンプルは、現在注入されてもよいです。
- ポスト実行停止条件
- すべてのサンプルは、実行が終了したことを示す、注入された後、誘導体化試薬ポンプ流れを止めます。
- ペリフェラルポートからDPPH•試薬ポンプ行を削除し、ポートをストッパー。
- それは、移動相は1分ml -1の10分間でカラムを通過させることによって格納すべき移動相でカラムを平衡化します。
- HPLC機器上で、移動相ポンプの流れを停止します。
- メタノールでDPPH•試薬を交換して、追加のポンプをパージします。
注:HPLCシステムは現在、シャットダウンすることができます。
Fluorescを使用した第一級アミンの2検出アミン
- 移動相の調製
- ボリュームへの希釈前に5 M水酸化アンモニウムで9.0に溶液のpHを調整し、10mMの酢酸アンモニウム溶液の1リットルを調製します。
- 95:05(:ACN緩衝液)の予混合移動相を達成するために酢酸アンモニウム緩衝液にアセトニトリル52.6ミリリットル(ACN)を加えます。
- HPLC機器の設定
- 移動相としてA線にプレミックス準備緩衝液を用いてHPLC機器を準備します。メーカーの要件に従ってポンプをパージします。
- 図4(a)に示すように 、HPLC楽器の部品や追加の誘導体化ポンプを設定します。
- 誘導体化ポンプにパルスダンパーコイルを取り付けます。
- セットアップ蛍光検出器(FLD)を475 nmで390 nmおよび発光波長の励起波長を有します。
- RF列の設定
- 目を接続しますHPLC装置にRF列のE入口。
- RF列の中央のポートをコンセントに0.13ミリメートルのIDチューブの15cmの長さを接続します。
- 0.13ミリメートルのIDチューブの15cmの長さを使用して、FLD検出器へのRFカラムの出口周辺ポートを接続します。
- RFのカラムの出口上のペリフェラルポートに誘導体化ポンプラインを接続します。
- 列のストッパーを用いたRFカラムの出口に未使用のペリフェラルポートをブロックします。
- 5%ACNと予備混合の10mM酢酸アンモニウム緩衝液pH 9、 - 1分ml -1の100%の線AににHPLCポンプの流量をもたらします。
- 内径4.6mm×100mmの長列の10分間100%ラインA、移動相でカラムを平衡化します。この時間は、ユーザが使用することができる他の列の寸法に応じてスケーリングすることができます。
- カミン試薬の調製
- 0.1ミリグラムミリリットル-1カミン試薬の100ミリリットルを加えます。 <1分間のLI>超音波処理します。
- 光への曝露を防止するためにホイルで覆います。
- メーカーの要件に従って準備されたフルオ試薬と試薬ポンプをパージします。
- 正確に2清潔で乾燥した船の重量を量ります。周辺機器など、中央およびその他のような1つの容器にラベルを付けます。
- 1.0分間、中央ラベル付き容器に中央ポートから出る廃液を収集します。
- 中央の容器を再計量し、ステップ1.4.3で以下のように中央のポートからの流れの重量を計算します。
- 繰り返しは、RF列のペリフェラルポートに取り付けられ、ステップ1.4.4で以下のように周辺の重みを計算されたFLDを出る流出物のために2.5.3に2.5.2を繰り返します。
- ステップ1.4.5で以下のように、中央と周辺機器ポートからの流れの割合を計算します。
- 中央流と周辺の間のセグメント化率を確認流れは43:57(:末梢中央)です。中央流が43%以上である場合には、中央のポートの出口0.13ミリメートルIDチューブの長さを追加することによって、出る流量を減少させます。中央流が43%未満である場合には、中央のポートから0.13ミリメートルのチューブの長さを減少させます。
- 2.5.6への手順を繰り返し2.5.1 43:57(中央:周辺)のセグメンテーション比がまで達成されています。
- 0.7 mlの分、移動相ポンプの流量を設定-1。
- 0.1ミリリットル分で流れるように誘導体化ポンプを設定-1。
注:フルオレサミン試薬で設定RF列は現在、分析の準備ができています。サンプルは、現在注入されてもよいです。
- すべてのサンプルは、実行が終了したことを示す、注入された後、誘導体化ポンプを停止します。
- ペリフェラルポートとストッパから誘導体化ポンプ行を削除します。
- 移動相中でカラムを平衡化しますそれは、移動相は1分ml -1の10分間でカラムを通過させることによって格納されます。
- 移動相ポンプの流れを停止します。
- アセトニトリルでフルオレサミン試薬を交換し、誘導体化ポンプをパージします。
注:HPLCシステムは現在、シャットダウンすることができます。
4-Aminoantipyreneとフェリシアン化カリウムを用いたフェノール類の3検出
- 移動相の調製
- ボリュームへの希釈前に5 M水酸化アンモニウムで9.0に溶液のpHを調整し、100 mMの酢酸アンモニウム溶液の1リットルを調製します。
- (:メタノールバッファー)5:95の予混合移動相を達成するために酢酸アンモニウム緩衝液にメタノール52.6ミリリットルを追加します。
- HPLC機器の設定
- 移動相としてA線にプレミックス準備緩衝液を用いてHPLC機器を準備します。メーカーごとのように、ポンプをパージ」; sの要件。
- HPLC楽器のコンポーネントと、図4(b)に示すように、2つのさらなる試薬ポンプを設定します。
- 試薬ポンプのそれぞれにパルスダンパーコイルを取り付けます。
- 500nmの波長で分析するために、UV-Visの検出器を設定します。
- RF列の設定
- HPLC機器へのRFカラムの入口を接続します。
- RF列の中央のポートをコンセントに0.13ミリメートルのIDチューブの15cmの長さを接続します。
- 0.13ミリメートルのIDチューブの15cmの長さを使用して、UV-Visの検出器へのRFカラムの出口周辺ポートを接続します。
- 各試薬( すなわち 、4-aminoantipyreneとフェリシアン化カリウム)のRFカラムの出口上のペリフェラルポートへのポンプラインを接続します。
- 1 mlの分をHPLCポンプの流量をもたらす-1 100%の線Aに-の5%メタノールで予め混合100mMの酢酸アンモニウム緩衝液pH 9、。
- 列Wの平衡内径4.6mm×100mmの長カラムの10分間の100%A線移動相i番目。この時間は、ユーザが使用することができる他の列の寸法に応じてスケーリングすることができます。
- 4 aminoantipyrene試薬の調製
- ステップ3.1.1に従うことによって、9のpHを有する酢酸アンモニウム緩衝液を準備します。
- 150mgの4- aminoantipyreneを秤量し、準備された酢酸アンモニウム緩衝液(pH 9)100mlに溶解します。
- 1分間超音波処理します。
- 光への曝露を防止するためにホイルで覆います。
- メーカーの要件に従って準備された4-aminoantipyrene試薬と第1試薬ポンプをパージします。
- フェリシアン化カリウム試薬の調製
- フェリシアン化カリウム150mgのを秤量し、ステップ3.1.1に従って調製酢酸アンモニウム緩衝液(pH 9)100mlに溶解します。
- 1分間超音波処理します。
- 光への曝露を防止することがホイルでカバーしています。
- PURGメーカーの要件に従って準備されたフェリシアン化カリウム試薬とE第2試薬ポンプ。
- RF列のチューニング
- 正確に2清潔で乾燥した船の重量を量ります。周辺機器など、中央およびその他のような1つの容器にラベルを付けます。
- 1.0分間、中央ラベル付き容器に中央ポートから出る廃液を収集します。
- 中央の容器を再計量し、ステップ1.4.3で以下のように中央のポートからの流れの重量を計算します。
- 繰り返しは、RF列のペリフェラルポートに取り付けられ、ステップ1.4.4で以下のように周辺の重みを計算されたUV-Visのを出る流出物のために3.6.3に3.6.2を繰り返します。
- ステップ1.4.5で以下のように、中央と周辺機器ポートからの流れの割合を計算します。
- 中央流と周辺の流れの間のセグメンテーション比が50:50(:末梢中央)であることを確認してください。中央流が50%以上である場合には、減少アウトレット中央のポートに0.13ミリメートルのIDチューブの長さを追加することで、出て行く流れの量。中央流が50%未満である場合には、中央のポートから0.13ミリメートルのチューブの長さを減少させます。
- 3.6.6への手順を繰り返し3.6.1 50:50(中央:周辺)のセグメンテーション比がまで達成されています。
- 0.5ミリリットル分に4-aminoantipyreneポンプの流量を設定して-1。
- 0.25ミリリットル分にフェリシアン化カリウムポンプの流量を設定して-1。
注:二成分試薬を用いて設定したRF列は現在、分析の準備ができています。サンプルは、現在注入されてもよいです。
- ポスト実行停止条件
- 一旦、全てのサンプルが実行が終了したことを示す、実行が終了した注入された、試薬ポンプの両方を停止します。
- 周辺機器ポートから試薬ポンプ行を削除し、0.13ミリメートルチューブの15cmのピースに置き換えます。
- WHIで移動相でカラムを平衡化しますCHは移動相を1ml分でカラムに通過さ-1 10分間可能にすることによって格納されます。
- HPLC機器上で、移動相ポンプの流れを停止します。
- メタノールで試薬ポンプ上の試薬の両方を交換して、製造業者の要件ごとのような追加のポンプをパージします。
注:HPLCシステムは現在、シャットダウンすることができます。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
RF-PCDによる使用のために適合された第一のPCD法は、2,2-ジフェニル-1- picrylhydrazilラジカル(DPPH•)24を用いて、酸化防止剤の誘導体でした。この反応は、25。コーレバらによって導入された、広く以来使用されています。検出は、活性酸素種の存在下でDPPHラジカル•の脱色、観察された吸光度の低下で抗酸化物質の結果のそれ故に存在に依存しています。 DPPH•反応は、多くの場合、しかし、それは、RF-PCDカラムを使用時に反応ループを必要としないことがわかった、500μL以上13-15の大型反応ループを採用している。 図5は、使用して誘導体化リステロットコーヒーのサンプルの2つのクロマトグラムを示しています従来のPCDとRF-PCDの計測器の両方を使用して、DPPHラジカル•。
RF-PCDによる使用のために適合された第2のPCD法デアあります誘導体化試薬23としてフルオレサミンを使用して、4つのアミノ酸(グリシン、ロイシン、フェニルアラニンおよびトリプトファン)のivatization。この方法は、RF列で使用するために最適化された移動相の組成、フルオレサミン濃度およびフルオ流量でUdenfriend ら 11によって仕事から適応されました。従来の方法は、pH 9.0緩衝液を既にバッファされた移動相を利用したRF-PCD法一方、フルオレサミン試薬の添加前に、流出液流に加えた二試薬誘導体化システム、従って、単一の試薬誘導体化システムを利用しました必要とされました。この用途のために誘導体化されたストリームは、蛍光による検出のために使用される励起波長に相当するUV可視検出器を用いて390 nmで分析しました。誘導体化されたストリームは、ノイズに大きなシグナルを与え、蛍光検出器を用いて検出し、したがって検出及び定量の下限することができitation、Udenfriend ら 11作品あたりとして。また、RF-PCDのセットアップの中心ポートからの溶離液は、第2のUV可視検出器を用いてモニターしました。
アミノ酸の誘導体化のためのRF-PCD法の性能は、従来のPCD法と比較した。 表1に、RF-PCDおよびPCD従来のモードの両方で分析したアミノ酸の各々について定量および検出の計算された限界。検出限界は、定量限界は10の信号対雑音比が達成された濃度であると定義しながら2の信号対雑音比が得られた濃度であると定義した。 図6は、4つのクロマトグラムを示しますアミノ酸は、従来のPCD法、RF-PCD法やRF-PCD法から誘導体化されていないストリームを用いて分析した。 図7は、エンドウ豆のために得られたシグナルの比較であります従来のPCD法やRF-PCD法の両方を使用して、グリシンおよびロイシンによるKS従来のPCD法、RF-PCD法及びRF-から誘導体化されていないストリームを用いて分析すると、 図8は、トリプトファンピークのピーク幅とを比較しますPCD法。
RF-PCD 26による使用のために適合された最終的なPCD法は、4つのフェノール類(フェノール、4-メトキシフェノール、p個の -cresolおよびトコフェロール)の誘導体です。この方法は、RF列で使用するための方法を最適化するために小さな変更を加えBigleyとグロブ27によって仕事から適応されました。この作品は、両方の4-amionantiprineとフェリシアン化カリウムの溶液は、RFカラムのエンドフィッティングでカラムの溶出液に添加した二成分誘導体化反応を利用しました。これは、反応に使用されるために必要な追加のポストカラム反応ループをRFカラムを使用していないときにすることが見出された。 図9は、ここでクロマトグラムの一例を示しています分離し、誘導体化および検出されたしない誘導体化方式およびいくつかの(黒のトレース)に対する応答を示すいくつかの成分を含有していた21成分試験サンプル。同じ混合物はまた、分離して比較(赤トレース)のための非誘導体化を検出しました。 図9において、RF-PCD応答が容易に視覚的な区別(取得した検出器応答が陽性であった)のための負の応答として表示されていた。 図10は、pのピーク形状の比較は-cresol両方RF-PCDカラムを使用し、誘導体化を示し非誘導体化。
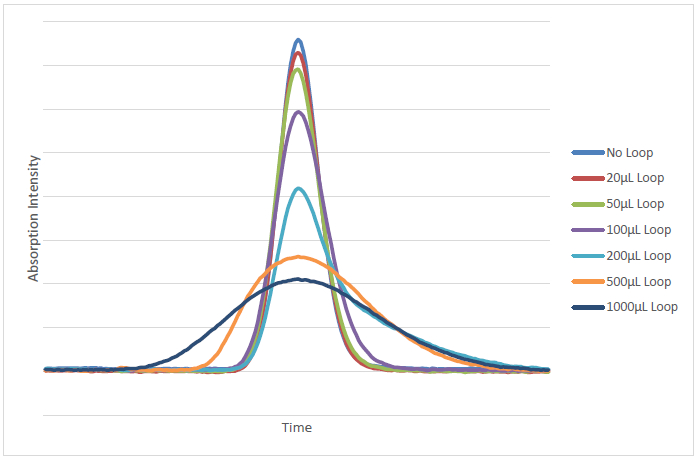
図1. クロマトグラフカラムと検出器との間に追加された様々なデッドボリュームとHPLCシステムに注入ヘキシルベンゼンのオーバーレイ。 してくださいこの図の拡大版をご覧になるにはこちらをクリックしてください。

図2. トルエン、エチルベンゼンとカラムと検出器との間に追加された様々なデッドボリュームとHPLCシステムに注入プロピルベンゼンのクロマトグラフオーバーレイ。 この図の拡大版をご覧になるにはこちらをクリックしてください。

反応流列の設計図3.イラスト。 この図の拡大版をご覧になるにはこちらをクリックしてください。
tp_upload / 53462 / 53462fig4.jpg "/>
図4.インストゥルメンタルは、RF-PCDの設定。(A)単一の試薬 ( すなわち 、DPPH•またはフルオレスカミン誘導体化試薬)及び(B)デュアル試薬( すなわち 、4-aminoantipyreneとフェリシアン化カリウム誘導体化試薬)。 表示するには、こちらをクリックしてください。この図の拡大版。

2,2-ジフェニル-1- picrylhydrazilラジカル(DPPH•)を使用して、ポストカラム誘導体化後の検出とリステロットコーヒーの分離 図5 クロマトグラム。誘導体化は500μlの反応コイル(A)と、従来のカラムを用いて行きました反応流カラム(B )>栄。 この図の拡大版をご覧になるにはこちらをクリックしてください。

後PCD試薬としてフルオレサミンを使用して、ポストカラム誘導体化によって検出された10〜1,000 ppmの範囲にわたって4個のアミノ酸(グリシン(G)、ロイシン(L)、フェニルアラニン(P)およびトリプトファン(T))の 図6 クロマトグラフのオーバーレイHPLCによる分離 。 (A)は、従来のPCD、(B)RF-PCD、および(C)RF-PCDから中央(非誘導体化)ポート:次のようにクロマトグラムは、 この図の拡大版をご覧になるにはこちらをクリックしてください。
_upload / 53462 / 53462fig7.jpg "/>
グリシン(最初のピーク)と、従来のPCD(赤のトレース)とRF-PCD(黒のトレース)からロイシン(第2ピーク)のために得られる信号の 図7 の比較。 この図の拡大版をご覧になるにはこちらをクリックしてください。

(A)保持時間および(B)ピークボリュームに基づいによるトリプトファンピークの図8.ピーク幅比較。黒のトレースは、従来のPCD法を示し、赤色のトレースは、RF-PCD法を示し、緑のトレースが示していますRF-PCD法の中心港から誘導体化されていないストリーム。 この図の拡大版をご覧になるにはこちらをクリックしてください。

人工的なサンプルの 図9 クロマトグラフィー分離。成分は、フェノール(P)、4-メトキシフェノール(M)、p個の -cresol(C)およびトコフェロール(T)、ならびに多数のアルキルベンゼン、多核芳香族炭化水素、アニソール、phentanoleを含みますカフェイン、フェニルアラニンおよびベンズアミド。 IIのI、及びiiiラベルされたピークは、予想外に誘導体化方式に応答したアルキルベンゼンです。赤色トレースは500 nmで誘導体化された応答を表す黒のトレースを254nmでUV検出器を用いて誘導体化されていない応答を表します。誘導体化された応答が反転された映像の明瞭さのために注意してください。 この図の拡大版をご覧になるにはこちらをクリックしてください。
 p個の -cresolの 図10. クロマト応答赤いトレースは500 nmで誘導体化(RF-PCD)の応答を表している。黒のトレースは、254nmのUV検出器を用いて誘導体化されていない応答を表す。 の拡大版をご覧になるにはこちらをクリックしてください。この図。
p個の -cresolの 図10. クロマト応答赤いトレースは500 nmで誘導体化(RF-PCD)の応答を表している。黒のトレースは、254nmのUV検出器を用いて誘導体化されていない応答を表す。 の拡大版をご覧になるにはこちらをクリックしてください。この図。
| 反応型 | グリシン | ロイシン | フェニルアラニン | トリプトファン | ||||
| LOD(PPM) | LOQ(PPM) | LOD(PPM) | LOQ(PPM) | LOD(PPM) | LOQ(PPM) | LOD(PPM) | LOQ(PPM) | |
| RF-PCD | 6 | 25 | 10 | 100 | 25 | 250 | 50 | 250 |
| RF-PCD中央ポート(非誘導体化) | 検出されず | 検出されず | 検出されず | 1 | 10 | |||
| 従来のPCD | 10 | 100 | 50 | 500 | 50 | 500 | 100 | 500 |
HPLCによる分離後誘導体化試薬としてカミン使用して別のポストカラム誘導体化システムによって検出された四つの異なるアミノ酸の検出および定量の 表1 を制限します。
Subscription Required. Please recommend JoVE to your librarian.
Discussion
RF-PCDは、バンドの広がりの影響を最小化し、分離性能を向上させる、反応コイルを使用することなくHPLC廃液ポストカラムで誘導体化試薬の効率的な混合を可能にします。 RF-PCD法はまた、検出方法に対する信号応答の改善を示しています。 Camenzuli ら 28は、エスプレッソコーヒー、試料中のROSの検出のためのDPPH•との反応流列の使用を初めて報告しました。彼らの研究は、種々のDPPH•試薬流量のDPPH•濃度の範囲を試験し、最高のパフォーマンスを達成するRF状態の分析および最適化を含みました。これは、0.1ミリグラムml -1の0.5ミリリットル分のDPPH•試薬の流量でのDPPH•濃度は-1 RF-PCDの下で改善された分離性能( すなわち 、効率性と感度)のための最適であると結論しましたDPPH•誘導体化の従来のPCD法に比べて条件。 図5は、エスプレッソコーヒーサンプル中の抗酸化物質のDPPH•アッセイを利用して2つのクロマトグラムを示しています。特に興味深いの約5分の保持時間を有する高強度のピークがあります。従来のDPPH•誘導体化方法の典型である500μlの反応ループを使用する場合、単一のブロードなピークが観察できることが分かります。 RF-PCD法は、反応ループを必要とせずに使用した場合しかし、それは、単一のピークが500μlのループを使用して、実際には二つのピークで観察されていることが明らかとなります。 RF-PCDの設定を使用するときに更に、追加の詳細は、5.5分後に見ることができます。したがって、DPPH•、RF-PCDの技術を使用して、試料中のROSの分析のためのDPPH•を使用してROS分析する従来の方法よりも優れていることが判明しました。
RF-PCDとフルオレサミン試薬は、一次アミノ酸の分析のために利用され、フルオレサミン20とPCDの従来の形態と比較しました。廃液とフルオレサミン間の誘導体化は、紫外線を介してRFエンドフィッティングの外側領域に着手し、検出されたRFカラムエンドフィッティング多重検出のためのプラットフォームを提供し、またあるので、誘導体化されていない中央流は、UV-Visのを経由して監視しましたヴィス。 4個のアミノ酸を含有する試験規格一連の多重RF-PCDの条件で分析した。 図6は、PCD( 図6A)とRF-PCD誘導体化を(検出( 図6B)および誘導体化されていない( 図の従来の方法のためのクロマトグラフィープロフィールとを比較します6C))のアミノ酸の一連の図7は、従来の PCDとRF-PCDを経て得られた二つのアミノ酸シグナルのオーバーレイである図 。ことが分かるTによるより効率的な観測分離彼は、反応ループの除去は全てのカラム流出物を誘導体化したという事実にもかかわらず、より高い信号応答をもたらしました。さらに、より効率的な誘導体化試薬混合方式はさらに、信号対雑音比を増加させる、より低いベースラインノイズをもたらしました。この効果は、表1において、従来のPCD法に比べてRF-PCD法について算出検出および定量の下限内で支持されている。この傾向はまた、DPPH•に抗酸化応答がために大きい、図5に見ることができます従来のPCD法に比べてRF-PCD法。有意なピークの低下は、従来のPCDの設定は、この方法の低い信号応答をもたらすに使用したクロマトグラムで観察することができます。
RF-PCD(両方誘導体化および非誘導体化ストリーム)と、従来のPCDによって分析すると、 図8は、トリプトファンのピークプロファイルを比較します。ピークプロファイルは、時間に対してプロットされている場合、ピーク幅は、全て( 図8A)広く類似していると思われます。ピークプロファイルは、ピークボリューム( 図8B)に対してプロットされている場合、従来のPCDと比較して、RF-PCDで見つかった改善点は明白です。ピーク体積に対してプロットしたとき、RF-PCDピークが誘導体化されていないピークに比べて劣化の少量を示している、分解は、しかしながら、従来のPCD法で観察されたものと比較して最小であることは明らかです。従来のPCDと比較して、RF-PCDの分離効率の向上は、従来のPCDとRF-PCDの両方により誘導体化した後、グリシンおよびロイシンのピーク形状を比較して、図7に例示されています。 RF-PCDモードで信号が2つのピークの間ずっと長い期間のベースラインであるとき、従来のPCDモードグリシンおよびロイシンピークはほとんどベースライン分離されていることがわかります。
アン従来のPCD法に比べてRF-PCDの追加の利点は、多重化された検出を可能にするRF列の中央のポートから誘導体化されていないの流出を監視する機能です。 RFエンドフィッティング内のフリットの設計は、半径方向中央領域における流れはエンドフィッティングの周辺領域の流れと混合することはできませんので、これは可能であり、したがっての外側領域から誘導体化されたストリームのモニタリングを可能にしますフィッティングだけでなく、中央のポートからの誘導体化されていないストリームの監視。 (280nmで)非誘導体化する場合、この機能は、フルオレサミン20によって誘導体化後の悪い信号応答を有することが知られている表1にトリプトファンについて得られた結果によって強調されるが、他のアミノ酸と異なり、それは、UV検出器の応答を示します。検出および定量の限界は比較的高かった両方の誘導体化システムでは、検出および定量のが限界はtについてはるかに低かったです彼はストリームを非誘導体化。両方の誘導体化および非誘導体化流出物を監視する能力を使用して検出パラメータは、各アミノ酸についての性能の最大レベルを与えるように最適化することができるストリーム。
RFエンドフィッティングのマルチポート設計は、デュアル誘導体化試薬の分析を可能にします。セリムら 23は、4 aminoantipyrene及びフェリシアン化カリウムを用いて、PCDの従来技術に比べてフェノール化合物の分析のためのRF-PCDの条件を使用して2つの試薬 (4-aminoantipyrene及びフェリシアン化カリウム)の性能を調べました。 PCD技術のこのタイプは、2つのポンプを必要とし、DPPH•のための1つのポンプと反応ループとは対照的に、反応は、各誘導体化試薬のためにループします。種々のフェノール及びアルキルベンゼン化合物は、従来のRF PCD条件下で分析しました。事実は、未検出に興味深いことに、従来の方法で検出されなかった非フェノール化合物でしたデルRF-PCD条件。 図9は、UV-Visのクロマトグラフィーの応答と、標準的なテストミックスにRF-PCD比色応答を示しています。 図10で観察されるようにRF-PCDは分離性能を損なうことなく、計装の面で単純化PCD技術を提供する。RF-PCDによっても誘導体化せずに分析すると、 図10 は、p -cresolのピークプロファイルを比較します。 RF-PCDのクロマトグラムのピーク幅は、誘導体化されていないクロマトグラムと非常に類似していることがわかります。 2つのクロマトグラムの主な違いは、RF-PCDのクロマトグラムがベースで少し広くなっていることです。これは、RF-PCD法に少なく、ピーク分散体に存在することを示しています。同様の反応は、それだけではなく、その誘導体化されていないピークに比べてRF-PCDにより誘導体同様のピーク幅を有するp個の -cresolピークであることを示している。図9で観察したが、すべてのフェノール類とアルキル誘導体化方式に応答したlbenzenesは、これと同じ傾向を示しました。 2誘導体化試薬を用いてRF-PCDは、従来の非誘導体化法に類似した分離性能が得られ、が、RF-PCDは、非誘導体化された条件下では検出されなかった一つは、フェノール化合物の選択的検出のために許可されました。
RF-PCDは、従来のHPLC-PCD法の開発は、このような移動相組成物として一般的なHPLC法で使用可能なチューニング・ツールの全て及び流量であるため、注入量及び分析波長はRF-PCD法に適用可能です。さらに、このようなPCD試薬流量比ならびにPCD試薬組成物を移動相として、従来のHPLC-PCD法で使用可能なチューニング・ツールは、RF-PCD法に適用可能です。従来のPCD法では利用できない利用可能な追加のチューニングツールRF-PCDを使用して、中枢および末梢からの流れの比であり、列のポート。フローは、(中央のポートからの流れが検出されない場合、またはポストカラム)の長さおよび/または後検出器の内径を制御することにより、ライン毎に相対的な背圧を変えることによって制御されているチューブ。周辺の流れの中心の最適な比率は、中央ポートが検出されているか否か、問題の反応、ならびに他の要因に依存します。末梢および40%中央の60%の流量比は、多くの場合、良好な出発点です。
チューニングパラメータと同様に、RF-PCDのカラムを使用して生じ得る問題の多くは、従来のPCD法と共通です。クロマトグラファーが実行してRF-PCD分析する場合に注意する必要がある一つの特定のパラメータは、特に、その試薬ポンプ(複数可)の、システム内の流量と圧力の安定性です。システム内の流れが安定していない場合は、ベースラインの不安定性は、したがって減少引き起こし得ます信号対雑音比にし、定量および検出のその後限界。
RF-PCDクロマトグラフィーは、現代のHPLCカラムおよびシステムPCD反応を適応の困難を克服するために開発されました。従来のPCD法と比較して、RF-PCDの主な利点は、それがRFカラムのエンドフィッティング内のフリットの内部で行われているにより効率的な混合であり、この混合はわずかに高い背圧です。これは、最小化または多くの従来のPCDの方法において使用される大容量の反応ループも排除することを可能にします。ポストカラムデッドボリュームのこの最小化により、より高いクロマトグラフ分解能で、より効率的な分離を行うことができます。
RF-PCDモードは、従来のPCD法と比較してノイズの分離効率、ピーク形状および信号の改善をもたらしました。しかし、信号の改善が検出器に依存していることに留意することが重要です。例えば、検出器のための依存そのサンプル量は、従来の方法と比較してRF-PCD条件下での信号応答の増加を示さないかもしれません。従来の方法の下で、カラムサンプルの100%が検出されるので、RF-PCD条件下でカラムにサンプルのみを一定の割合を分割比に応じて検出された場合、これは、そうです。しかし、RF-PCDの反応は(限り、両方の試薬が同時に添加されているように)最小の再最適化PCD反応の任意の一つまたは二つの試薬に適合させることができるようになることが予想されるとの利点は、3つすべてについて観察されたものこれまでに試験された反応は、他のすべてのPCDの反応に変換します。
Subscription Required. Please recommend JoVE to your librarian.
Materials
| Name | Company | Catalog Number | Comments |
| HPLC instrument | Agilent | 1290 Series HPLC | |
| Additional Pump(s) for derivatization system | Shimadzu | LC-20A | |
| RF colum | Non-commercial | ||
| PEEK tubing | Sigma Aldrich | Z227307 | |
| Column stoppers | Provided with column | ||
| PEEK tube cutter | Sigma Aldrich | Z290882 | |
| Analytical Scale Balance | 4-point analytical balance | ||
| Stop watch | Non-Scientific equiptment | ||
| Eluent collection vials | Any Small vial with a flat bottom will do, e.g., HPLC vials | ||
| HPLC Vials | Will depend on instrument used | ||
| Vessels for mobile phase and derivatization solution(s) | Sigma Aldrich | Z232211 | |
| General Laboratory glassware | Volumetric Flasks, pippettes, etc. Quantity and volumes will depend on sample preparation method. | ||
| Methanol | Sigma Aldrich | 34860 | |
| DPPH | Sigma Aldrich | D9132 | |
| Ammonium Acetate | Sigma Aldrich | 17836 | |
| Ammonia | Sigma Aldrich | 320145 | Corrosive |
| Acetonitrile | Sigma Aldrich | 34998 | |
| Fluorescamine | Sigma Aldrich | F9015 | |
| 4-aminoantipyrene | Acros Organics BVBA | AC103151000 | |
| Potassium ferricyanide | AnalaR | B10204-30 |
References
- Srijaranai, S., et al. Use of 1-(2-pyridylazo)-2-naphthol as the post column reagent for ion exchange chromatography of heavy metals in environmental samples. Microchem. J. 99, 152-158 (2011).
- Kubickova, A., Kubicek, V., Coufal, P. UV-VIS detection of amino acids in liquid chromatography: online post-column solid-state derivatization with Cu(II) ions. J Sep Sci. 34, 3131-3135 (2011).
- Quinto, M., Spadaccino, G., Palermo, C., Centonze, D. Determination of aflatoxins in cereal flours by solid-phase microextraction coupled with liquid chromatography and post-column photochemical derivatization-fluorescence detection. J. Chromatogr. A. 1216, 8636-8641 (2009).
- Lee, M., Lee, Y., Soltermann, F., von Gunten, U. Analysis of N-nitrosamines and other nitro(so) compounds in water by high-performance liquid chromatography with post-column UV photolysis/Griess reaction. Water Res. 47, 4893-4903 (2013).
- Niu, Y., et al. Identification of isoflavonoids in Radix Puerariae for quality control using on-line high performance liquid chromatography-diode array detector-electrospray ionization-mass spectrometry coupled with post-column derivatization. Food Res Int. 48, 528-537 (2012).
- Zacharis, C. K., Tzanavaras, P. D. Liquid chromatography coupled to on-line post column derivatization for the determination of organic compounds: a review on instrumentation and chemistries. Anal. Chim. Acta. 798, 1-24 (2013).
- Dousa, M., Brichac, J., Gibala, P., Lehnert, P. Rapid hydrophilic interaction chromatography determination of lysine in pharmaceutical preparations with fluorescence detection after postcolumn derivatization with o-phtaldialdehyde. J Pharm Biomed Anal. 54, 972-978 (2011).
- Iijima, S., et al. Optimization of an Online Post-Column Derivatization System for Ultra High-Performance Liquid Chromatography (UHPLC) and Its Applications to Analysis of Biogenic Amines. Anal Sci. 29, 539-545 (2013).
- Cunico, R. L., Schlabach, T. Comparison of Ninhydrin and o-Phthalaldehyde Postcolumn Detection Techniques for High Performance Liquid Chromatography of Free Amino. J. Chromatogr. A. 1983, 461-470 (1983).
- Donahue, E. P., Brown, L. L., Flakoll, P. J., Abumrad, N. N. Rapid Measurement of Leucine-specific Activity in Biological Fluids by Ion-exchange Chromatography and Post-column Ninhydrin Detection. J. Chromatogr. A. 571, 29-36 (1998).
- Udenfriend, S., et al. Fluorescamine: A Reagent for Assay of Amino Acids, Peptides, Proteins and Primary Amines in the Picomole Range. Science. 1972, 871-872 (1972).
- Samejima, K. Separation of Fluorescamine Derivitices of Aliphatic Diamines and Polyamines by High Speed Liquid Chromatography. J. Chromatogr. A. 96, 250-254 (1974).
- Zhang, Y., et al. Evaluation of antioxidant activity of ten compounds in different tea samples by means of an on-line HPLC-DPPH assay. Food Res Int. 53, 847-856 (2013).
- Niu, Y., et al. Identification of the anti-oxidants in Flos Chrysanthemi by HPLC-DAD-ESI/MS(n) and HPLC coupled with a post-column derivatisation system. Phytochem Anal. 24, 59-68 (2013).
- Raudonis, R., Bumblauskiene, L., Jakstas, V., Pukalskas, A., Janulis, V. Optimization and validation of post-column assay for screening of radical scavengers in herbal raw materials and herbal preparations. J. Chromatogr. A. 1217, 7690-7698 (2010).
- Raudonis, R., Raudone, L., Jakstas, V., Janulis, V. Comparative evaluation of post-column free radical scavenging and ferric reducing antioxidant power assays for screening of antioxidants in strawberries. J. Chromatogr. A. 1233, 8-15 (2012).
- Zakrzewski, R. Determination of Methimazole in Pharmaceutical Preparations using an HPLC Method Coupled with an Iodine-Azide Post-Column Reaction. J. Liq. Chrom. Rel. Technol. 32, 383-398 (2008).
- Zakrzewski, R. Development and validation of a reversed-phase HPLC method with post-column iodine-azide reaction for the determination of thioguanine. J. Anal. Chem. 64, 1235-1241 (2009).
- Gritti, F., Guiochon, G. Accurate measurements of the true column efficiency and of the instrument band broadening contributions in the presence of a chromatographic column. J. Chromatogr. A. 1327, 49-56 (2014).
- Stewart, J. T. Post cotumn derivatization methodology in high performance liquid chromatography (HPLC). Trends Anal. Chem. 1, 170-174 (1982).
- Rigas, P. G. Post-column labeling techniques in amino acid analysis by liquid chromatography. Anal. Bioanal. Chem. 405, 7957-7992 (2013).
- Frei, R. W. Reaction Detectors in Modern Liquid Chromatography. Chromatographia. 15, 161-166 (1982).
- Pravadil-Cekic, S., et al. Using Reaction Flow Chromatography for the Analysis of Amino Acid: Derivatisation With Fluorescamine Reagent. Microchem. J. , (Accepted Manuscript) (2015).
- Camenzuli, M., Ritchie, H. J., Dennis, G. R., Shalliker, R. A. Parallel segmented flow chromatography columns with multiplexed detection: An illustration using antioxidant screening of natural products. Microchem. J. 110, 726-730 (2013).
- Koleva, I. I., Niederlander, H. A. G., van Beek, T. A. An On-Line HPLC Method for Detection of Radical Scavenging Compounds in Complex Mixtures. Anal Chem. 72, 2323-2328 (2000).
- Selim, M., et al. A Two-component Post-column Derivatisation Method Utilsing Reaction Flow Chromatography. Microchem. J. 116, 87-91 (2014).
- Bigley, F. P., Grob, R. L. Determination of Phenols in Water and Wastewater by Post-column Reaction Detection High-performance Liquid Chromatography. J. Chromatogr. A. 350, 407-416 (1985).
- Camenzuli, M., Ritchie, H. J., Dennis, G. R., Shalliker, R. A. Reaction flow chromatography for rapid post column derivatisations: The analysis of antioxidants in natural products. J. Chromatogr. A. 1303, 62-65 (2013).



