Protocol voor HER2 vissen combineren van de voordelen van Cryo-behoud en formaline fixatie met een niet-kruis-mailkoppeling, formaline-gratis weefsel fixatief
Summary
Fluorescentie in situ hybridisatie (FISH) is vaak vereist in combinatie met histopathologie en moleculaire diagnostiek voor selectie van therapie in gepersonaliseerde geneeskunde. Een nieuwe niet-kruis-mailkoppeling, formaline-gratis weefsel-fixeerspray waarmee hoge kwaliteit morfologische, moleculaire en vis analyses van het zelfde model door toevoeging van een na fixatie stap voordat vis wordt aangeboden.
Abstract
Morfologische beoordeling van formaline-vaste, paraffine-ingebedde weefselsteekproeven van (FFPE) is de gouden standaard voor kanker diagnostiek voor decennia als gevolg van haar uitstekende behoud van morfologie. Gepersonaliseerde geneeskunde biedt steeds meer individueel aangepast en gerichte therapieën voor gekarakteriseerd afzonderlijke ziekten ingeschakeld door gecombineerde morfologische en moleculair analytische technieken en diagnostiek. Prestaties van morfologische en moleculaire tests uit de dezelfde FFPE monster is uitdagend vanwege de negatieve impact van formaline door chemische wijziging en cross-linking van nucleïnezuren en proteïnen. Een niet-kruis-mailkoppeling, formaline-gratis weefsel fixatief heeft onlangs ontwikkeld om te voldoen aan beide eisen, dat wil zeggen, voor het behoud van de morfologie zoals FFPE en biomoleculen zoals cryo-behoud. Aangezien vis vaak in combinatie met histopathologie en moleculaire diagnostiek vereist is, testten we de toepasselijkheid van vis protocollen betreffende weefsels behandeld met deze nieuwe fixeerspray. We vonden dat na fixatie van formaline van histologische secties van niet-kruis-linking, formaline-vrije en paraffine-ingebedde (NCFPE) borst kanker weefsel gegenereerd gelijkwaardige resultaten voor mensen met FFPE weefsel in menselijke epidermale groeifactor receptor 2 (HER2) FISH-analyse. Dit protocol beschrijft hoe een vis assay oorspronkelijk ontwikkeld en gevalideerd voor FFPE weefsel kan worden gebruikt voor NCFPE weefsels door een eenvoudige stap na fixatie van histologische secties.
Introduction
Gepersonaliseerde geneeskunde afhankelijk steeds meer van Multi-parameter proeven waarbij morfologische en moleculair weefsel analyses. Formaline fixatie van weefsels als de gouden standaard biedt uitstekende morfologische kwaliteit1,2. Echter interfereert formaline-geïnduceerde chemische modificatie en cross-linking van proteïnen en nucleïnezuren3,4,5 negatief met moleculaire analyse6. Deze moleculaire wijzigingen beperken de kwaliteit van nucleïnezuren en proteïnen en kan resulteren in gen reeks artefacten7 of verminderde gevoeligheid van de polymerase-kettingreactie (PCR)-gebaseerd testen8. Hoewel grote inspanningen werden meegenomen naar het optimaliseren van moleculaire tests voor FFPE weefsel, is cryo-behoud van weefsels in algemene superieur aan formaline fixatie, waardoor het noodzakelijk wordt om te splitsen weefselmonsters voor behoud van de verschillende procedures. Om te voorkomen dat de behoefte aan cryo-behoud voor moleculaire analyses, een niet-kruis-mailkoppeling, formaline-vrije kleefpoeders, PAXgene weefsel werd ontwikkeld. Dit commercieel beschikbare systeem bestaat uit een fixatie en een stabilisatie oplossing met verschillende alcoholen, azijnzuur en een oplosbare organische verbinding. Goede behoud van nucleïnezuren, eiwitten (phospo) en morfologie werd getoond in verscheidene studies6,9,10,11,12,,13.
Een bepaalde toepassing in kanker diagnostiek is vis opsporen van een brede waaier van chromosomale wijzigingen, zoals translocaties, submicroscopische verwijderingen en amplifications 14. Bijvoorbeeld, twintig procent van de invasieve borst kanker tumoren Toon versterking van de menselijke epidermale groeifactor receptor 2 (HER2) gene15,16,17, die geassocieerd met een slechte prognose18 wordt ,19. Bepaling van de HER2 overexpressie en versterking status bij borstkanker door vis nodig is om te kiezen van patiënten voor anti-HER2-gerichte therapie en is een metgezel diagnostische vermeld door de Federal Drug Association (FDA) (http://www.fda.gov/ MedicalDevices/ProductsandMedicalProcedures/InVitroDiagnostics/ucm301431.htm)17. In staat te stellen een brede toepassing van vis gebaseerde metgezel diagnostiek in de gezondheidszorg zijn testen ontwikkeld en goedgekeurd voor FFPE weefsels.
In een eerdere studie toonden we dat NCFPE weefsels kunnen niet worden gebruikt voor het testen van de vis die zijn goedgekeurd voor FFPE weefsel. Tests van tijd reeks andere post fixatie procedures van NCFPE weefsels met 4% gebufferd formaldehyde bleek dat fixatie tijden van 18 h of langer van NCFPE weefselsecties post bereikt echter gelijkwaardige resultaten voor mensen met FFPE weefsels14.
In deze studie, wij bieden een gedetailleerd protocol en aantonen dat de gevolgen van niet-kruis-mailkoppeling, formaline-gratis weefsel fixatie en 24 h 4% gebufferd formaldehyde na fixatie op secties gebruikt voor HER2 vis en RNA kwaliteit uit de dezelfde primaire weefsel monster.
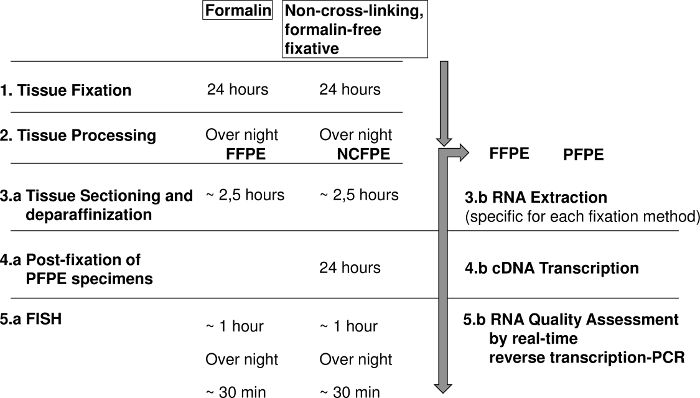
Figuur 1: Diagram toont de stappen voor fluorescentie in situ hybridisatie (FISH) en RNA analyse van formaline vaste paraffine ingesloten (FFPE) en niet-Kruis-koppeling, formaline-vrije vaste paraffine ingebedde weefsels (NCFPE). Klik hier voor een grotere versie van dit cijfer.
Protocol
Representative Results
Discussion
De resultaten tonen aan dat twee belangrijkste bevindingen. Eerst is een eenvoudige 24u SBFS na fixatie stap van de secties gesneden uit NCFPE weefsels voldoende om het verkrijgen van gelijkwaardige resultaten voor mensen met FFPE in de vis analyses met behulp van vis testen voor FFPE weefsels goedgekeurd (Zie ook naslaginformatie14). Dit protocol heeft het voordeel van het gebruik van vis tests oorspronkelijk ontwikkeld en goedgekeurd voor FFPE zonder de behoefte aan uitgebreide revalidatie (bijvoorbeeld door het optimaliseren van de pre kruising voorwaarden voor non-cross-linked weefsel). Precies zoals beschreven in de instructies van de fabrikant kan de vis-protocol worden gebruikt.
Kleine wijzigingen van de instructies van de manufacturer´s beschreven in dit protocol (bijvoorbeeld weefsel sectie diameter en incubatie periodes in de deparaffinization stappen) resultaat van eerdere aanpassingen, die uitdrukkelijk door de fabrikant is aanbevolen Als gevolg van het gebruik van verschillende weefseltypes (HLA) en fixatie methoden.
De stap na fixatie is essentieel, omdat het vereist een chemische reactie tijd van 18-24 h, die strekt zich uit de tijd van de analyse door een dag maar staat dezelfde dagelijkse workflow ontwikkeld voor FFPE weefsels (Figuur 1). SBFS wordt gemeld dat het weefsel op een gemiddelde van 1 mm per uur,22 tot en met 5 mm in 2 h afhankelijk van het type23,24van weefsel doordringen. De observatie dat alleen na fixatie langdurig van meer dan 18 h kon veranderen de eigenschappen van NCFPE naar FFPE afdelingen, geeft aan dat er sprake is van cruciaal belang voor het bereiken van de gewenste resultaten1 niet de penetratie van de fixeer, maar de chemische reactie tijd ,14.
Ten tweede, het resterende weefsel van de NCFPE die niet voor fixatie van de post gebruikt wordt kan worden gebruikt voor verdere moleculair analyses zoals de biomoleculen goed bewaard gebleven zijn. Dit werd aangetoond door real-time omgekeerde transcriptie PCR (Figuur 3). De bepaling is meer gevoelig en specifiek zijn dan het electropherogram afkomstige RIN waarde (RNA integriteit nummer) met betrekking tot kwaliteit van de RNA (dat wil zeggen, chemische modificatie en fragmentatie) voor mRNA geïsoleerd van paraffine-ingebedde weefsels8. Kwaliteitscontrole was beperkt in deze studie tot PCR in real time aangezien onafhankelijke groepen hebben aangetoond dat naast RNA, de kwaliteit van DNA en eiwitten geïsoleerd van NCFPE beter dan die van FFPE weefsels 8,9, is 13.
Het protocol gepresenteerd volgt, indien van toepassing (bijv. SBFS recept, fixatie voorwaarden, de controle van de kwaliteit van het RNA, validatie), de eisen van de technische specificaties van de CEN voor vooraf analytische procedures voor in-vitro diagnostiek (IVD), die hebben onlangs vrijgegeven door het Europees Comité voor normalisatie (CEN) (bijvoorbeeld CEN/TS 16827-1:2015 voor RNA-isolatie uit FFPE weefsels waarin wordt verwezen naar de ISO 15189 norm).
De methode is beperkt tot deze specifieke fixeerspray. Hoewel het goede behoud van biomoleculen en morfologie met behulp van de niet-cross-mailkoppeling, formaline-gratis fixeerspray is gepresenteerd in verschillende studies, wordt het voornamelijk gebruikt in onderzoek maar niet in routine medische toepassingen. Een van de redenen is dat vervanging van de goudstandaard SBFS fixatie door een ander fixeer een verscheidenheid van validatieonderzoek vereisen zou aangezien niet alle protocollen die zijn geoptimaliseerd voor FFPE materiaal kunnen worden gebruikt voor materialen met niet-kruis-mailkoppeling fixatives bevestigd. Andere weefsel fixatie methoden werden niet getest voor deze vis-protocol.
De eenvoudige na fixatie stap beschreven in dit manuscript heeft het voordeel van het gebruik van IVD goedgekeurde testen beide voor FFPE en NCFPE weefsels.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Wij danken het team van het laboratorium voor moleculaire pathologie bij het Instituut van de pathologie van de medische Universiteit Graz voor hun expertise en ondersteuning. Bovendien, wij danken Iris Kufferath en Daniela Pabst voor technische bijstand, Bernadette Rieger en Sylvia Eidenhammer voor de verwerking van de HER2-gevallen en Kinga Szurian (patholoog) alsmede Tamas Regényi (3DHISTEC). Wij danken Penelope Kungl voor proeflezen van het manuscript. Dit werk heeft financieel ondersteund door het Christian Doppler onderzoeksfonds, het Oostenrijkse federale ministerie van wetenschap, onderzoek en economie en de nationale Stichting voor onderzoek, technologie en ontwikkeling.
Materials
| SAV LP GmbH, Flintsbach a. I., Germany | www.sav-lp.de | FN-200L-4-1 | Tissue fixative |
| Simport Plastic Ltd., Beloeil, Canada | www.simport.com | M-498 | Safekeeping device providing labelling, fixation and paraffin embedding for tissue samples. |
| Qiagen GmbH, Hilden Germany | www.qiagen.com | 765112 | For collection, fixation, and stabilization of tissue samples: 10 Prefilled Reagent Containers, containing PAXgene Tissue FIX and PAXgene Tissue STABILIZER. |
| ThermoFisher Scientific | www.thermofisher.com | 813150 | Processing of biological specimens from chemical fixation to paraffin infiltration |
| Merck Millipore, Munich, Germany | www.analytics-shop.com/de/hersteller/millipore.html | MC1009834000 | Dehydration of tissue samples |
| VWR Chemicals, Darmstadt, Germany | https://at.vwr.com | 10293EP | Dehydration of tissue samples |
| ACM Herba Chemosan Apotheker AG, Vienna, Austria | www.herba-chemosan.at | 2549662 32 | Paraffin used in a tissue processing device |
| Leica Mikrosysteme Handels GmbH, Vienna, Austria | www.LeicaBiosystems.com | 39602004 | Paraffin embedding medium |
| Sanova Diagnostik, Vienna, Austria | www.sanova.at | 5229 | Paraffin embedding instrument for tissues for histology |
| Histocom Medizintechnik Vertriebs GmbH, Wiener Neudorf, Austria | www.histocom.info | M 910010 | This device is used for especially sophisticated paraffin sectioning techniques in biology and medicine. Only skilled or specially trained personnel must operate the microtome, i.e. clamping the specimen, trimming, sectioning and taking off the sections from the instrument. |
| Dako Denmark A/S, Glostrup, Denmark | www.chem.agilent.com | K802021-2 | Coated glass slides, intended for mounting formalin-fixed, paraffin-embedded tissue sections. |
| Qiagen GmbH, Hilden Germany | www.qiagen.com | 73504 | For purification of total RNA from formalin-fixed, paraffin-embedded tissue sections |
| Qiagen GmbH, Hilden Germany | www.qiagen.com | 765134 | For purification of total RNA from PAXgene-fixed, paraffin-embedded tissue sections |
| ZytoVision GmbH, Bremerhaven, Germany | www.zytovision.com | Z-2015-200 | For the detection of ERBB2 (a.k.a HER2) gene amplification frequently observed in solid malignant neoplasms e.g. breast cancer samples. |
| 3DHISTEC, Budapest, Hungary | www.3dhistech.com | Digital device for scanning tissue slides equipped with a 40x/1.2 NA objective, Quad band filters (DAPI/FITC/TRITC/Cy5) filters and a 5.5Mpx, 16 bit, cooled scientific CMOS (Complementary Metal Oxide Semiconductor) camera. | |
| ThermoFisher Scientific | www.thermofisher.com | 4368814 | The High Capacity cDNA Reverse Transcription Kit contains all components necessary for the quantitative conversion of up to 2 µg of total RNA to single-stranded cDNA in a single 20 µL reaction. |
| ThermoFisher Scientific | www.thermofisher.com | 4367659 | PCR Master Mix containing polymerase, nucleotides and SYBR Green for PCR and quanitification of amplicons. |
| ThermoFisher Scientific, Wilmington, DE | www.thermofisher.com | Ser. Nr. F239 | Spectrophotometer for nucleic acid quantification. |
| QuantStudio 7 Flex Real-time PCR System | www.thermofisher.com | 4485701 | PCR machine, |
| Vysis/Abbott Laboratories. Abbott Park, Illinois, U.S.A | www.molecular.abbott/us/en/products/instrumentation/thermobrite#order | e.g. (ThermoBrite) 07J91-020 | Temperature controlled slide processing system for in-situ denaturation/hybridization procedures. |
References
- Fox, C. H., Johnson, F. B., Whiting, J., Roller, R. P. Formaldehyde fixation. J. Histochem.Cytochem. 33 (8), 845-853 (1985).
- Oosterhuis, J. W., Coebergh, J. W., van Veen, E. B. Tumour banks: well-guarded treasures in the interest of patients. Nat. Rev. Cancer. 3 (1), 73-77 (2003).
- Masuda, N., Ohnishi, T., Kawamoto, S., Monden, M., Okubo, K. Analysis of chemical modification of RNA from formalin-fixed samples and optimization of molecular biology applications for such samples. Nucleic Acids Res. 27 (22), 4436-4443 (1999).
- Metz, B., Kersten, G. F., Hoogerhout, P., Brugghe, H. F., Timmermans, H. A., de Jong, A., et al. Identification of formaldehyde-induced modifications in proteins: reactionswith model peptides. J. Biol. Chem. 279 (8), 6235-6243 (2003).
- Evers, D. L., Fowler, C. B., Cunningham, B. R., Mason, J. T., O’Leary, T. J. The effect of formaldehyde fixation on RNA: optimization of formaldehyde adduct removal. J.Mol. Diagn. 13 (3), 282-288 (2011).
- Groelz, D., Sobin, L., Branton, P., Compton, C., Wyrich, R., Rainen, L. Non-formalin fixative versus formalin-fixed tissue: A comparison of histology and RNA quality. Exp. Mol. Pathol. 94 (1), 188-194 (2013).
- Do, H., Dobrovic, A. Sequence artifacts in DNA from formalin-fixed tissues: causes and strategies for minimization. Clin. Chem. 61, 64-71 (2015).
- Kashofer, K., Viertler, C., Pichler, M., Zatloukal, K. Quality Control of RNA Preservation and Extraction from Paraffin-Embedded Tissue: Implications for RT-PCR and Microarray Analysis. PloS One. 8 (7), e70714 (2013).
- Viertler, C., Groelz, D., Gündisch, S., Kashofer, K., Reischauer, B., Riegman, P. H., et al. A new technology for stabilization of biomolecules in tissues for combined histological and molecular analyses. J. Mol. Diagn. 14 (5), 458-466 (2012).
- Gundisch, S., Slotta-Huspenina, J., Verderio, P., Maura, C., Ciniselli, S. P., Schott, S., et al. Evaluation of colon cancer histomorphology: A comparison between formalin and PAXgene tissue fixation by an international ring trial. Virchows Arch. 465 (5), 509-519 (2014).
- Ergin, B., Meding, S., Langer, R., Kap, M., Viertler, C., Schott, C., et al. Proteomic analysis of PAXgene-fixed tissues. J. Proteome Res. 9 (10), 5188-5196 (2010).
- Kap, M., Smedts, F., Oosterhuis, W., Winther, R., Christensen, N., Reischauer, B., et al. Histological Assessment of PAXgene Tissue Fixation and Stabilization Reagents. PLoS ONE. 6 (11), e27704 (2011).
- Mathieson, W., Marcon, N., Antunes, L., Ashford, D. A., Betsou, F., Frasquilho, S. G., et al. A Critical Evaluation of the PAXgene Tissue Fixation System: Morphology, Immunohistochemistry, Molecular Biology, and Proteomics. Am J Clin Pathol. 146, 25-40 (2016).
- Oberauner-Wappis, L., Loibner, M., Viertler, C., Groelz, D., Wyrich, R., Zatloukal, K. Protocol for HER2 FISH determination on PAXgene-fixed and paraffin-embedded tissue in breast cancer. Int J. Exp. Path. 97 (2), 202-206 (2016).
- Pauletti, G., Godolphin, W., Press, M. F., Slamon, D. J. Detection and quantitation ofHER-2/neu gene amplification in human breast cancer archival material using fluorescence in situ hybridization. Oncogene. 13 (1), 63-72 (1996).
- Owens, M. A., Horten, B. C., Da Silva, M. M. HER2 amplification ratios by fluorescence in situ hybridization and correlation with immunohistochemistry in a cohort of 6556 breast cancer tissues. Clin.Breast Cancer. 5 (1), 63-69 (2004).
- Wolff, A. C., Hammond, M. E., Schwartz, J. N., Hagerty, K. L., Allred, D. C., Cote, R. J., et al. American Society of Clinical Oncology/College of American Pathologists guideline recommendations for human epidermal growth factor receptor 2 testing in breast cancer. Arch Pathol Lab Med. 131 (1), 18-43 (2007).
- Press, M. F., Bernstein, L., Thomas, P. A., Meisner, L. F., Zhou, J. Y., Ma, Y., et al. HER-2/neu gene amplification characterized by fluorescence in situ hybridization: poor prognosis in node-negative breast carcinomas. J. Clin. Oncol. 15 (8), 2894-2904 (1997).
- Yamauchi, H., Stearns, V., Hayes, D. F. When is a tumor marker ready for prime time? A case study of c-erbB-2 as a predictive factor in breast cancer. J. Clin. Oncol. 19 (8), 2334-2356 (2001).
- Paulik, R., Micsik, T., Kiszler, G., Kaszál, P., Székely, J., Paulik, N., Várhalmi, E., Prémusz, V., Krenács, T., Molnár, B. An optimized image analysis algorithm for detecting nuclear signals in digital whole slides for histopathology. Cytometry A. , (2017).
- Applied Biosystems. . QuantStudio 6 and 7 Flex Real-Time PCR System Software. , (2013).
- NCCLS. . Quality Assurance for Immunocytochemistry. , (1999).
- Baker, J. R. . Principles of Biological Microtechnique. , (1958).
- Hewitt, S. M., Lewis, F., Cao, Y., Conrad, R. C., Cronin, M., Danenberg, K. D., et al. Tissue handling and specimen preparation in surgical pathology: issues concerning the recovery of nucleic acids from formalin-fixed, paraffin-embedded tissue. Arch Pathol. Lab Med. 132 (12), 1929-1935 (2008).

