HER2 のプロトコルは、非相互リンク、無料のホルマリン組織固定液を使用して低温保存とホルマリン固定の利点を結合する魚します。
Summary
蛍光の現場の交配 (魚) は、病理と個別化医療の治療法の選択のための分子診断との組み合わせで多くの場合必要です。できる高品質の形態学的、分子と魚解析同じ標本からポスト固定ステップの添加による魚を提示する前に新規非相互リンク、無料のホルマリン組織固定液。
Abstract
ホルマリン固定のパラフィン埋め込まれた (FFPE) 組織サンプルの形態学的評価は、その優れた保存形態のため数十年のがん診断のゴールド スタンダードをされています。個別化医療はますます複合形態と分子解析技術と診断により特徴づけられる個々 の病気の個別に適応し、ターゲットを絞った治療を提供します。同じ FFPE 標本からの形態学的及び分子アッセイのパフォーマンスに化学修飾によるホルマリンの否定的な影響のために挑戦し、核酸やタンパク質の架橋します。非相互リンク、無料のホルマリン組織固定液 FFPE のような形態と低温保存のような生体を維持するために、すなわちの両方の要件を満たすために最近開発しました。魚は、病理組織学的および分子診断との組み合わせでよく必要があるのでこの新しい定着剤と扱われる組織での魚のプロトコルの有効性をテストしました。我々 が見つかりましたそのホルマリンのポスト固定非十字リンク、無料のホルマリンの標本とパラフィン (NCFPE) 乳房癌組織生成相当結果 FFPE 組織とのそれらにひと上皮成長因子受容体 2 (HER2)魚の分析。このプロトコルは、もともと開発および FFPE 組織の検証魚アッセイを組織切片の単純なポスト固定ステップによって NCFPE 組織の使用方法について説明します。
Introduction
個別化医療は、ますますマルチパラ メーター試験形態と分子組織分析に依存します。ゴールド スタンダードとして組織のホルマリン固定は、優れた形態品質1,2を提供します。ただし、ホルマリン誘発の化学修飾とタンパク質と核酸3,4、5の否定的架橋分子解析6と干渉します。これらの分子変更核酸とタンパク質の質の制限し、遺伝子シーケンス工芸品7またはポリメラーゼの連鎖反応 (PCR) の感受性低下があります-ベースの試金8。FFPE 組織分子テストを最適化するために撮影された主要な努力が、組織の低温保存は一般より優れているホルマリン固定組織別の保存プロシージャのサンプルを分割する必要があるのです。分子解析で、非十字リンク、低温保存の必要性を避けるために無料のホルマリン固定、PAXgene 組織開発されました。この市販のシステムは、固定と異なるアルコール、酢酸可溶性有機化合物を含む安定化ソリューションで構成されます。核酸、タンパク質 (phospo)、形態の適正な保全は、いくつかの研究6,9,10、11,12,13に示されました。
がん診断の 1 つの特定のアプリケーションは、増幅14超顕微鏡的削除転座などの染色体変異の包括的な範囲を検出する魚です。たとえば、浸潤性乳癌の腫瘍の 20% 示すひと上皮成長因子受容体 2 (HER2) の増幅遺伝子15,16,17,18, 予後不良に関連付けられています。 ,19。魚による乳癌の HER2 過剰発現と増幅状態の定量指向抗 HER2 療法のために患者を選択するために必要なコンパニオン診断の連邦医薬品協会 (FDA) (http://www.fda.gov/ に記載されています。MedicalDevices/ProductsandMedicalProcedures/InVitroDiagnostics/ucm301431.htm)17。医療における魚基づいてコンパニオン診断の広範なアプリケーションを可能にするための試金は開発され FFPE 組織の承認します。
以前の研究では NCFPE 組織を FFPE 組織の承認された魚アッセイに使用できないことを示した。しかし、ことを示した 4% ホルムアルデヒドと NCFPE 組織の別のポスト固定手順のシリーズ ポスト固定時間 18 時間以上 NCFPE ティッシュ セクションの時間のテストは FFPE 組織14とのそれらに同等の結果を達成しました。
本研究では、詳細なプロトコルを提供し、非相互リンク、無料のホルマリン組織固定・ 24 h 4% の影響を与えるバッファー使用される同じプライマリ組織標本から HER2 魚および RNA の品質のセクションにホルムアルデヒド ポスト固定を示します。
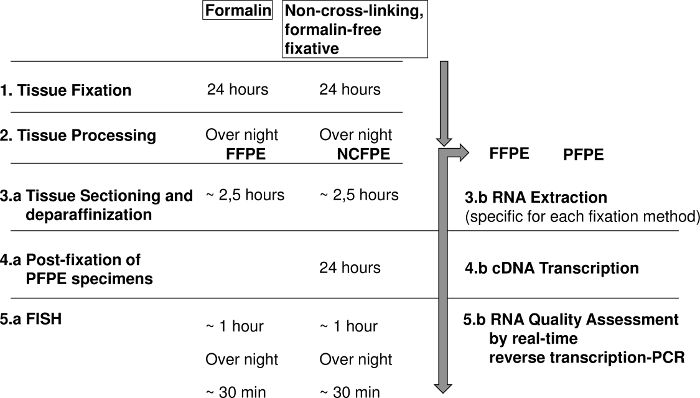
図 1: 蛍光性上皮内交配 (魚) とホルマリン固定パラフィン埋め込まれた (FFPE) と非クロス リンクの RNA 解析の手順を示す図、無料のホルマリン固定パラフィン埋め込まれた組織 (NCFPE) です。この図の拡大版を表示するのにはここをクリックしてください。
Protocol
Representative Results
Discussion
結果は、2 つ主要な調査結果を示します。最初に、セクション NCFPE 組織からカットのシンプルな 24 h リン酸カルシウム ポスト固定ステップです (また見なさい参照14) FFPE 組織の承認された魚の試金を使用して魚分析 FFPE と同等の結果を得るのに十分です。このプロトコルには、もともと開発し、包括的な再認証を必要とせず FFPE 承認 (例えば、組織の非架橋前の交配の条件を最適化する) によって魚の試金を使用しての利点があります。魚のプロトコルは、製造元のマニュアルの説明どおりに使用できます。
メーカーの推奨は明示的に以前の適応からこのプロトコル (例えばティッシュ セクション直径と潜伏期間 deparaffinization ステップで) 結果の manufacturer´s 指示からマイナーな修正異なる組織の種類と固定方法の使用。
ポスト固定ステップは、18-24 時間を 1 日で分析時間が長く、FFPE 組織 (図 1) の開発により、同じ日々 のワークフローの化学反応時間が必要なため重要です。リン酸カルシウムは時間22組織型23,24に応じて 2 h で 5 mm あたり 1 mm の平均レートで組織に浸透されています。18 時間以上の長時間ポスト固定期間のみが NCFPE のプロパティを FFPE のセクションに変更する観察は定着剤が化学反応時間のない浸透1 の目的の結果を達成するため重要であることを示します ,14。
第二に、生体がよく保存されて、ポスト固定のため使用されていない残りの NCFPE 組織をさらに分子分析のため使用できます。リアルタイム逆転写 PCR (図 3) によってこれを示した。アッセイはより敏感なパラフィン包埋組織8から分離された mRNA の (すなわち、化学修飾と断片化) RNA の品質に関して簡便派生鈴値 (RNA 整合性数) よりも具体的です。品質管理はリアルタイム PCR に本研究では制限された独立したグループは、rna や DNA と NCFPE から分離したタンパク質の品質は FFPE 組織8,9,からより示されているので13。
該当する場合、次を提示プロトコル (例えば、リン酸カルシウムのレシピ、固定条件、RNA 品質管理、検証)、事前分析手順の体外診断 (IVD)、CEN の技術仕様の要件最近発売された標準化ヨーロッパ委員会 (CEN) によって (例えば CEN/TS 16827-ISO 15189 標準を示す FFPE 組織からの RNA の隔離のための 1:2015)。
メソッドは、この特定の固定に限定されます。いくつかの研究では、生体分子と非相互リンク、無料のホルマリン固定液を用いて形態のよい保存を提示されているが研究ではなく日常の医療アプリケーションで主に使用されます。理由の 1 つ金本位リン酸カルシウムを置き換える別定着剤による固定は必要です検証研究のさまざまな非十字リンクの定着剤で固定用 FFPE 材料の最適化されたすべてのプロトコルを使用できるように。他の組織の固定方法は、この魚のプロトコルのテストしませんでした。
本稿で説明した簡単なポスト固定ステップ FFPE と NCFPE 組織の両方承認 IVD 試金を使用しての利点があります。
Disclosures
The authors have nothing to disclose.
Acknowledgements
我々 は、彼らの専門知識の医科大学グラーツの病理学研究所の分子病理学研究室のチームに感謝し、サポートします。さらに、アイリス Kufferath と感謝ダニエラ パブスト テクニカル サポート、ベルナデット リーガーと HER2 のケースを処理するためのシルビア Eidenhammer キン Szurian (病理学者)、タマス Regényi (3DHISTEC)。原稿の校正、ペネロペ Kungl に感謝しますこの作業は、研究・技術・開発のキリスト教のドップラー研究基金、オーストリア連邦省、研究と経済と建国によって財政的にサポートされています。
Materials
| SAV LP GmbH, Flintsbach a. I., Germany | www.sav-lp.de | FN-200L-4-1 | Tissue fixative |
| Simport Plastic Ltd., Beloeil, Canada | www.simport.com | M-498 | Safekeeping device providing labelling, fixation and paraffin embedding for tissue samples. |
| Qiagen GmbH, Hilden Germany | www.qiagen.com | 765112 | For collection, fixation, and stabilization of tissue samples: 10 Prefilled Reagent Containers, containing PAXgene Tissue FIX and PAXgene Tissue STABILIZER. |
| ThermoFisher Scientific | www.thermofisher.com | 813150 | Processing of biological specimens from chemical fixation to paraffin infiltration |
| Merck Millipore, Munich, Germany | www.analytics-shop.com/de/hersteller/millipore.html | MC1009834000 | Dehydration of tissue samples |
| VWR Chemicals, Darmstadt, Germany | https://at.vwr.com | 10293EP | Dehydration of tissue samples |
| ACM Herba Chemosan Apotheker AG, Vienna, Austria | www.herba-chemosan.at | 2549662 32 | Paraffin used in a tissue processing device |
| Leica Mikrosysteme Handels GmbH, Vienna, Austria | www.LeicaBiosystems.com | 39602004 | Paraffin embedding medium |
| Sanova Diagnostik, Vienna, Austria | www.sanova.at | 5229 | Paraffin embedding instrument for tissues for histology |
| Histocom Medizintechnik Vertriebs GmbH, Wiener Neudorf, Austria | www.histocom.info | M 910010 | This device is used for especially sophisticated paraffin sectioning techniques in biology and medicine. Only skilled or specially trained personnel must operate the microtome, i.e. clamping the specimen, trimming, sectioning and taking off the sections from the instrument. |
| Dako Denmark A/S, Glostrup, Denmark | www.chem.agilent.com | K802021-2 | Coated glass slides, intended for mounting formalin-fixed, paraffin-embedded tissue sections. |
| Qiagen GmbH, Hilden Germany | www.qiagen.com | 73504 | For purification of total RNA from formalin-fixed, paraffin-embedded tissue sections |
| Qiagen GmbH, Hilden Germany | www.qiagen.com | 765134 | For purification of total RNA from PAXgene-fixed, paraffin-embedded tissue sections |
| ZytoVision GmbH, Bremerhaven, Germany | www.zytovision.com | Z-2015-200 | For the detection of ERBB2 (a.k.a HER2) gene amplification frequently observed in solid malignant neoplasms e.g. breast cancer samples. |
| 3DHISTEC, Budapest, Hungary | www.3dhistech.com | Digital device for scanning tissue slides equipped with a 40x/1.2 NA objective, Quad band filters (DAPI/FITC/TRITC/Cy5) filters and a 5.5Mpx, 16 bit, cooled scientific CMOS (Complementary Metal Oxide Semiconductor) camera. | |
| ThermoFisher Scientific | www.thermofisher.com | 4368814 | The High Capacity cDNA Reverse Transcription Kit contains all components necessary for the quantitative conversion of up to 2 µg of total RNA to single-stranded cDNA in a single 20 µL reaction. |
| ThermoFisher Scientific | www.thermofisher.com | 4367659 | PCR Master Mix containing polymerase, nucleotides and SYBR Green for PCR and quanitification of amplicons. |
| ThermoFisher Scientific, Wilmington, DE | www.thermofisher.com | Ser. Nr. F239 | Spectrophotometer for nucleic acid quantification. |
| QuantStudio 7 Flex Real-time PCR System | www.thermofisher.com | 4485701 | PCR machine, |
| Vysis/Abbott Laboratories. Abbott Park, Illinois, U.S.A | www.molecular.abbott/us/en/products/instrumentation/thermobrite#order | e.g. (ThermoBrite) 07J91-020 | Temperature controlled slide processing system for in-situ denaturation/hybridization procedures. |
References
- Fox, C. H., Johnson, F. B., Whiting, J., Roller, R. P. Formaldehyde fixation. J. Histochem.Cytochem. 33 (8), 845-853 (1985).
- Oosterhuis, J. W., Coebergh, J. W., van Veen, E. B. Tumour banks: well-guarded treasures in the interest of patients. Nat. Rev. Cancer. 3 (1), 73-77 (2003).
- Masuda, N., Ohnishi, T., Kawamoto, S., Monden, M., Okubo, K. Analysis of chemical modification of RNA from formalin-fixed samples and optimization of molecular biology applications for such samples. Nucleic Acids Res. 27 (22), 4436-4443 (1999).
- Metz, B., Kersten, G. F., Hoogerhout, P., Brugghe, H. F., Timmermans, H. A., de Jong, A., et al. Identification of formaldehyde-induced modifications in proteins: reactionswith model peptides. J. Biol. Chem. 279 (8), 6235-6243 (2003).
- Evers, D. L., Fowler, C. B., Cunningham, B. R., Mason, J. T., O’Leary, T. J. The effect of formaldehyde fixation on RNA: optimization of formaldehyde adduct removal. J.Mol. Diagn. 13 (3), 282-288 (2011).
- Groelz, D., Sobin, L., Branton, P., Compton, C., Wyrich, R., Rainen, L. Non-formalin fixative versus formalin-fixed tissue: A comparison of histology and RNA quality. Exp. Mol. Pathol. 94 (1), 188-194 (2013).
- Do, H., Dobrovic, A. Sequence artifacts in DNA from formalin-fixed tissues: causes and strategies for minimization. Clin. Chem. 61, 64-71 (2015).
- Kashofer, K., Viertler, C., Pichler, M., Zatloukal, K. Quality Control of RNA Preservation and Extraction from Paraffin-Embedded Tissue: Implications for RT-PCR and Microarray Analysis. PloS One. 8 (7), e70714 (2013).
- Viertler, C., Groelz, D., Gündisch, S., Kashofer, K., Reischauer, B., Riegman, P. H., et al. A new technology for stabilization of biomolecules in tissues for combined histological and molecular analyses. J. Mol. Diagn. 14 (5), 458-466 (2012).
- Gundisch, S., Slotta-Huspenina, J., Verderio, P., Maura, C., Ciniselli, S. P., Schott, S., et al. Evaluation of colon cancer histomorphology: A comparison between formalin and PAXgene tissue fixation by an international ring trial. Virchows Arch. 465 (5), 509-519 (2014).
- Ergin, B., Meding, S., Langer, R., Kap, M., Viertler, C., Schott, C., et al. Proteomic analysis of PAXgene-fixed tissues. J. Proteome Res. 9 (10), 5188-5196 (2010).
- Kap, M., Smedts, F., Oosterhuis, W., Winther, R., Christensen, N., Reischauer, B., et al. Histological Assessment of PAXgene Tissue Fixation and Stabilization Reagents. PLoS ONE. 6 (11), e27704 (2011).
- Mathieson, W., Marcon, N., Antunes, L., Ashford, D. A., Betsou, F., Frasquilho, S. G., et al. A Critical Evaluation of the PAXgene Tissue Fixation System: Morphology, Immunohistochemistry, Molecular Biology, and Proteomics. Am J Clin Pathol. 146, 25-40 (2016).
- Oberauner-Wappis, L., Loibner, M., Viertler, C., Groelz, D., Wyrich, R., Zatloukal, K. Protocol for HER2 FISH determination on PAXgene-fixed and paraffin-embedded tissue in breast cancer. Int J. Exp. Path. 97 (2), 202-206 (2016).
- Pauletti, G., Godolphin, W., Press, M. F., Slamon, D. J. Detection and quantitation ofHER-2/neu gene amplification in human breast cancer archival material using fluorescence in situ hybridization. Oncogene. 13 (1), 63-72 (1996).
- Owens, M. A., Horten, B. C., Da Silva, M. M. HER2 amplification ratios by fluorescence in situ hybridization and correlation with immunohistochemistry in a cohort of 6556 breast cancer tissues. Clin.Breast Cancer. 5 (1), 63-69 (2004).
- Wolff, A. C., Hammond, M. E., Schwartz, J. N., Hagerty, K. L., Allred, D. C., Cote, R. J., et al. American Society of Clinical Oncology/College of American Pathologists guideline recommendations for human epidermal growth factor receptor 2 testing in breast cancer. Arch Pathol Lab Med. 131 (1), 18-43 (2007).
- Press, M. F., Bernstein, L., Thomas, P. A., Meisner, L. F., Zhou, J. Y., Ma, Y., et al. HER-2/neu gene amplification characterized by fluorescence in situ hybridization: poor prognosis in node-negative breast carcinomas. J. Clin. Oncol. 15 (8), 2894-2904 (1997).
- Yamauchi, H., Stearns, V., Hayes, D. F. When is a tumor marker ready for prime time? A case study of c-erbB-2 as a predictive factor in breast cancer. J. Clin. Oncol. 19 (8), 2334-2356 (2001).
- Paulik, R., Micsik, T., Kiszler, G., Kaszál, P., Székely, J., Paulik, N., Várhalmi, E., Prémusz, V., Krenács, T., Molnár, B. An optimized image analysis algorithm for detecting nuclear signals in digital whole slides for histopathology. Cytometry A. , (2017).
- Applied Biosystems. . QuantStudio 6 and 7 Flex Real-Time PCR System Software. , (2013).
- NCCLS. . Quality Assurance for Immunocytochemistry. , (1999).
- Baker, J. R. . Principles of Biological Microtechnique. , (1958).
- Hewitt, S. M., Lewis, F., Cao, Y., Conrad, R. C., Cronin, M., Danenberg, K. D., et al. Tissue handling and specimen preparation in surgical pathology: issues concerning the recovery of nucleic acids from formalin-fixed, paraffin-embedded tissue. Arch Pathol. Lab Med. 132 (12), 1929-1935 (2008).

