Summary
不斉濃縮 bispiro [γ-ブチロラクトン-pyrrolidin-4、4'-ピラゾロン] スケルトン非対称的、単純な有機触媒 1, 3-双極子付加環化反応により合成されます。
Abstract
Bispirocyclic 足場は、多彩で魅力的な生物活性を示す多くの天然物の重要な構造のサブユニットの一つです。最近では、様々 な不斉濃縮 bispiro [γ-ブチロラクトン-pyrrolidin-4、4'-ピラゾロン] スケルトンへの安易なアクセスを提供する効率的な有機触媒戦略を開発しました。本稿では、薬のような bispirocyclic、organocatyltic 1, 3-双極子環化付加反応による 2 つのスピロ炭素センター化合物の不斉合成のための詳しいプロトコルを示しています。環化反応シントン α イミノ γ-ラクトンと alkylidene ピラゾロンの準備が最初に、squaramide の塩基触媒の存在下で環化付加反応を受けている高収率で目的の bispirocycles を支払うことと優れた立体選択性。キラル高速液体クロマトグラフィー (HPLC) は製品の光学純度を決定するために実施し、プロトン核磁気共鳴 (1H NMR) による d. r. 値を検討します。X 線結晶構造解析によると、製品の絶対的な構成が割り当てられます。この合成戦略に bispirocyclic の足場高収率と良好とエナンチオ選択性の多様性を準備できます。
Introduction
キラル スピロ化合物を天然物、キラル配位子で流行している発見し、有機金属錯体は、その構造の複雑さと生物活性1,2のための魅力的な合成ターゲットとして浮上しています。 3。具体的には、bispirocyclic 足場、特集 2 つの剛体の spirocenters と 3 つのリングによって、重要な生物学的活動4、5と多くの天然物の構造のサブユニットです。その結果、立体、光学的に純粋な bispirocyclic 骨格を持つ化合物の建設は、最後の数十年にわたって大きな注目を集めています。スピロ化合物の数が多いとその誘導体が有機金属アプローチを通じて正常に合成されて、有機触媒に近づく、たとえば、非対称及び 1, 3-双極子及び、ディールス ・ アルダーなど反応6,7,8。しかし、これらの分子は、bispirocyclic 構造体が報告少ないインドール ベース bispirocycles の建設に限定してほとんど monospirocyclic 構造です。
多くの bispirocyclic の構造的に多様な化合物を得るために環化付加シントン スピロ センターの非対称の構造のための汎用性は、探検9,10,11をされています。とくに二官能性 squaramide 触媒、アゾメチン イリド12,13,14, α-イミノ γ-ラクトンなどなど alkylidene ピラゾロン15,16 dipolarophiles ,17, 複数 stereocenters、それらの完璧な環化反応シントン (図 1) を作ると bispirocyclic 骨格を構築する単純な 1, 3-双極子付加環化を受けることができます。後、触媒と反応溶媒、この付加環化反応プロセスの構造の最適化は、高収率と優れたエナンチオ - ジアステレオと目的の製品を効率的に affords。また、この反応は多様な機能グループ18環シントンの広い範囲で比較的高い構造トレランスを展示します。この新しいメソッドは、化合物構造多様性指向の応用でライトが光るシンプルな有機触媒反応を介して 2 つの第四紀 spirocenters 薬のような高機能の様々 なへの効率的なアクセスを提供しますこの興味をそそられる化合物群の合成。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
注意: 使用前に関連するすべての材料安全データ用紙 (MSDS) を参照してください。化学薬品および溶媒の使用は、試薬グレードのされ、さらに精製することがなく使用されました。空気や水分に敏感な試薬や中間体を含むすべての反応はアルゴン雰囲気下で行われました。
1. α-Arylidiene Pyrazolinone 種の準備
-
準備ピラゾロン
- 250 mL の丸底フラスコにメスシリンダー常温から氷酢酸 40 mL を追加します。ヒドラジン (1 相当、1.58 mol/L) とアセト酢酸メチル (1 相当、1.58 mol/L) を追加してソリューションをかき混ぜます。還流凝縮器、フラスコを装備します。
メモ: この濃度は低濃度反応速度を遅くするために使用されます。 - 3 h の攪拌しながら油浴中で 120 ° C に反応フラスコを加熱します。周囲温度に反応フラスコを冷却した後バーに攪拌バー レトリーバー電磁攪拌を削除します。ロータリーエバポレーターを使用して 60 の ° C で反応混合物を集中します。負圧のため反応混合物をこぼすことを避けます。
- 前記反応フラスコに 20 mL の脱イオン水を追加し、, 目標到達プロセスにソリューションを転送します。抽出水層 3 酢酸エチル (30 mL) で x。漏斗で有機層を組み合わせるし、洗って塩水 (50 mL) で 2 倍。
- 1 h の無水硫酸ナトリウムをした有機層を乾燥、その後、重力濾過により硫酸ナトリウムを削除します。
- ロータリーエバポレーター 35 ° c. の減圧下での溶媒を除去します。
- すべての溶媒を除去した後に、セクション 4 を実行するときにピラゾロン種を適用されます。
- 250 mL の丸底フラスコにメスシリンダー常温から氷酢酸 40 mL を追加します。ヒドラジン (1 相当、1.58 mol/L) とアセト酢酸メチル (1 相当、1.58 mol/L) を追加してソリューションをかき混ぜます。還流凝縮器、フラスコを装備します。
-
準備Α-Arylidiene Pyrazolinones
- N2雰囲気下でオーブン乾燥 100 mL 丸底フラスコにピラゾロン (1 相当、0.49 mol/L)、ベンズアルデヒド (1 相当、0.49 mol/L)、酸化マグネシウム (等価 0.6 0.5 g)、電磁攪拌棒を追加します。
- 気密のシリンジを使用して反応フラスコに無水アセトニ トリル (40 mL) を追加し、還流凝縮器とフラスコを装備します。12 h の攪拌しながら油浴中で 120 ° C に反応フラスコを加熱します。
- 石油エーテル: 酢酸エチルを用いた薄層クロマトグラフィー (TLC) による反応の進行状況を監視 (2:1 [v/v]、保持係数 Rf = 0.86) 溶離液として。
- ピラゾロンの完全な消費の後室温まで反応フラスコを冷却します。セライトのプラグインを介して酸化マグネシウムをフィルター処理します。
- 減圧下で、35 ° C で回転蒸発器を使用して余分なアセトニ トリルを削除します。粗製品を提供する石油エーテル: 酢酸エチル (8:1 [v/v] に 10:1) で溶出シリカゲル カラムクロマトグラフィーによる残留物を浄化します。
- 100 mL の電磁攪拌棒エルレンマイヤー フラスコに粗製品を追加し、最小量の 95% エタノールを加えます。ホット プレートにフラスコを置き、全体の固体がちょうど解散するまで穏やかな沸騰にそれをもたらします。ホット プレートからフラスコを取り、任意の攪拌せずゆっくりと冷ます。
注: 混合物を室温に冷却すると、対応する α-arylidiene の pyrazolinone が純粋な結晶として形成されます。
2. α-イミノ γ-ラクトン化学種の合成
- N2雰囲気下でオーブン乾燥 100 mL 丸底フラスコに α-アミノ酸-γ-ブチロラクトン臭化水素酸塩 (1 相当、0.41 mol/L)、硫酸マグネシウム (1 相当、0.41 mol/L)、トリエチルアミン (1 相当、0.41 mol/L)、電磁攪拌棒を追加します。
- 気密の注射器を使用して、反応フラスコに無水ジクロロ メタンの 36 mL を追加します。反応混合物をかき混ぜる 1 h. 追加対応するチオフェン-2-カルバルデヒドの室温 (1.1 相当、0.45 mol/L) のソリューションに、別の 12 時間かき混ぜます。
- TLC、ラクトン種の完全な消費が発生するまでは、溶離液として石油エーテル: 酢酸エチル (4:1 [v/v]) を使用して、その後、反応混合物は、30−50 μ m の孔径のフィルター ペーパーを使用してオフ フィルターによって反応の進行状況を監視します。
- 得られた混合物を 5 mL の脱イオン水を追加し、水相から有機層を分離します。抽出水相 2 ジクロロ メタン (30 mL) で x。漏斗で有機層を組み合わせるし、洗って塩水 (50 mL) で 2 倍。
- 1 h の無水硫酸ナトリウムをした有機層を乾燥、重力濾過により硫酸ナトリウムを取り外します。ロータリーエバポレーター 35 ° c. の減圧下での溶媒を除去します。
- すべての溶媒を除去した後に、セクション 4 を実行するとき α イミノ γ-ラクトン種を適用します。
3. 官能 squaramide 触媒 C519の合成
注: 有機分子触媒 5 C の合成は、図 2を参照してください。
-
3-((3,5-bis(trifluoromethyl)phenyl)amino)-4-methoxycyclobut-3-ene-1,2-dione (化合物 1) の準備
- N2雰囲気下でオーブン乾燥 100 mL 丸底フラスコに、電磁攪拌棒、20 mL のメタノール、3, 5-ビス (トリフルオロメチル) アニリン (1.1 相当、0.69 mol/L) 3,4-dimethoxycyclobut-3-ene-1,2-dione (1 相当、0.63 mol/L) を追加します。
- 48 時間室温で混合物をかき混ぜます。黄色の沈殿物の形成、反応が行われているを示します。
- フィルター目標到達プロセス反応液はメタノール (15 mL) 3 x ろ紙及び固体製品の洗浄を装着しました。真空中で一晩黄色の固体として最終製品を買う余裕を黄色の固体を乾燥します。
-
C5 の触媒の合成
- 3-((3,5-bis(trifluoromethyl)phenyl)amino)-4-methoxycyclobut-3-ene-1,2-dione (複合 1; 1 相当、0.2 mol/L) と (S)-(6-methoxyquinolin-4-yl)((1S,2R,4S,5R)-5-vinylquinuclidin-2-yl)methanamine (複合 2; 1 相当、0.2 mol/L) を追加します。・ N2雰囲気下で 25 mL の丸底フラスコに電磁攪拌棒。
- 気密のシリンジを用いた無水ジクロロ メタン (5 mL) を追加します。48 時間室温で混合物をかき混ぜます。
- Dichloromethane:methanol を使用して、TLC による反応の進行状況を監視 (10:1 [v/v]、Rf = 0.49) 溶離液として。反応が完了したら、集中反応混合物は、40 ° C でロータリーエバポレーターを使用して
- 目的製品を提供する dichloromethane:methanol (20:1 [v/v]) で溶出性シリカゲルのカラム ・ クロマトグラフィによる残留物を浄化します。
4 bispirocyclic 化合物の不斉合成
- 電磁攪拌棒を含む 50 mL 丸底反応フラスコを乾燥させます。オーブンからフラスコを削除し、不活性ガス使用する前にそれを吹くことによって部屋の温度にそれをクールします。
- N2雰囲気下で 50 mL の丸底フラスコに pyrazolinone α arylidiene (1 モル、1 相当、0.1 mol/L) と α-イミノ γ-ラクトン (1.2 モル、1.2 に相当、0.12 mol/L) を追加します。
- 気密の注射器を使用して、反応フラスコに無水のエチル エーテル (10 mL) を追加します。次に、ソリューションに対応する触媒 (相当する 0.1、0.01 mol/L) を追加し、40 ° C で反応混合物をかき混ぜる
- Tlc 法、石油エーテル: エチル酢酸による反応の進行状況を監視 (4:1 [v/v]、Rf = 0.51) 溶離液として。
注: 開始の材料や製品のスポットが手持ちの 254 nm の紫外線ランプを使用して可視化。 - 反応が完了した後、反応混合物は、40 ° C でロータリーエバポレーターを使用してを集中します。
- 石油エーテル: 酢酸エチル (4:1 [v/v]) 最終製品を提供すると溶出性シリカゲルのカラム ・ クロマトグラフィによる残留物を浄化します。
- 1H、 13C NMR スペクトル、400 MHz 核磁気共鳴の分光計を使用して最終製品を特徴付けます。光学分割用カラムを使用して、製品の ee の値を決定します。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
様々 な水素結合ドナー二官能性有機分子触媒は、ジクロロ メタン (DCM) 25 ° c (表 1) 触媒の存在下で検討しました。有機分子触媒の代表的な合成プロセスを図 1に示します。異なる触媒 (表 1エントリ 1-6) のスクリーニング結果 C5 優れた立体選択性を持つ (94 %ee > 20:1 d. r.、エントリ 5) と最高収量 (85% の利回り)。溶剤 (表 17-11 のエントリ) のさらなる最適化を提案を Et2O はこの合成過程で好まれました。
大幅に反応の一般性を確認する別の官能基を持つ 2 つの環化反応のシントンの置換基のさまざまなテストされた正常に最適化されたモデルの反応条件、目的の結果を使用優れた収率および立体選択性に良い bispirocycles。Pyrazolinone 1 aの範囲には、デシル、 tert- ブチルと 3 でベンジル基 - チエニル グループ、エチルなどの異なる置換基を有する基板、ナフチル、アリールの広い範囲で α-arylidiene のフェニル基の置換が含まれています。位置、および置換アリール環 1 位置の電子特性が異なる。その上、基板を探索するイミノ ラクトン2 a、繰返しイミノ エステル部位の範囲だったような利回りとかなり立体選択性 bispirocycles を提供する 5-メチルチオフェニルやフェニル 2-ナフチル グループに置き換えられます。
Bispirocyclic 製品の構造は、 1H、 13C の NMR 分光法によって確認しました。光学純度と立体物の立体選択性を特徴付ける、ee 値を求めたキラル HPLC を用いて、d. r. 値が 400 MHz 1H NMR によって決定されます。化合物3 eの reprehensive の高速液体クロマトグラフィー特性評価結果は、図 3に与えられています。構造相対性理論を探索するには、x 線結晶構造解析は3e(5S6R7R13R) として明らかに製品3eの絶対配置を分析に使用されました。3eの結晶構造を図 4に示します。CCDC 1590396 3e、得ることができるの結晶学的データが含まれているケンブリッジの結晶学データ センター (www.ccdc.cam.ac.uk/data_request/cif) から無料で。
たとえば、bispirocyclic 製品 (3 e) の特性データが次のように: Rf = 0.51 (4:1 [v/v]、石油エーテル/酢酸エチル);1H NMR (400 MHz、CDCl3) δ 7.55 (d、 J = 7.2 Hz、2 H)、7.35 7.31 (m, 2 H) 6.90-6.88 (m, 1 H)、5.03 6.98 6.93 (m, 3 H)、7.19-7.15 (m, 2 H) 7.26-7.22 (m, 2 H) (d、 J = 11.6 Hz、1 H)、4.57 (s, 1 H) 4.46-4.40 (m, 1 H) 4.09 (td、 J = 8.8, 2.0 Hz、1 H)、3.80 (d、 J = 11.6 Hz、1 H)、2.67-2.61 (m, 1 H)、2.35 2.27 (m、4 H);13C NMR (100 MHz、CDCl3) δ 178.8、171.9、163.9, 161.4、158.5、137.1、136.0, 131.3、1,312億、128.8、127.0、125.8、125.4、] を 125.0、119.7、116.3、116.1、70.8、67.4、66.0、64.1、57.5、34.6、13.6;19F (376 MHz、CDCl3) NMR δ 112.8。Ee 価値は HPLC 分析により, ヘキサン/2-プロパノール 80/20、流量によって決定されました = 1.0 mL/min、254 nm、tr = 8.63 分 (主要な);人事管理システム (ESI) C26H23N3O3SF+ [M + H]+ 476.1439、Calcd は、476.1446 を発見しました。
| エントリ | 触媒 | 溶剤 | 収量[、] (%) | d. r.[c] | ee[d] (%) |
| 1 | C1 | DCM | 81 | > 20:1 | 94 |
| 2 | C2 | DCM | 82 | 12:1 | 90 |
| 3 | C3 | DCM | 30 | 9:1 | 0 |
| 4 | C4 | DCM | 78 | > 20:1 | 71 |
| 5 | C5 | DCM | 85 | > 20:1 | 94 |
| 6 | C6 | DCM | 70 | 12:1 | 93 |
| 7 | C5 | トルエン | 79 | > 20:1 | 95 |
| 8 | C5 | THF | 73 | 15:1 | 89 |
| 9 | C5 | CHCl3 | 71 | > 20:1 | 93 |
| 10 | C5 | DCE | 81 | 18:1 | 91 |
| 11 | C5 | Et2O | 88 (83[b]) | > 20:1 | 98 |
|
[利回り定められた1H NMR 分析内部標準として 4 iodoanisole を使用して粗製品の。 [b]単離収率。 [c]の比率は、 1H NMR によって決定されます。 [d]キラル高速液体クロマトグラフィーにより決定。 |
|||||
表 1: 反応条件の最適化。テーブルは、陳ら18から変更されています。

図 1: モデル 1 a と 2 a の反応。二官能性有機分子触媒 (C1-C6) の構造が表示されます。この図では、 1 a (0.10 モル)、 2 a (0.12 ミリ モル) 8 72 h 常温溶剤 (1 mL) の触媒 (10 mol %) と実行の反応を示しています。実験手順の詳細については、「プロトコル」を参照してください。この図は、陳ら18から変更されています。この図の拡大版を表示するのにはここをクリックしてください。
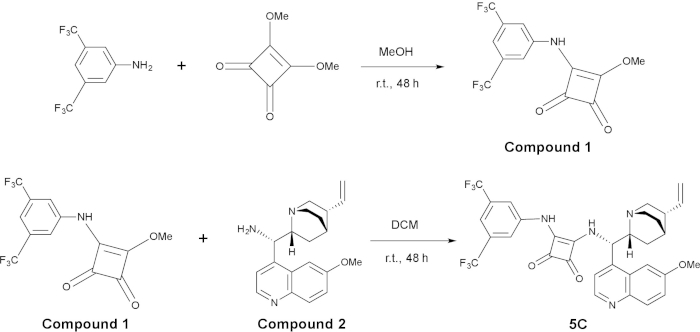
図 2: 合成における触媒反応の 5 C上部のパネルには1化合物の合成と下部パネルは、化合物1と化合物2から5 Cの合成。この図の拡大版を表示するのにはここをクリックしてください。
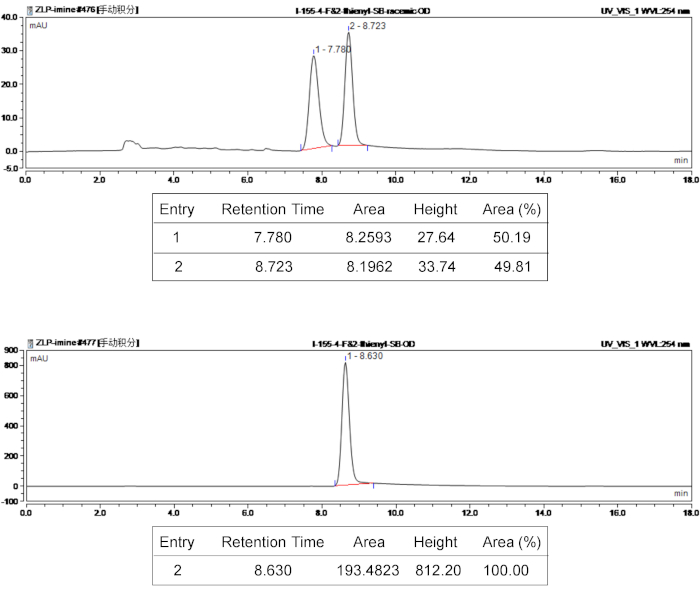
図 3: ラセミ体とキラル製品 3 e の高速液体クロマトグラフィー スペクトル。上部のパネルにはラセミ体製品3 eの高速液体クロマトグラフィー スペクトルと下部パネルはキラル3 eの高速液体クロマトグラフィーのスペクトル。この図の拡大版を表示するのにはここをクリックしてください。

図 4: 3 e の単結晶構造。左の構造は、 3 eの結晶構造と右の構造が正しく指定された各原子の立体化学と3 e 。この図の拡大版を表示するのにはここをクリックしてください。
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Bispiro [γ-ブチロラクトン-pyrrolidin-4、4'-ピラゾロン] スケルトンの成功の準備はいくつかの要因に依存しています。
このワンステップ不斉付加環化反応プロセスの重要なステップは、α arylidiene pyrazolinone 1 aおよび塩基 squaramide 触媒による環状イミノ エステル2 aの synergistical の活性化です。それは 2 つの反応基質と触媒水素結合ドナーとして間に複数分子間水素結合の形成によって達成されます。したがって、大きな立体障害、C5、すべて、水素結合ドナー二官能性有機分子触媒、上映から出展した最高の立体選択性。注目されるプロトコルは、モデルの反応で 10 mol % の触媒を使用します。その上、基質と触媒の両方の高溶解性の要件は、不可欠です。結果、Et の使用として最適な溶媒として2O だけでなく確実に、基質と触媒に完全に溶解が室温で高収率と立体選択性も滑らかな環化付加反応を受けます。特に、反応系における水貧しい立体選択性に 。合成に成功を確保するためには、反応を開始する前にすべての試薬と溶媒の乾燥を確認する重要です。
環化付加反応は、さまざまな置換 α-arylidiene pyrazolinone と互換性が。具体的には、α arylidiene の異なるアリール基の置換基は忍容性します。電子撤回アリール グループ、その増加の有する 1, 3-双極子環化付加反応の中には、利回りおよび立体選択性の面で優先されます。また、3 ポジションなどの基材にエチル、デシル、 tert置き換え-ブチル、およびベンジル グループと 1 位修飾別電子芳香族リングによる、非常に許容されます。また、ナフチル グループや thiophenyl、フェニル イミノ ラクトンの繰返しイミノ エステル基の置換基は反応と互換性あります。成功した反応を確保するために、イミノ ラクトン (1.2 相当) の少し過剰が必要です注目すべきです。ほとんどの場合、基質の濃度が 0.1 0.12 で保持される溶媒 1 mL で mol/L スケール。基板と触媒の種類に応じてワンステップ環化付加反応は室温で 8 72 h をかかることがあります。
イミノ ラクトン2 R4置換基が thiolphenyl、5-メチルチオフェニルまたは 2-ナフチル グループ、この付加環化反応は立体選択性の高レベルを提供されることは注目に値するです。ただし、他のアルキル基と複素環置換基 R4置換基を交換したときは、低立体選択性または低反応収量は達成されました。
要約すると、提案するプロトコルにより直接非対称 bispiro [γ-ブチロラクトン-pyrrolidin-4、4'-ピラゾロン] 優れた収率との高いレベルでの効率的なワンステップ有機触媒 1, 3-双極子付加環化反応を利用した構立体選択性。また、この新方法論は 2 つのシントンが汎用性の高い官能基を軸受と互換性のある、bispirocyclic の足場で多様な治療薬の合成に役に立つはず。
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
著者が明らかに何もありません。
Acknowledgments
著者は、中国の国家自然科学基金 (X.C. に 21708051 号) から財政支援を申し上げます。
Materials
| Name | Company | Catalog Number | Comments |
| Acetonitrile, anhydrous, 99.9% | Innochem (China) | A0080 | |
| α-amino-γ-butyrolactone hydrobromide, 98% | Alfa Aesar | B23148 | |
| 3,5-bis(trifluoromethyl)aniline, 98+% | Adamas | 48611B | |
| Dichloromethane, 99.5% | Greagent | G81014H | |
| 3,4-dimethoxycyclobut-3-ene-1,2-dione, 98+% | Leyan (China) | 1062550 | |
| Ethanol, 99.5% | Greagent | G73537B | |
| Ethyl acetate, 99.5% | Greagent | G23272L | |
| Ethyl ether,anhydrous,99.5% | Greagent | G69159B | |
| Ethyl 3-oxobutanoate, 98% | TCI | A0649 | |
| 4-fluorobenzaldehyde, 98% | Innochem (China) | A24295 | |
| Glacial acetic acid, 99.5% | Greagent | G73562B | |
| Magnesium oxide, 99+% | Alfa Aesar | 44733 | |
| Magnesium sulfate, 98% | Greagent | G80872C | |
| Methanol, 99.5% | Greagent | G75851A | |
| Petroleum ether | Greagent | G84208D | |
| Phenylhydrazine, 98% | Innochem (China) | A57671 | |
| (S)-(6-methoxyquinolin-4-yl)((1S,2R,4S,5R)-5-vinylquinuclidin-2-yl)methanamine | DAICEL Group | 111240 | |
| Sodium sulfate,anhydrous,99% | Greagent | G82667A | |
| Thiophene-2-carbaldehyde, 98% | J & K scientific (China) | 124605 | |
| Triethylamine, 99% | J & k scientific (China) | 432915 |
References
- Rios, R. Enantioselective methodologies for the synthesis of spiro compounds. Chemical Society Reviews. 41 (3), 1060-1074 (2012).
- Khan, R. K., et al. Synthesis, isolation, characterization, and reactivity of high-energy stereogenic-at-Ru carbenes: stereochemical inversion through olefin metathesis and other pathways. Journal of the American Chemical Society. 134 (30), 12438-12441 (2012).
- Wang, X., Han, Z., Wang, Z., Ding, K. Catalytic asymmetric synthesis of aromatic spiroketals by spinphox/iridium(I)-catalyzed hydrogenation and spiroketalization of alpha,alpha'-bis(2-hydroxyarylidene) ketones. Angewandte Chemie International Edition. 51 (4), 936-940 (2012).
- Kim, N., Sohn, M. J., Koshino, H., Kim, E. H., Kim, W. G. Verrulactone C with an unprecedented dispiro skeleton, a new inhibitor of Staphylococcus aureus enoyl-ACP reductase, from Penicillium verruculosum F375. Bioorganic & Medicinal Chemistry Letters. 24 (1), 83-86 (2014).
- Mulholland, D. A., Schwikkard, S. L., Crouch, N. R. The chemistry and biological activity of the Hyacinthaceae. Natural Product Reports. 30 (9), 1165-1210 (2013).
- Tan, B., Hernandez-Torres, G., Barbas, C. F. Highly efficient hydrogen-bonding catalysis of the Diels-Alder reaction of 3-vinylindoles and methyleneindolinones provides carbazolespirooxindole skeletons. Journal of the American Chemical Society. 133 (32), 12354-12357 (2011).
- Cayuelas, A., et al. Enantioselective Synthesis of Polysubstituted Spiro-nitroprolinates Mediated by a (R,R)-Me-DuPhos.AgF-Catalyzed 1,3-Dipolar Cycloaddition. Organic Letters. 18 (12), 2926-2929 (2016).
- Lacharity, J. J., et al. Total Synthesis of Unsymmetrically Oxidized Nuphar Thioalkaloids via Copper-Catalyzed Thiolane Assembly. Journal of the American Chemical Society. 139 (38), 13272-13275 (2017).
- Liu, K., Teng, H. L., Yao, L., Tao, H. Y., Wang, C. J. Silver-catalyzed enantioselective desymmetrization: facile access to spirolactone-pyrrolidines containing a spiro quaternary stereogenic center. Organic Letters. 15 (9), 2250-2253 (2013).
- Zhu, G., et al. Asymmetric [3 + 2] Cycloaddition of 3-Amino Oxindole-Based Azomethine Ylides and alpha,beta-Enones with Divergent Diastereocontrol on the Spiro[pyrrolidine-oxindoles]. Organic Letters. 19 (7), 1862-1865 (2017).
- Sun, W., et al. Organocatalytic diastereo- and enantioselective 1,3-dipolar cycloaddition of azlactones and methyleneindolinones. Angewandte Chemie International Edition. 52 (33), 8633-8637 (2013).
- Grigg, R., Kilner, C., Sarker, M. A. B., Orgaz de la Cierva, C., Dondas, H. A. X=Y–ZH compounds as potential 1,3-dipoles. Part 64: Synthesis of highly substituted conformationally restricted and spiro nitropyrrolidines via Ag(I) catalysed azomethine ylide cycloadditions. Tetrahedron. 64 (37), 8974-8991 (2008).
- Liu, T. L., He, Z. L., Tao, H. Y., Wang, C. J. Stereoselective construction of spiro(butyrolactonepyrrolidines) by highly efficient copper(I)/TF-BiphamPhos-catalyzed asymmetric 1,3-dipolar cycloaddition. Chemistry. 18 (26), 8042-8046 (2012).
- Wang, L., Shi, X. M., Dong, W. P., Zhu, L. P., Wang, R. Efficient construction of highly functionalized spiro[gamma-butyrolactone-pyrrolidin-3,3'-oxindole] tricyclic skeletons via an organocatalytic 1,3-dipolar cycloaddition. Chemical Communications. 49 (33), 3458-3460 (2013).
- Yetra, S. R., Mondal, S., Mukherjee, S., Gonnade, R. G., Biju, A. T. Enantioselective Synthesis of Spirocyclohexadienones by NHC-Catalyzed Formal [3+3] Annulation Reaction of Enals. Angewandte Chemie International Edition. 55 (1), 268-272 (2016).
- Liu, J. Y., Zhao, J., Zhang, J. L., Xu, P. F. Quaternary Carbon Center Forming Formal [3 + 3] Cycloaddition Reaction via Bifunctional Catalysis: Asymmetric Synthesis of Spirocyclohexene Pyrazolones. Organic Letters. 19 (7), 1846-1849 (2017).
- Mondal, S., Mukherjee, S., Yetra, S. R., Gonnade, R. G., Biju, A. T. Organocatalytic Enantioselective Vinylogous Michael-Aldol Cascade for the Synthesis of Spirocyclic Compounds. Organic Letters. 19 (16), 4367-4370 (2017).
- Chen, N., et al. Asymmetric Synthesis of Bispiro[γ-butyrolactone-pyrrolidin-4,4'-pyrazolone] Scaffolds Containing Two Quaternary Spirocenters via an Organocatalytic 1,3-Dipolar Cycloaddition. European Journal of Organic Chemistry. 2018 (23), 2939-2943 (2018).
- Yang, W., Du, D. M. Highly enantioselective Michael addition of nitroalkanes to chalcones using chiral squaramides as hydrogen bonding organocatalysts. Organic Letters. 12 (23), 5450-5453 (2010).



