Summary
يتم توليف هياكل عظمية بيسبيرو انانتيوميريكالي المخصب [γ-بيوتيرولاكتون-بيروليدين-4, 4 '-بيرازولوني] دون تناسق من خلال رد فعل سيكلواديشن 1، 3-حلقية أورجانوكاتاليتيك بسيطة.
Abstract
بيسبيروسيكليك السقالات هي واحدة من الوحدات الفرعية الهيكلية الهامة في العديد من المنتجات الطبيعية التي يحمل أنشطة بيولوجية متنوعة وجذابة. في الآونة الأخيرة، قمنا بتطوير استراتيجية فعالة أورجانوكاتاليتيك، الذي يوفر سهلة الوصول إلى مجموعة متنوعة من الهياكل العظمية المخصب انانتيوميريكالي بيسبيرو [γ-بيوتيرولاكتون-بيروليدين-4, 4 '-بيرازولوني]. في هذه الورقة، ونظهر بروتوكول مفصل للتوليف غير المتناظر لمركبات بيسبيروسيكليك مثل المخدرات مع اثنين من مراكز الكربون سبيروسيكليك عن طريق فعل 1، 3-حلقية سيكلواديشن أورجانوكاتيلتيك. سبيروسيكليزيشن سينثونس α-imino γ-اكتونات وبيرازولونيس الكيلدين على استعداد أولاً، ثم الذي يتعرض لفعل سيكلواديشن حضور أورجانوكاتاليست سكواراميدي بيفونكشونال لتحمل بيسبيروسيكليس المرجوة في الغلات العالية و ستيريوسيليكتيفيتيس ممتازة. مراوان كروماتوغرافيا سائلة عالية الأداء ([هبلك]) هو إجراء لتحديد نقاء الأجزاء من المنتجات، ويتم فحص قيمة د. بواسطة بروتون الرنين المغناطيسي النووي (الرنين المغناطيسي النووي ح من1). يتم تعيين التكوين المطلق المنتج وفقا لتحليل الأشعة سينية بلورية. هذه الاستراتيجية الاصطناعية يسمح للعلماء لإعداد مجموعة متنوعة من بيسبيروسيكليك السقالات في غلة عالية وممتازة دياستيريو--وانانتيوسيليكتيفيتيس.
Introduction
مركبات سبيروسيكليك مراوان وجدت انتشارا في المنتجات الطبيعية، يغاندس مراوان وظهرت مجمعات الفلزية كأهداف الاصطناعية جذابة نظراً للتعقيد الهيكلي والنشاط البيولوجي1،2، 3. على وجه التحديد، السقالات بيسبيروسيكليك، الموصى بها من قبل عصابات الثلاثة مع اثنين من سبيروسينتيرس جامدة، هي الوحدات الفرعية الهيكلية في العديد من المنتجات الطبيعية ذات أهمية الأنشطة البيولوجية4،5. ونتيجة لذلك، بناء المركبات مع ستيريوكونتروليد، بيسبيروسيكليك بصريا نقية الهياكل العظمية الانتباه كبيرة خلال العقود القليلة الماضية. عدد كبير من المركبات سبيروسيكليك ومشتقاتها وقد تم تصنيعه بنجاح من خلال النهج الفلزية والنهج أورجانوكاتاليتيك، على سبيل المثال، سيكلواديشنز غير المتماثلة مثل سيكلواديشنز 1، 3-حلقية وديلز-الدر ردود الفعل6،،من78. بيد أن هذه الجزيئات معظمها هياكل مونوسبيروسيكليك، بينما الهياكل بيسبيروسيكليك أقل عن وتقتصر على بناء أساس اندول بيسبيروسيكليس.
بغية الحصول على أكثر المركبات بيسبيروسيكليك المختلفة هيكلياً، كانت براعة سينثونس سيكلواديشن لبناء مراكز سبيروسيكليك غير المتناظر استكشفت9،،من1011. خاصة مع سكواراميدي بيفونكشونال أورجانوكاتاليستس، أزوميثيني يليدي12،،من1314، مثل α-imino γ-اكتونات، وديبولاروفيليس، مثل الكيلدين بيرازولونيس15،16 ،17، وهم قادرون على الخضوع سيكلواديشن 1، 3-حلقية بسيطة لبناء هياكل عظمية بيسبيروسيكليك مع ستيريوسينتيرس متعددة، مما يجعلهم سينثونس سبيروسيكليزيشن الكمال (الشكل 1). بعد يتيح الاستفادة المثلى هيكل أورجانوكاتاليست ورد فعل المذيبات، وهذه العملية سيكلواديشن كفاءة المنتج المطلوب مع غلة عالية وممتازة انانتيو--ودياستيريوسيليكتيفيتي. وعلاوة على ذلك، رد الفعل هذا المعارض تسامح هيكلية مرتفعة نسبيا على نطاق واسع من سينثونس سيكلواديشن مع مجموعات وظيفية متنوعة18. يوفر هذا الأسلوب الجديد لوصول فعال إلى مجموعة متنوعة من المركبات مثل المخدرات عالية فونكتيوناليزيد مع سبيروسينتيرس رباعي اثنين عن طريق سيكلواديشن أورجانوكاتاليتيك بسيطة، تسطع الأضواء على تطبيقه في الهيكلية الموجهة نحو التنوع توليف لهذه الفئة مثيرة للاهتمام من المركبات.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
تحذير: الرجاء مراجعة صحائف بيانات السلامة المادية ذات الصلة (MSDS) قبل الاستخدام. المواد الكيميائية والمذيبات المستخدمة في الصف الكاشف واستخدمت دون مزيد من تنقية. وأجريت جميع ردود الفعل التي تنطوي على الهواء أو كواشف حساسة للرطوبة أو وسيطة تحت جو أرجون.
1-إعداد الأنواع بيرازولينوني α-أريليديني
-
إعداد بيرازولونيس
- إضافة 40 مل حمض الخليك الجليدية قارورة مستديرة قاع 250 مل من اسطوانة في درجة حرارة الغرفة. إثارة الحل أثناء إضافة الهيدرازين (ما يعادل 1، 1.58 mol/L) وأسيتواسيتاتي الميثيل (ما يعادل 1، 1.58 mol/L). تجهيز قارورة مع مكثف ارتداد.
ملاحظة: يتم استخدام هذا التركيز نظراً لتركيز أقل يؤدي إلى رد فعل معدل أبطأ. - الحرارة قارورة رد فعل إلى 120 درجة مئوية في حمام زيت مع التحريك ح 3. بعد التبريد قارورة رد فعل وصولاً إلى درجة الحرارة المحيطة، إزالة إثارة المغناطيسية بار، استخدام المسترد شريط إثارة. تركز رد فعل المخلوط باستخدام مبخر دوراني في 60 درجة مئوية. تجنب إراقة المخلوط رد فعل بسبب الضغط السلبي.
- إضافة 20 مل مياه إلى قارورة رد فعل ونقل الحل إلى قمع سيباراتوري. استخراج الطبقة المائية 3 x مع وخلات الإيثيل (30 مل). الجمع بين الطبقات العضوية في القمع سيباراتوري وغسلها x 2 مع محلول ملحي (50 مل).
- الجاف للطبقات العضوية مجتمعة فوق كبريتات الصوديوم اللامائية ح 1، وثم إزالة كبريتات الصوديوم عن طريق الترشيح الجاذبية.
- إزالة المذيب على مبخر روتاري في خفض الضغط وعند 35 درجة مئوية.
- بعد إزالة كافة المذيب، تنطبق على الأنواع بيرازولوني عند أداء القسم 4.
- إضافة 40 مل حمض الخليك الجليدية قارورة مستديرة قاع 250 مل من اسطوانة في درجة حرارة الغرفة. إثارة الحل أثناء إضافة الهيدرازين (ما يعادل 1، 1.58 mol/L) وأسيتواسيتاتي الميثيل (ما يعادل 1، 1.58 mol/L). تجهيز قارورة مع مكثف ارتداد.
-
إعداد Α-أريليديني بيرازولينونيس
- إضافة بيرازولوني (ما يعادل 1، 0.49 mol/L)، بينزالديهيدي (ما يعادل 1، 0.49 mol/L)، وأكسيد الماغنسيوم (0.5 ز، أي ما يعادل 0.6)، وبار إثارة مغناطيسية في قارورة مستديرة قاع تجفف في فرن 100 مل تحت ن2 الغلاف الجوي.
- إضافة الاسيتو الانيتريل اللامائى (40 مل) إلى قارورة رد الفعل، استخدام المحاقن محكم، وثم تجهز قارورة مع مكثف ارتداد. الحرارة قارورة رد فعل إلى 120 درجة مئوية في حمام زيت مع التحريك ح 12.
- رصد التقدم المحرز رد فعل طبقة رقيقة اللوني (TLC)، استخدام النفط الاثير: إيثيل اسيتات (2:1 [v/v]، والاحتفاظ بعامل Rf = 0.86) الوينت.
- بعد اكتمال استهلاك بيرازولوني، بارد قارورة رد فعل وصولاً إلى درجة حرارة الغرفة. تصفية قبالة أكسيد الماغنسيوم عن طريق سد سليت.
- إزالة الاسيتو الانيتريل الزائدة باستخدام مبخر دوراني تحت ضغط مخفض وعند 35 درجة مئوية. تنقية المخلفات من كروماتوغرافيا العمود على السليكا هلام التينج مع النفط الاثير: إيثيل اسيتات (10:1 إلى 8:1 [v/v]) لتوفير النفط الخام المنتج.
- إضافة المنتج الخام إلى 100 مل قارورة Erlenmeyer مزودة بشريط إثارة مغناطيسية، ومن ثم قم بإضافة وحدة تخزين الحد أدنى من الإيثانول 95%. وضع في قارورة على صفيحة ساخنة وجعله يغلي لطيف حتى يذوب كامل الصلبة فقط. تأخذ قارورة قبالة صفيحة وبارد عليه ببطء دون أي تحريض.
ملاحظة: عندما يتم تبريد الخليط في درجة حرارة الغرفة، يتم تشكيل بيرازولينوني α-أريليديني المقابلة كبلورات نقية.
2-تجميع للأنواع اكتونات γ α-imino
- إضافة هيدروبروميد α-γ الأمينية-المادة (ما يعادل 1، 0.41 mol/L)، وسلفات المغنزيوم (ما يعادل 1، 0.41 mol/L)، إثيل (ما يعادل 1، 0.41 mol/L)، وبار إثارة مغناطيسية في قارورة مستديرة قاع تجفف في فرن 100 مل تحت الغلاف الجوي2 ن.
- إضافة مل 36 من الميثان اللامائى قارورة رد الفعل، استخدام المحاقن محكم. يقلب الخليط رد الفعل في درجة حرارة الغرفة حاء 1 إضافة المقابلة ثيوفين-2-كاربالديهيدي (ما يعادل 1.1، 0.45 mol/L) إلى الحل وآثاره لآخر ح 12.
- رصد التقدم المحرز في رد فعل TLC، استخدام النفط الاثير: إيثيل اسيتات (4:1 [ت/ت]) الوينت حتى حدوث استهلاك الأنواع lactone كاملة، ومن ثم، مرشح إيقاف رد فعل المخلوط باستخدام ورقة تصفية مع حجم مسام ميكرومتر 30−50.
- إضافة 5 مل مياه إلى الخليط الناتج وفصل الطبقة العضوية من المرحلة المائية. استخراج المرحلة مائي 2 x مع الميثان (30 مل). الجمع بين الطبقات العضوية في القمع سيباراتوري وغسلها x 2 مع محلول ملحي (50 مل).
- الجاف للطبقات العضوية مجتمعة فوق كبريتات الصوديوم اللامائية ح 1، وثم إزالة كبريتات الصوديوم عن طريق الترشيح الجاذبية. إزالة المذيب على مبخر روتاري في خفض الضغط وعند 35 درجة مئوية.
- بعد إزالة جميع المذيبات، تنطبق على الأنواع اكتونات γ α-Imino عند أداء القسم 4.
3-توليف محفز سكواراميدي بيفونكشونال C519
ملاحظة: لتركيب أورجانوكاتاليستس ج 5، انظر الشكل 2.
-
إعداد 3-((3,5-bis(trifluoromethyl)phenyl)amino)-4-methoxycyclobut-3-ene-1,2-dione (مجمع 1)
- إضافة 3,4-dimethoxycyclobut-3-ene-1,2-dione (ما يعادل 1، 0.63 mol/L)، انيلين 3.5-مكررا (تريفلوروميثيل) (ما يعادل 1.1، 0.69 mol/L)، 20 مل من الميثانول، وبار إثارة مغناطيسية في قارورة مستديرة قاع تجفف في فرن 100 مل تحت الغلاف الجوي2 ن.
- يقلب الخليط في درجة حرارة الغرفة ح 48. تشكيل ترسبات الأصفر يعد مؤشرا على أن يحدث رد فعل.
- تصفية الحل رد فعل من خلال قمع مزودة بورق الترشيح ويغسل المنتج الصلبة x 3 مع الميثانول (15 مل). جاف الصلبة الأصفر في الخلاء بين عشية وضحاها تحمل المنتجات النهائية صلبة صفراء.
-
توليف محفز C5
- إضافة 3-((3,5-bis(trifluoromethyl)phenyl)amino)-4-methoxycyclobut-3-ene-1,2-dione (ما يعادل 1; 1 مركبة، 0.2 mol/L) و (S)-(6-methoxyquinolin-4-yl)((1S,2R,4S,5R)-5-vinylquinuclidin-2-yl)methanamine (ما يعادل 2؛ 1 مركبة، 0.2 مول/لتر) وشريط مغناطيسي ضجة في قارورة أسفل جولة 25 مل تحت الغلاف الجوي2 ن.
- إضافة اللامائى الميثان (5 مل)، استخدام المحاقن محكم. يقلب الخليط في درجة حرارة الغرفة ح 48.
- رصد التقدم المحرز في رد فعل TLC، باستخدام dichloromethane:methanol (10:1 [ت/ت], Rf = 0.49) الوينت. بعد الانتهاء من رد فعل، تركز رد فعل المخلوط باستخدام مبخر دوراني عند 40 درجة مئوية.
- تنقية المخلفات من كروماتوغرافيا العمود على السليكا هلام الوتينج مع dichloromethane:methanol (20:1 [ت/ت]) لتقديم المنتج المطلوب.
4-غير المتناظر توليف المركبات بيسبيروسيكليك
- الجاف قارورة رد أسفل الجولة 50 مل يحتوي على حانة إثارة مغناطيسية. إزالة قارورة من الفرن وبارد عليه إلى درجة حرارة الغرفة التي تهب على ذلك مع غاز خامل قبل الاستخدام.
- إضافة α-أريليديني بيرازولينوني (1 mmol، ما يعادل 1، 0.1 mol/L) و α-imino اكتونات γ (1.2 ميللي مول، ما يعادل 1.2، 0.12 مول/لتر) إلى قارورة مستديرة القاع 50 مل تحت الغلاف الجوي2 ن.
- إضافة اللامائى إيثيل البروم ثنائي الفينيل (10 مل) إلى قارورة رد الفعل، استخدام المحاقن محكم. ثم، إضافة أورجانوكاتاليست المقابلة (ما يعادل 0.1، 0.01 mol/L) إلى الحل ويقلب الخليط رد فعل عند 40 درجة مئوية.
- رصد التقدم المحرز في رد فعل TLC، استخدام النفط الاثير: إيثيل اسيتات (4:1 [ت/ت], Rf = 0.51) الوينت.
ملاحظة: كانت نقاط انطلاق مواد ومنتجات تصور استخدام مصباح 254 نانومتر الأشعة فوق البنفسجية باليد. - بعد الانتهاء من رد فعل، تركز رد فعل المخلوط باستخدام مبخر دوراني عند 40 درجة مئوية.
- تنقية المخلفات من كروماتوغرافيا العمود على السليكا هلام التينج مع النفط الاثير: إيثيل اسيتات (4:1 [ت/ت]) تقديم المنتج النهائي.
- تحديد خصائص المنتج النهائي 1ح وأطياف "الرنين المغناطيسي النووي ج" 13، استخدام مطياف الرنين المغناطيسي النووي سرعة 400 ميجاهرتز. تحديد قيم هة المنتج، باستخدام عمود انطباقي.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
ودرست مختلف المانحين السندات الهيدروجين أورجانوكاتاليستس بيفونكشونال حضور أورجانوكاتاليستس في الميثان (DCM) عند 25 درجة مئوية (الجدول 1). ويرد في الشكل 1عملية أورجانوكاتاليستس الاصطناعية الممثل. فحص أورجانوكاتاليستس مختلفة (الجدول 1، إدخالات 1-6) أدى إلى C5 مع ستيريوسيليكتيفيتي ممتازة (هة 94%، > د. 20:1، ودخول 5) والعائد أفضل (yield 85%). تحسين مزيدا من المذيبات (الجدول 1، إدخالات 7-11) واقترح آخرون2س كان الأفضل في هذه العملية التركيبية.
إلى حد كبير، دراسة من رد فعل العمومية، تم اختبار مجموعة متنوعة من سوبستيتوينتس سينثونس سبيروسيكليزيشن اثنين مع مختلف المجموعات الوظيفية بنجاح باستخدام شروط رد فعل النموذج الأمثل، أسفر عن المطلوب بيسبيروسيكليس خيرا للمحاصيل ممتازة وستيريوسيليكتيفيتي. ويشمل نطاق بيرازولينوني 1a بديلاً من مجموعة فينيل على α-أريليديني مع طائفة واسعة من أريل، نافثيل، وجماعات ثينيل، ركائز مع سوبستيتوينتس مختلفة مثل إيثيل، ديسيل، ثالثي-بوتيل، ومجموعة البنزيل في 3- الموقف، وسوبستيتوينتس مع الخصائص الإلكترونية المختلفة على الحلبة أريل في الموضع 1. إلى جانب ذلك، استكشاف الركيزة تمت الاستعاضة عن نطاق imino lactone 2a، مجموعة إستر imino دوري مع مجموعة 5-ميثيلثيوفينيل، فينيل أو 2-نافثيل، تزويد بيسبيروسيكليس بالغلة مماثلة وستيريوسيليكتيفيتيس كبيرة.
وأكد هيكل المنتجات بيسبيروسيكليك 1ح وأطياف "الرنين المغناطيسي النووي ج" 13. تميز نقاء بصري وستيريوسيليكتيفيتي للمنتجات ستيريويسومير، تحددت قيم هة استخدام مراوان [هبلك]، وتم تحديد قيم د. بسرعة 400 ميجاهرتز 1"ح الرنين المغناطيسي النووي". [هبلك] ريبريهينسيفي توصيف نتائج مجمع 3e ترد في الشكل 3. لاستكشاف نسبية الهيكلية، استخدمت البلورات بالأشعة السينية لتحليل 3e، الكشف عن تكوين المنتج 3e المطلق (5ق، 6ص، 7ص،ص13). ويرد هيكل واحد-كريستال 3e في الشكل 4. 1590396 ككدك يحتوي على بيانات بلورية 3e، التي يمكن الحصول عليها مجاناً من "مركز البيانات بلورية كامبريدج" (www.ccdc.cam.ac.uk/data_request/cif).
على سبيل المثال، بيانات توصيف المنتج بيسبيروسيكليك (3e) وكانت كما يلي: Rf = 0.51 (4:1 [v/v]، النفط الاثير/أتاك)؛ 1 ح الرنين المغناطيسي النووي (400 ميجاهرتز، كدكل3) δ 7.55 (د، ي = 7.2 هرتز، ح 2)، 7.35-7.31 (م، ح 2) 7.22 7.26 (م، ح 2)، 6.93 6.98 (م، ح 3) 6.90-6.88 (م، ح 1)، 5.03، 7.15 7.19 (م، ح 2) (د، ي = 11.6 هرتز، ح 1)، 4.57 (ق، ح 1)، 4.46-4.40 (م، ح 1)، 4.09 (الدفتيريا، ي = 8.8، هرتز 2.0 ، ح 1)، 3.80 (د، ي = 11.6 هرتز، ح 1)، 2.61 2.67 (م، ح 1)، 2.35-2.27 (م، ح 4)؛ 13 Δ الرنين المغناطيسي النووي (100 ميجاهرتز، كدكل3) ج 178.8، 171.9، 163.9، 161.4، 158.5، 137.1، 136.0، 131.3، 131.2، 128.8، 127.0، 125.8، 125.4، 125.0، 119.7، 116.3، 116.1، 70.8، 67.4، 66.0، 64.1، 57.5، 34.6، 13.6؛ 19 الرنين المغناطيسي النووي (376 ميغاهرتز، كدكل3) و δ 112.8. تم تحديد قيمة هة بتحليل [هبلك]، الهكسين/2-بروبانول 80/20، معدل التدفق = 1.0 مل/دقيقة، 254 نانومتر، tr = 8.63 دقيقة (الرئيسية)؛ ووجد كالكد "نظام إدارة الموارد البشرية" (ESI) ج26ح23ن3س3سادس+ [M + H]+ 476.1439، 476.1446.
| دخول | محفز | المذيبات | العائد[] (%) | د.[ج] | هة[د] (%) |
| 1 | C1 | • قرار مجلس الوزراء | 81 | > 20:1 | 94 |
| 2 | C2 | • قرار مجلس الوزراء | 82 | 12:1 | 90 |
| 3 | C3 | • قرار مجلس الوزراء | 30 | 9:1 | 0 |
| 4 | C4 | • قرار مجلس الوزراء | 78 | > 20:1 | 71 |
| 5 | C5 | • قرار مجلس الوزراء | 85 | > 20:1 | 94 |
| 6 | C6 | • قرار مجلس الوزراء | 70 | 12:1 | 93 |
| 7 | C5 | تولوين | 79 | > 20:1 | 95 |
| 8 | C5 | THF | 73 | 15:1 | 89 |
| 9 | C5 | شكل3 | 71 | > 20:1 | 93 |
| 10 | C5 | DCE | 81 | 18:1 | 91 |
| 11 | C5 | Et2س | 88 (83[ب]) | > 20:1 | 98 |
|
[أ] الغلة يحددها 1تحليل "ح الرنين المغناطيسي" من النفط الخام المنتج باستخدام 4-إيودوانيسولي كمعيار داخلي. [ب] الغلة معزولة. [ج] تتحدد نسبة 1"ح الرنين المغناطيسي النووي". [د] تتحدد حسب مراوان [هبلك]. |
|||||
الجدول 1: الاستفادة المثلى حالة رد الفعل. وقد تم تعديل الجدول من تشن et al.18.

رقم 1: نموذج رد الفعل بين 1a و 2a. يتم سرد هياكل أورجانوكاتاليستس بيفونكشونال (C1-C6). يظهر هذا الشكل ردود الفعل التي يؤديها مع 1a (0.10 ملمول)، 2a (0.12 ملمول)، ومحفِّز (مول 10 في المائة) في المذيبات (1 مل) في درجة حرارة الغرفة ح 8-72. للحصول على إجراءات تجريبية مفصلة، راجع البروتوكول. وقد تم تعديل هذا الرقم من تشن et al.18. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
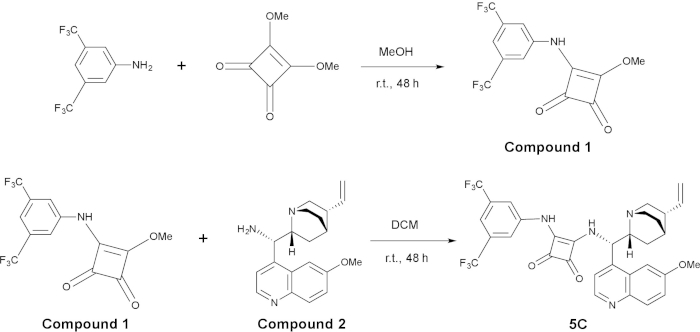
رقم 2: توليف أورجانوكاتاليست جيم 5 أعلى اللوحة هو تجميع ل مجمع 1، واللوحة السفلية هو توليف ج 5 من مجمع 1 و مجمع 2. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
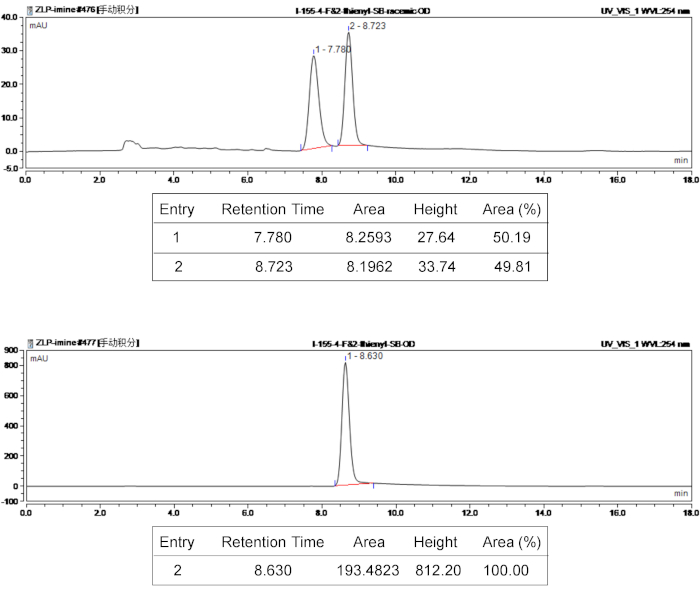
الشكل 3: [هبلك] أطياف المنتج الراسيمي ومراوان 3e- أعلى اللوحة الطيف [هبلك] المنتج الراسيمي 3e، واللوحة السفلية هو طيف مراوان 3e[هبلك]. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الشكل 4: هيكل واحد-كريستال 3e- هيكل الأيسر هو هيكل واحد-كريستال 3e، والهيكل الصحيح هو 3e مع الفراغية لكل ذرة المعينة بشكل صحيح. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
Subscription Required. Please recommend JoVE to your librarian.
Discussion
الإعداد الناجح لهياكل عظمية بيسبيرو [γ-بيوتيرولاكتون-بيروليدين-4, 4 '-بيرازولوني] يعتمد على عدد من العوامل.
أن الخطوة الرئيسية لهذه العملية غير المتناظر سيكلواديشن خطوة واحدة هو تفعيل سينيرجيستيكال α-أريليديني بيرازولينوني 1a و إستر imino دوري 2a من محفز سكواراميدي بيفونكشونال. ويتحقق بتشكيل السندات الهيدروجين الجزيئات متعددة بين محفز كمانح هيدروجين سندات وهما رد فعل ركائز. تبعاً لذلك، مع عائق كبير الفراغية، C5، الخروج من جميع السندات الهيدروجين المانحة بيفونكشونال أورجانوكاتاليستس فرزهم، عرضت ستيريوسيليكتيفيتي أفضل. يستخدم البروتوكول لوحظ مول 10% حافز في رد الفعل النموذجي. وإلى جانب ذلك، ضروري شرط القابلية للذوبان عالية من ركائز ومحفِّز. نتيجة لذلك، استخدام Et2س كمذيب الأمثل لا يضمن أن ركائز ومحفِّز يتم حلها تماما في درجة حرارة الغرفة بل أنها تمر سيكلواديشن سلس مع الغلة العالية وستيريوسيليكتيفيتيس، وكذلك. جدير بالذكر أن المياه في النظام رد فعل يؤدي إلى ستيريوسيليكتيفيتي الفقيرة. من أجل ضمان توليفة ناجحة، من المهم للتحقق من جفاف جميع الكواشف والمذيبات قبل البدء في رد فعل.
سيكلواديشن متوافقة مع تشكيلة واسعة من بيرازولينوني المستبدلة α-أريليديني. على وجه التحديد، هي أيضا التسامح سوبستيتوينتس مع مجموعة أريل مختلفة على α-أريليديني. إلكترون سحب مجموعات أريل، نظراً لما اليكتروفيليسيتي زيادة خلال سيكلواديشن 1، 3-حلقية، المفضلة من حيث الغلة وستيريوسيليكتيفيتي. أيضا، استبدال ركائز مثل 3-الموقف، إيثيل، ديسيل، ثالثي-بوتيل، وجماعات البنزيل وموقف 1، فونكتيوناليزيد بحلقات أريل الإلكترونية المختلفة، ويسمح بدرجة عالية. وعلاوة على ذلك، سوبستيتوينتس مجموعة إستر imino دوري في lactone imino مع فينيل أو ثيوفينيل أو مجموعات نافثيل أيضا متوافقة مع رد فعل. جدير بالذكر أنه، ضمانا لرد فعل ناجح، مطلوب زيادة صغيرة من lactone imino (ما يعادل 1.2). في معظم الحالات، يتم الاحتفاظ تركيزات ركائز في 0.12-0.1 مقياس mol/L في 1 مل مذيب. استناداً إلى أنواع من ركائز والمواد الحفازة، قد تتخذ رد فعل سيكلواديتيون خطوة واحدة ح 8-72 في درجة حرارة الغرفة.
تجدر الإشارة إلى أن هذه سيكلواديشن توفر مستوى عال من ستيريوسيليكتيفيتي عندما كان مستبدل4 R imino lactone 2 مجموعة ثيولفينيل أو 5-ميثيلثيوفينيل 2-نافثيل. ومع ذلك، عندما استعيض مستبدل4 R الألكيل سوبستيتوينتس أو سوبستيتوينتس الحلقية الأخرى، قد تحقق ستيريوسيليكتيفيتي منخفضة أو رد فعل منخفضة عائد.
وباختصار، يسمح البروتوكول قدم البناء غير المتناظر المباشر من بيسبيرو [γ-بيوتيرولاكتون-بيروليدين-4, 4 '-بيرازولوني] رد فعل سيكلواديشن 1، 3-حلقية أورجانوكاتاليتيك في غلة المحاصيل ممتازة وعلى مستوى عال من كفاءة في خطوة واحدة باستخدام ستيريوسيليكتيفيتي. وعلاوة على ذلك، هذه المنهجية الجديدة متوافق مع سينثونس اثنين تحمل مجموعات وظيفية متعددة الاستخدامات، وينبغي أن تكون مفيدة لتركيب عوامل علاجية متنوعة مع السقالات بيسبيروسيكليك.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgments
الكتاب نقدر الدعم المالي من "مؤسسة العلوم الطبيعية الوطنية الصينية" (رقم 21708051 إلى X.C.).
Materials
| Name | Company | Catalog Number | Comments |
| Acetonitrile, anhydrous, 99.9% | Innochem (China) | A0080 | |
| α-amino-γ-butyrolactone hydrobromide, 98% | Alfa Aesar | B23148 | |
| 3,5-bis(trifluoromethyl)aniline, 98+% | Adamas | 48611B | |
| Dichloromethane, 99.5% | Greagent | G81014H | |
| 3,4-dimethoxycyclobut-3-ene-1,2-dione, 98+% | Leyan (China) | 1062550 | |
| Ethanol, 99.5% | Greagent | G73537B | |
| Ethyl acetate, 99.5% | Greagent | G23272L | |
| Ethyl ether,anhydrous,99.5% | Greagent | G69159B | |
| Ethyl 3-oxobutanoate, 98% | TCI | A0649 | |
| 4-fluorobenzaldehyde, 98% | Innochem (China) | A24295 | |
| Glacial acetic acid, 99.5% | Greagent | G73562B | |
| Magnesium oxide, 99+% | Alfa Aesar | 44733 | |
| Magnesium sulfate, 98% | Greagent | G80872C | |
| Methanol, 99.5% | Greagent | G75851A | |
| Petroleum ether | Greagent | G84208D | |
| Phenylhydrazine, 98% | Innochem (China) | A57671 | |
| (S)-(6-methoxyquinolin-4-yl)((1S,2R,4S,5R)-5-vinylquinuclidin-2-yl)methanamine | DAICEL Group | 111240 | |
| Sodium sulfate,anhydrous,99% | Greagent | G82667A | |
| Thiophene-2-carbaldehyde, 98% | J & K scientific (China) | 124605 | |
| Triethylamine, 99% | J & k scientific (China) | 432915 |
References
- Rios, R. Enantioselective methodologies for the synthesis of spiro compounds. Chemical Society Reviews. 41 (3), 1060-1074 (2012).
- Khan, R. K., et al. Synthesis, isolation, characterization, and reactivity of high-energy stereogenic-at-Ru carbenes: stereochemical inversion through olefin metathesis and other pathways. Journal of the American Chemical Society. 134 (30), 12438-12441 (2012).
- Wang, X., Han, Z., Wang, Z., Ding, K. Catalytic asymmetric synthesis of aromatic spiroketals by spinphox/iridium(I)-catalyzed hydrogenation and spiroketalization of alpha,alpha'-bis(2-hydroxyarylidene) ketones. Angewandte Chemie International Edition. 51 (4), 936-940 (2012).
- Kim, N., Sohn, M. J., Koshino, H., Kim, E. H., Kim, W. G. Verrulactone C with an unprecedented dispiro skeleton, a new inhibitor of Staphylococcus aureus enoyl-ACP reductase, from Penicillium verruculosum F375. Bioorganic & Medicinal Chemistry Letters. 24 (1), 83-86 (2014).
- Mulholland, D. A., Schwikkard, S. L., Crouch, N. R. The chemistry and biological activity of the Hyacinthaceae. Natural Product Reports. 30 (9), 1165-1210 (2013).
- Tan, B., Hernandez-Torres, G., Barbas, C. F. Highly efficient hydrogen-bonding catalysis of the Diels-Alder reaction of 3-vinylindoles and methyleneindolinones provides carbazolespirooxindole skeletons. Journal of the American Chemical Society. 133 (32), 12354-12357 (2011).
- Cayuelas, A., et al. Enantioselective Synthesis of Polysubstituted Spiro-nitroprolinates Mediated by a (R,R)-Me-DuPhos.AgF-Catalyzed 1,3-Dipolar Cycloaddition. Organic Letters. 18 (12), 2926-2929 (2016).
- Lacharity, J. J., et al. Total Synthesis of Unsymmetrically Oxidized Nuphar Thioalkaloids via Copper-Catalyzed Thiolane Assembly. Journal of the American Chemical Society. 139 (38), 13272-13275 (2017).
- Liu, K., Teng, H. L., Yao, L., Tao, H. Y., Wang, C. J. Silver-catalyzed enantioselective desymmetrization: facile access to spirolactone-pyrrolidines containing a spiro quaternary stereogenic center. Organic Letters. 15 (9), 2250-2253 (2013).
- Zhu, G., et al. Asymmetric [3 + 2] Cycloaddition of 3-Amino Oxindole-Based Azomethine Ylides and alpha,beta-Enones with Divergent Diastereocontrol on the Spiro[pyrrolidine-oxindoles]. Organic Letters. 19 (7), 1862-1865 (2017).
- Sun, W., et al. Organocatalytic diastereo- and enantioselective 1,3-dipolar cycloaddition of azlactones and methyleneindolinones. Angewandte Chemie International Edition. 52 (33), 8633-8637 (2013).
- Grigg, R., Kilner, C., Sarker, M. A. B., Orgaz de la Cierva, C., Dondas, H. A. X=Y–ZH compounds as potential 1,3-dipoles. Part 64: Synthesis of highly substituted conformationally restricted and spiro nitropyrrolidines via Ag(I) catalysed azomethine ylide cycloadditions. Tetrahedron. 64 (37), 8974-8991 (2008).
- Liu, T. L., He, Z. L., Tao, H. Y., Wang, C. J. Stereoselective construction of spiro(butyrolactonepyrrolidines) by highly efficient copper(I)/TF-BiphamPhos-catalyzed asymmetric 1,3-dipolar cycloaddition. Chemistry. 18 (26), 8042-8046 (2012).
- Wang, L., Shi, X. M., Dong, W. P., Zhu, L. P., Wang, R. Efficient construction of highly functionalized spiro[gamma-butyrolactone-pyrrolidin-3,3'-oxindole] tricyclic skeletons via an organocatalytic 1,3-dipolar cycloaddition. Chemical Communications. 49 (33), 3458-3460 (2013).
- Yetra, S. R., Mondal, S., Mukherjee, S., Gonnade, R. G., Biju, A. T. Enantioselective Synthesis of Spirocyclohexadienones by NHC-Catalyzed Formal [3+3] Annulation Reaction of Enals. Angewandte Chemie International Edition. 55 (1), 268-272 (2016).
- Liu, J. Y., Zhao, J., Zhang, J. L., Xu, P. F. Quaternary Carbon Center Forming Formal [3 + 3] Cycloaddition Reaction via Bifunctional Catalysis: Asymmetric Synthesis of Spirocyclohexene Pyrazolones. Organic Letters. 19 (7), 1846-1849 (2017).
- Mondal, S., Mukherjee, S., Yetra, S. R., Gonnade, R. G., Biju, A. T. Organocatalytic Enantioselective Vinylogous Michael-Aldol Cascade for the Synthesis of Spirocyclic Compounds. Organic Letters. 19 (16), 4367-4370 (2017).
- Chen, N., et al. Asymmetric Synthesis of Bispiro[γ-butyrolactone-pyrrolidin-4,4'-pyrazolone] Scaffolds Containing Two Quaternary Spirocenters via an Organocatalytic 1,3-Dipolar Cycloaddition. European Journal of Organic Chemistry. 2018 (23), 2939-2943 (2018).
- Yang, W., Du, D. M. Highly enantioselective Michael addition of nitroalkanes to chalcones using chiral squaramides as hydrogen bonding organocatalysts. Organic Letters. 12 (23), 5450-5453 (2010).



