Summary
Скелетов enantiomerically обогащенный bispiro [гамма-бутиролактон пирролидин-4, 4'-пиразолон] несимметрично синтезируется посредством реакции циклоприсоединения 1,3-дипольного простой organocatalytic.
Abstract
Bispirocyclic леса являются одним из важных структурных подразделений во многих натуральных продуктов, которые демонстрируют разнообразной и привлекательной биологической деятельности. Недавно мы разработали стратегию эффективной organocatalytic, которая обеспечивает легким доступ к различным enantiomerically обогащенный bispiro [гамма-бутиролактон пирролидин-4, 4'-пиразолон] скелетов. В этой статье мы демонстрируем подробный протокол для асимметричного синтеза наркотиков как bispirocyclic соединений с двумя центрами углеродных spirocyclic через organocatyltic реакции 1,3-дипольного циклоприсоединения. Spirocyclization синтонов α-имино γ-лактоны и alkylidene pyrazolones готовы во-первых, которые затем подвергаются реакции циклоприсоединения присутствии бифункциональных squaramide organocatalyst позволить желаемый bispirocycles высокой урожайности и отличные stereoselectivities. Хиральные высокопроизводительных жидкостной хроматографии (ВЭЖХ) осуществляется для определения энантиомерные чистоты продукции, и значение d.r. изучается протонного ядерного магнитного резонанса (1H ЯМР). По данным рентгеновской кристаллографических анализ назначается абсолютной конфигурации продукта. Это синтетические стратегия позволяет ученым подготовить разнообразие bispirocyclic леса в высоких урожаев и отличные diastereo - и enantioselectivities.
Introduction
Хиральная spirocyclic соединений нашли широкое распространение в натуральных продуктов, хиральных лигандов и металлоорганические комплексы стали привлекательными синтетических показателей вследствие их структурной сложности и биологической активности1,2, 3. В частности bispirocyclic леса, представленные тремя кольцами с двумя жесткими spirocenters, являются структурными подразделениями во многих природных продуктов с важной биологической деятельности4,5. Следовательно строительство соединений с stereocontrolled, оптически чистый bispirocyclic скелеты привлекла большое внимание за последние несколько десятилетий. Большое количество spirocyclic соединений и их производные синтезированы успешно через металлоорганические подходов и organocatalytic подходов, например, асимметричной cycloadditions как 1,3-дипольного cycloadditions и реакции Дильса-Альдера реакции6,,78. Однако эти молекулы являются главным образом monospirocyclic структуры, в то время как bispirocyclic структуры являются менее сообщили о и ограничивается строительство на основе индола bispirocycles.
Чтобы получить более структурно различных bispirocyclic соединений, универсальность циклоприсоединения синтонов для асимметричного строительство центров spirocyclic был изучены9,10,11. Особенно с бифункциональных squaramide organocatalysts, азометинкарбоновых фосфора12,13,14, например α-имино γ-лактонов и dipolarophiles, например alkylidene pyrazolones15,16 ,17, способны пройти простой 1,3-дипольного циклоприсоединения построить скелетов bispirocyclic с несколькими stereocenters, что делает их идеальным spirocyclization синтонов (рис. 1). После оптимизации структуры organocatalyst и реакции растворителя, этот процесс циклоприсоединения эффективно дает желаемый продукт с высокой урожайностью и отличные enantio - и diastereoselectivity. Кроме того эта реакция экспонаты сравнительно высокой структурной терпимости на широкий спектр циклоприсоединения синтонов с18различных функциональных групп. Этот новый метод обеспечивает эффективный доступ к целому ряду весьма функционализированных наркотиков подобных соединений с двумя четвертичных spirocenters через простой organocatalytic циклоприсоединения, сияющий свет на его применение в структурного разнообразия ориентированный синтез этой интригующей класса соединений.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Предупреждение: Обратитесь все соответствующие листы данных безопасности материалов (MSDS) перед использованием. Химических веществ и растворителей, используемых были марки реагента и были использованы без дальнейшей очистки. Все реакции с участием воздуха или влаги чувствительных реагентов или промежуточных продуктов были проведены в атмосфере аргона.
1. Подготовка видов α-Arylidiene Pyrazolinone
-
Подготовка pyrazolones
- Добавьте 40 мл уксусной кислоты кристаллизированной 250 мл раунд нижней колбе из мерного баллона при комнатной температуре. Перемешайте раствор при добавлении гидразина (1 эквивалент, 1,58 моль/Л) и метил ацетоуксусный (1 эквивалент, 1,58 моль/Л). Оборудовать колбу с обратным холодильником.
Примечание: Эта концентрация используется потому, что более низкой концентрации приводит к медленнее скорость реакции. - Тепло реакции колбу до 120 ° C в масляной ванне помешивая в течение 3 ч. После охлаждения реакции колбу до температуры окружающей среды, удалите магнитные перемешать бар, используя ретривер бар stir. Концентрат реакционную смесь, используя роторный испаритель при температуре 60 ° C. Избегайте разлив реакционную смесь из-за отрицательного давления.
- Добавить 20 мл обессоленной воды в колбу реакции и передача решения в воронку separatory. Экстракт водный слой 3 x с этилацетат (30 мл). Объединить органических слоев в separatory воронка и мыть их 2 x с рассола (50 мл).
- Сухие комбинированные органических слоев за безводный сульфат натрия 1 h и удалите сульфат натрия, тяжести фильтрации.
- Удаление растворителя на роторный испаритель при пониженном давлении и температуре 35 ° C.
- После удаления всех растворителя, применяются пиразолон видов при выполнении раздела 4.
- Добавьте 40 мл уксусной кислоты кристаллизированной 250 мл раунд нижней колбе из мерного баллона при комнатной температуре. Перемешайте раствор при добавлении гидразина (1 эквивалент, 1,58 моль/Л) и метил ацетоуксусный (1 эквивалент, 1,58 моль/Л). Оборудовать колбу с обратным холодильником.
-
Подготовка Α-Arylidiene Pyrazolinones
- Добавьте пиразолон (1 эквивалент, 0.49 моль/Л), Бензойный альдегид (1 эквивалент, 0.49 моль/Л), оксид магния (0,5 г, 0,6 эквивалент) и магнитный перемешать бар в раунд нижней колбе печь сушеные 100 мл под N2 атмосферы.
- Добавьте безводный Ацетонитрил (40 мл) реакции колбу, с использованием герметичной шприц и затем, оборудовать колбу с обратным холодильником. Тепло реакции колбу до 120 ° C в масляной ванне помешивая в течение 12 ч.
- Следить за ходом реакции на тонкий слой хроматографии (ТСХ), с использованием нефти эфира: Этилацетат (2:1 [v/v], удержание коэффициент Rf = 0,86) как элюента.
- После полного потребления пиразолона прохладный колбу реакции до комнатной температуры. Фильтр от оксида магния через Celite вилкой.
- Удалите избыток ацетонитриле с помощью роторный испаритель при пониженном давлении и температуре 35 ° C. Очищайте остатки по колоночной хроматографии на силикагеле элюирующие с нефтяной эфира: Этилацетат (10:1-8:1 [v/v]) предоставлять сырой продукт.
- Добавить сырой продукт в 100 мл колбу Эрленмейера, с баром магнитные перемешать, а затем, добавьте минимальный объем 95% этиловом спирте. Поместите колбу на горячей плите и довести его до кипения нежный, пока весь твердый просто растворится. Принимать настой покинуть поджарки и медленно охладить его без перемещения.
Примечание: Когда смесь охлаждают до комнатной температуры, соответствующей pyrazolinone α-arylidiene формируется как чистые кристаллы.
2. синтез α-имино γ-лактонов видов
- Добавьте α-аминокислот гамма-бутиролактон гидробромида (1 эквивалент, 0,41 моль/Л), сульфат магния (1 эквивалент, 0,41 моль/Л), триэтиламин (1 эквивалент, 0,41 моль/Л) и магнитный перемешать бар в раунд нижней колбе печь сушеные 100 мл под N2 атмосферы.
- Добавьте 36 мл безводного дихлорметан в колбу реакции, с использованием герметичной шприца. Перемешать смесь реакции при комнатной температуре в течение 1 ч. добавить соответствующий тиофен-2-карбальдегида (1.1 эквивалент, 0,45 моль/Л) в решение и размешать для другого 12 h.
- Контролируйте ход реакции на TLC, с использованием нефти эфира: Этилацетат (4:1 [v/v]) как элюента до тех пор, пока имеет место полное потребление видов лактон, а затем фильтр от реакционной смеси, используя фильтр бумага с порами размером 30−50 мкм.
- Добавьте 5 мл обессоленной воды в результате смесь и отдельные органический слой из водной фазы. Извлечь водяной участок 2 x с Дихлорметан (30 мл). Объединить органических слоев в separatory воронка и мыть их 2 x с рассола (50 мл).
- Сухие комбинированные органических слоев за безводный сульфат натрия 1 h и удалите сульфат натрия, тяжести фильтрации. Удаление растворителя на роторный испаритель при пониженном давлении и температуре 35 ° C.
- После удаления всех растворителя, применяются α-имино γ-лактонов видов при выполнении раздела 4.
3. синтез squaramide бифункционального катализатора C519
Примечание: Для синтеза organocatalysts 5C, смотрите Рисунок 2.
-
Подготовка 3-((3,5-bis(trifluoromethyl)phenyl)amino)-4-methoxycyclobut-3-ene-1,2-dione (соединение 1)
- Добавьте 3,4-dimethoxycyclobut-3-ene-1,2-dione (эквивалент 1, 0,63 моль/Л), 3,5-бис (trifluoromethyl) анилина (1.1 эквивалент, 0,69 моль/Л), 20 мл метанола и магнитные перемешать бар в раунд нижней колбе печь сушеные 100 мл под N2 атмосферы.
- Перемешайте смесь при комнатной температуре в течение 48 часов. Формирование желтый осадок является признаком, что реакция проходит.
- Фильтр реакции раствора через воронку оснащены фильтровальная бумага и мыть твердый продукт 3 x с метанолом (15 мл). Сухой желтого тела в вакууме на ночь позволить конечной продукции как желтого тела.
-
Синтез катализатора C5
- Добавить 3-((3,5-bis(trifluoromethyl)phenyl)amino)-4-methoxycyclobut-3-ene-1,2-dione (соединение 1; 1 эквивалент, 0,2 моль/Л) и (S)-(6-methoxyquinolin-4-yl)((1S,2R,4S,5R)-5-vinylquinuclidin-2-yl)methanamine (соединение 2; 1 эквивалент, 0,2 моль/Л) и бар магнитные переполох в раунд нижней колбе 25 мл под N2 атмосферы.
- Добавление безводный Дихлорметан (5 мл), с использованием герметичной шприца. Перемешайте смесь при комнатной температуре в течение 48 часов.
- Следить за ходом реакции методом ТСХ, используя dichloromethane:methanol (10:1 [v/v], Rf = 0,49) как элюента. После завершения реакции, концентрат реакционную смесь, используя роторный испаритель при 40 ° C.
- Очищайте остатки по колоночной хроматографии на силикагеле элюирующие с dichloromethane:methanol (20:1 [v/v]) для обеспечения желаемого продукта.
4. асимметричный синтез bispirocyclic соединений
- Сухие 50 мл раунд дно реакции колбу, содержащие бар магнитные перемешать. Вынуть колбу из духовки и охладить до комнатной температуры, дуя на нее с инертным газом перед использованием.
- Добавьте 50 мл раунд нижней колбе под N2 атмосферы α-arylidiene pyrazolinone (1 ммоль, 1 эквивалент, 0,1 моль/Л) и α-имино γ-лактонов (1,2 ммоль, 1.2 аналоги, 0,12 моль/Л).
- Добавьте безводного этилового эфира (10 мл) в реакции колбу, с использованием герметичной шприца. Затем добавьте в решение соответствующих organocatalyst (эквивалент 0,1, 0,01 моль/Л) и перемешать смесь реакции при 40 ° C.
- Следить за ходом реакции методом ТСХ, с использованием нефти эфира: Этилацетат (4:1 [v/v],f R = 0,51) как элюента.
Примечание: Пятна начиная материалов и продуктов были визуализируется с использованием ручных 254 Нм УФ лампы. - После завершения реакции, концентрат реакционную смесь, используя роторный испаритель при 40 ° C.
- Очищайте остатки по колоночной хроматографии на силикагеле элюирующие с нефтяной эфира: Этилацетат (4:1 [v/v]) для обеспечения конечного продукта.
- Характеризовать конечный продукт 1H, 13C NMR спектров, с помощью ЯМР-спектрометр 400 МГц. Определите значения ee продукта, используя хиральный столбец.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Различные доноры Скрепление водопода бифункциональных organocatalysts были рассмотрены в присутствии organocatalysts в Дихлорметан (DCM) при 25 ° C (Таблица 1). Представитель синтетических процесс organocatalysts показано на рисунке 1. Скрининг различных organocatalysts (Таблица 1, записи 1-6) привело к C5 с отличным стереоселективность (94% ee, > д.р. 20:1, вход 5) и лучший картридж (85%). Дальнейшая оптимизация растворителей (Таблица 1, записи 7-11) предложил Et2O является предпочтительным в этом процессе синтетических.
Значительно для изучения общего характера реакции, различные фторсодержащими заместителями два spirocyclization синтонов с различными функциональными группами были протестированы успешно используя оптимизированная модель условий реакции, что приводит к желаемому уровню bispirocycles с хорошим отличные урожаи и стереоселективность. Pyrazolinone 1a включает в себя замену фенильные группы по α-arylidiene с широким кругом арил, naphthyl и thienyl групп, субстратов с различными фторсодержащими заместителями как этиловый, децил, трет- бутил и бензиловый группы на 3- позиция и фторсодержащими заместителями с различных электронных свойств арил кольцо в позиции 1. Кроме того изучить субстрат сферы имино лактон 2a, остаток циклических имино Эстер был заменен с группой 5-methylthiophenyl, фенил или 2-naphthyl, обеспечивая bispirocycles с аналогичными урожайности и значительные stereoselectivities.
Структура bispirocyclic продукции было подтверждено 1H, 13C ЯМР спектроскопии. Характеризовать оптической чистоты и стереоселективность стереоизомер продуктов, ee значения были определены с использованием хиральные ВЭЖХ и д.р. значения были определены 400 МГц 1H ЯМР. На рисунке 3приведены возмутительное ВЭЖХ характеристика результаты составных 3e . Исследовать структурной теории относительности, рентгеноструктурного анализа был использован для анализа 3e, раскрывая абсолютной конфигурации продукта 3e (5S,R,R, 13R7 6). Одиночн кристалл структура 3e показана на рисунке 4. CCDC 1590396 содержит кристаллографических данные 3e, которые могут быть получены бесплатно от центра Cambridge кристаллографических данных (www.ccdc.cam.ac.uk/data_request/cif).
Например, характеристики данных для bispirocyclic продукта (3e) были следующими: Rf = 0,51 (4:1 [v/v], нефтяной эфира/EtOAc); 1 H ЯМР (400 МГц, CDCl3) δ 7.55 (d, J = 7.2 Гц, 2 H), 7.35-7.31 (м, Ч. 2), 7.26-7,22 (м, Ч. 2), 7.19-7.15 (м, Ч. 2), 6.98-6,93 (m, 3 Ч), 6.90-6,88 (m, 1 H), 5.03 (d, J = 11,6 Гц, 1 Ч), 4.57 (s, 1 H), 4.46-4.40 (m, 1 H), 4.09 (ТД, J = 8,8, 2.0 Гц 1 H), 3,80 (d, J = 11,6 Гц, 1 H), 2.67-2.61 (m, 1 H), 2,35-2.27 (m, 4 Ч); 13 C ЯМР (100 МГц, CDCl3) δ 178.8, 171.9, 163.9, 161,4, 158.5, 137.1, 136.0, 131.3, 131.2, 128,8, 127.0, 125,8, 125,4, 125,0, 119.7, 116.3, 116.1, 70,8, 67,4, 66.0, 64,1, 57,5, 34,6, 13,6; 19 ЯМР (376 МГц, CDCl3) F δ 112.8. Ее значение определяется ВЭЖХ анализа, гексан/2-пропанол 80/20, скорость потока = 1.0 мл/мин, 254 Нм, tr = 8.63 мин (майор); HRMS (ESI) Calcd для C26H23N3O3SF+ + 476.1439, [M + H] нашли 476.1446.
| Вход | Катализатор | Растворитель | Выход[] (%) | д.р.[c] | ee[d] (%) |
| 1 | C1 | ДКМ | 81 | > 20:1 | 94 |
| 2 | C2 | ДКМ | 82 | 12:1 | 90 |
| 3 | C3 | ДКМ | 30 | 9:1 | 0 |
| 4 | C4 | ДКМ | 78 | > 20:1 | 71 |
| 5 | C5 | ДКМ | 85 | > 20:1 | 94 |
| 6 | C6 | ДКМ | 70 | 12:1 | 93 |
| 7 | C5 | Толуол | 79 | > 20:1 | 95 |
| 8 | C5 | ТГФ | 73 | 15:1 | 89 |
| 9 | C5 | КХКЛ3 | 71 | > 20:1 | 93 |
| 10 | C5 | DCE | 81 | 18:1 | 91 |
| 11 | C5 | ET2O | 88 (83[b]) | > 20:1 | 98 |
|
[] урожаи были определены 1H ЯМР анализ сырой продукт, используя 4-iodoanisole в качестве внутреннего стандарта. [b] изолированных доходность. [c] коэффициент определяется 1H ЯМР. [d] преисполнены на хиральные ВЭЖХ. |
|||||
Таблица 1: Оптимизация состояния реакции. От Chen et al.18была изменена таблица.

Рисунок 1: модель реакции между 1a и 2a. Перечислены структуры бифункциональных organocatalysts (С1-С6). Эта цифра показывает реакции с 1a (0.10 ммоль), 2а (0.12 ммоль) и катализатора (10 моль %) в растворителе (1 мл) при комнатной температуре для 8-72 ч. Подробное описание экспериментальных процедур см. протокол. Этот рисунок был изменен с Чэнь et al.18. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
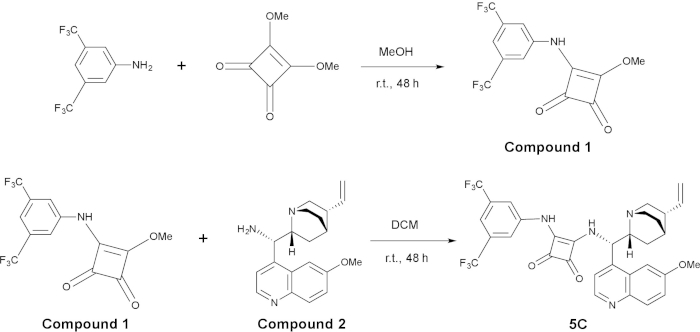
Рисунок 2: синтез organocatalyst 5C. Верхней панели – это синтез сложных 1, и нижней панели – это синтез 5 C из смеси 1 и составные 2. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
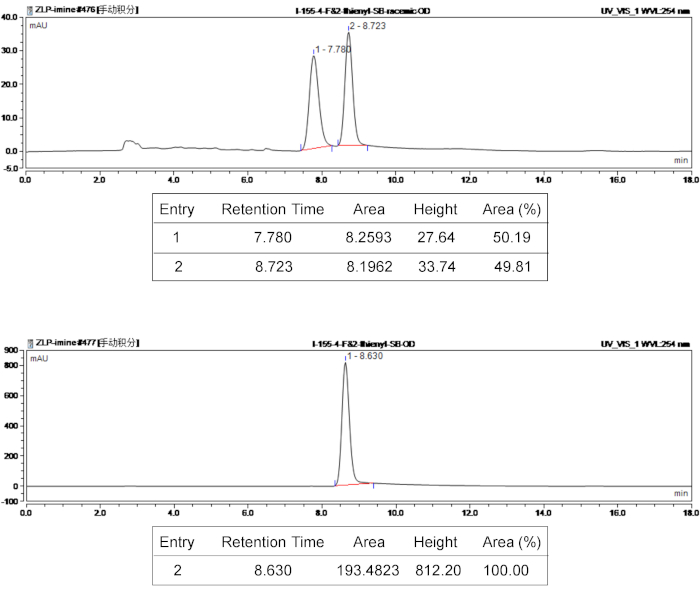
Рисунок 3: ВЭЖХ спектры рацемический и хиральная продукт 3e. Верхней панели ВЭЖХ спектр рацемического продукта 3e, и нижней панели ВЭЖХ спектр хиральная 3e. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 4: одиночн кристалл структура 3e. Левый структура структура одиночн кристалл 3e, и правильной структуры является 3e с стереохимия каждого атома надлежащего места для. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Успешной подготовке скелетов bispiro [гамма-бутиролактон пирролидин-4, 4'-пиразолон] зависит от ряда факторов.
Ключевым моментом этого процесса одношаговый циклоприсоединения асимметричным является synergistical активация α-arylidiene pyrazolinone 1a и 2a циклических имино Эстер на бифункциональных squaramide катализатора. Это достигается путем формирования нескольких межмолекулярных водородных связей между катализатора в качестве донора водорода Бонд и две реакции субстратов. Соответственно с большим их пространственной помех, C5, из всех Скрепление водопода доноров бифункциональных organocatalysts скрининг, выставлены лучшие стереоселективность. Отметить протокол использует 10 моль % катализатора в модель реакции. Кроме того требование о высокой растворимости субстратов и катализатора имеет важное значение. Как результат, использование Et2O как оптимального растворителя не только гарантирует, что субстратов и катализатор полностью растворяются при комнатной температуре, но что они проходят гладко циклоприсоединения с высокой урожайностью и stereoselectivities также. В частности воды в системе реакции приведет к плохой стереоселективность. Чтобы обеспечить успешный синтез, важно проверить сухости всех реагентов и растворителя перед началом реакции.
Циклоприсоединения совместим с широким разнообразием замещенных α-arylidiene pyrazolinone. В частности фторсодержащими заместителями с группой различных арил на α-arylidiene хорошо переносится. Снятие арил группы электрон, из-за их повышенной electrophilicity течение 1,3-дипольного циклоприсоединения, являются предпочтительными с точки зрения урожайности и стереоселективность. Кроме того, субстратов, например 3-позиции, заменены этил, децил, трет-бутила, бензил групп и 1-позиции, функционализированных различных электронных арил кольца, высокой переносимостью. Кроме того фторсодержащими заместителями циклических имино Эстер остаток на имино лактон с фенил, thiophenyl или naphthyl группы, также совместимы с реакции. Примечательно, что, для того чтобы обеспечить успешный реакции, требуется небольшой избыток имино лактон (1.2 эквивалентные). В большинстве случаев концентрации субстрата хранятся в 0,1-0,12 моль/Л масштаб в 1 мл растворителя. В зависимости от типов субстратов и катализаторов реакции циклоприсоединения одношаговый может занять 8-72 ч при комнатной температуре.
Стоит отметить, что этот циклоприсоединения обеспечивается высоким уровнем стереоселективность, когда R4 заместитель имино лактон 2 был thiolphenyl, 5-methylthiophenyl или 2-naphthyl группы. Однако когда заместитель4 R был заменен другими алкильных заместителей или гетероциклических фторсодержащими заместителями, низкий стереоселективность или низкий реакция урожайности было достигнуто.
В резюме представленные протокол позволяет прямой асимметричный строительство bispiro [гамма-бутиролактон пирролидин-4, 4'-пиразолон] с помощью эффективной одношаговый organocatalytic 1,3-дипольного циклоприсоединения реакции в отличные урожаи и высокий уровень стереоселективность. Кроме того эта новая методология совместим с двумя синтонов, учитывая разносторонний функциональных групп и быть полезными для синтеза различных терапевтических агентов с bispirocyclic леса.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Авторы не имеют ничего сообщать.
Acknowledgments
Авторы высоко ценим финансовую поддержку от Фонда национального естественных наук Китая (№ 21708051 до X.C.).
Materials
| Name | Company | Catalog Number | Comments |
| Acetonitrile, anhydrous, 99.9% | Innochem (China) | A0080 | |
| α-amino-γ-butyrolactone hydrobromide, 98% | Alfa Aesar | B23148 | |
| 3,5-bis(trifluoromethyl)aniline, 98+% | Adamas | 48611B | |
| Dichloromethane, 99.5% | Greagent | G81014H | |
| 3,4-dimethoxycyclobut-3-ene-1,2-dione, 98+% | Leyan (China) | 1062550 | |
| Ethanol, 99.5% | Greagent | G73537B | |
| Ethyl acetate, 99.5% | Greagent | G23272L | |
| Ethyl ether,anhydrous,99.5% | Greagent | G69159B | |
| Ethyl 3-oxobutanoate, 98% | TCI | A0649 | |
| 4-fluorobenzaldehyde, 98% | Innochem (China) | A24295 | |
| Glacial acetic acid, 99.5% | Greagent | G73562B | |
| Magnesium oxide, 99+% | Alfa Aesar | 44733 | |
| Magnesium sulfate, 98% | Greagent | G80872C | |
| Methanol, 99.5% | Greagent | G75851A | |
| Petroleum ether | Greagent | G84208D | |
| Phenylhydrazine, 98% | Innochem (China) | A57671 | |
| (S)-(6-methoxyquinolin-4-yl)((1S,2R,4S,5R)-5-vinylquinuclidin-2-yl)methanamine | DAICEL Group | 111240 | |
| Sodium sulfate,anhydrous,99% | Greagent | G82667A | |
| Thiophene-2-carbaldehyde, 98% | J & K scientific (China) | 124605 | |
| Triethylamine, 99% | J & k scientific (China) | 432915 |
References
- Rios, R. Enantioselective methodologies for the synthesis of spiro compounds. Chemical Society Reviews. 41 (3), 1060-1074 (2012).
- Khan, R. K., et al. Synthesis, isolation, characterization, and reactivity of high-energy stereogenic-at-Ru carbenes: stereochemical inversion through olefin metathesis and other pathways. Journal of the American Chemical Society. 134 (30), 12438-12441 (2012).
- Wang, X., Han, Z., Wang, Z., Ding, K. Catalytic asymmetric synthesis of aromatic spiroketals by spinphox/iridium(I)-catalyzed hydrogenation and spiroketalization of alpha,alpha'-bis(2-hydroxyarylidene) ketones. Angewandte Chemie International Edition. 51 (4), 936-940 (2012).
- Kim, N., Sohn, M. J., Koshino, H., Kim, E. H., Kim, W. G. Verrulactone C with an unprecedented dispiro skeleton, a new inhibitor of Staphylococcus aureus enoyl-ACP reductase, from Penicillium verruculosum F375. Bioorganic & Medicinal Chemistry Letters. 24 (1), 83-86 (2014).
- Mulholland, D. A., Schwikkard, S. L., Crouch, N. R. The chemistry and biological activity of the Hyacinthaceae. Natural Product Reports. 30 (9), 1165-1210 (2013).
- Tan, B., Hernandez-Torres, G., Barbas, C. F. Highly efficient hydrogen-bonding catalysis of the Diels-Alder reaction of 3-vinylindoles and methyleneindolinones provides carbazolespirooxindole skeletons. Journal of the American Chemical Society. 133 (32), 12354-12357 (2011).
- Cayuelas, A., et al. Enantioselective Synthesis of Polysubstituted Spiro-nitroprolinates Mediated by a (R,R)-Me-DuPhos.AgF-Catalyzed 1,3-Dipolar Cycloaddition. Organic Letters. 18 (12), 2926-2929 (2016).
- Lacharity, J. J., et al. Total Synthesis of Unsymmetrically Oxidized Nuphar Thioalkaloids via Copper-Catalyzed Thiolane Assembly. Journal of the American Chemical Society. 139 (38), 13272-13275 (2017).
- Liu, K., Teng, H. L., Yao, L., Tao, H. Y., Wang, C. J. Silver-catalyzed enantioselective desymmetrization: facile access to spirolactone-pyrrolidines containing a spiro quaternary stereogenic center. Organic Letters. 15 (9), 2250-2253 (2013).
- Zhu, G., et al. Asymmetric [3 + 2] Cycloaddition of 3-Amino Oxindole-Based Azomethine Ylides and alpha,beta-Enones with Divergent Diastereocontrol on the Spiro[pyrrolidine-oxindoles]. Organic Letters. 19 (7), 1862-1865 (2017).
- Sun, W., et al. Organocatalytic diastereo- and enantioselective 1,3-dipolar cycloaddition of azlactones and methyleneindolinones. Angewandte Chemie International Edition. 52 (33), 8633-8637 (2013).
- Grigg, R., Kilner, C., Sarker, M. A. B., Orgaz de la Cierva, C., Dondas, H. A. X=Y–ZH compounds as potential 1,3-dipoles. Part 64: Synthesis of highly substituted conformationally restricted and spiro nitropyrrolidines via Ag(I) catalysed azomethine ylide cycloadditions. Tetrahedron. 64 (37), 8974-8991 (2008).
- Liu, T. L., He, Z. L., Tao, H. Y., Wang, C. J. Stereoselective construction of spiro(butyrolactonepyrrolidines) by highly efficient copper(I)/TF-BiphamPhos-catalyzed asymmetric 1,3-dipolar cycloaddition. Chemistry. 18 (26), 8042-8046 (2012).
- Wang, L., Shi, X. M., Dong, W. P., Zhu, L. P., Wang, R. Efficient construction of highly functionalized spiro[gamma-butyrolactone-pyrrolidin-3,3'-oxindole] tricyclic skeletons via an organocatalytic 1,3-dipolar cycloaddition. Chemical Communications. 49 (33), 3458-3460 (2013).
- Yetra, S. R., Mondal, S., Mukherjee, S., Gonnade, R. G., Biju, A. T. Enantioselective Synthesis of Spirocyclohexadienones by NHC-Catalyzed Formal [3+3] Annulation Reaction of Enals. Angewandte Chemie International Edition. 55 (1), 268-272 (2016).
- Liu, J. Y., Zhao, J., Zhang, J. L., Xu, P. F. Quaternary Carbon Center Forming Formal [3 + 3] Cycloaddition Reaction via Bifunctional Catalysis: Asymmetric Synthesis of Spirocyclohexene Pyrazolones. Organic Letters. 19 (7), 1846-1849 (2017).
- Mondal, S., Mukherjee, S., Yetra, S. R., Gonnade, R. G., Biju, A. T. Organocatalytic Enantioselective Vinylogous Michael-Aldol Cascade for the Synthesis of Spirocyclic Compounds. Organic Letters. 19 (16), 4367-4370 (2017).
- Chen, N., et al. Asymmetric Synthesis of Bispiro[γ-butyrolactone-pyrrolidin-4,4'-pyrazolone] Scaffolds Containing Two Quaternary Spirocenters via an Organocatalytic 1,3-Dipolar Cycloaddition. European Journal of Organic Chemistry. 2018 (23), 2939-2943 (2018).
- Yang, W., Du, D. M. Highly enantioselective Michael addition of nitroalkanes to chalcones using chiral squaramides as hydrogen bonding organocatalysts. Organic Letters. 12 (23), 5450-5453 (2010).



