Summary
Мы представляем протокол для эффективной оценки перфузии аневризмы и патологии паряточной аневризмы у крыс и кроликов, используя флуоресцентную видео-ангиографию на основе флуоресценции (FVA). При положительной прогностической стоимости 92,6%, это простой, но очень эффективный и экономичный метод без специального оборудования требуется.
Abstract
Лечение аневризмы мозга фокусируется на достижении полной окклюзии, а также на сохранении кровотока в родительской артерии. Флуоресцеин натрия и индоцианина зеленый используются для наблюдения кровотока и перфузии состояния сосудов, соответственно. Цель этого исследования заключается в применении FVA для проверки в режиме реального времени кровотока, состояния перфузии сосудов и окклюзии аневризм после индукции аневризм боковины у кроликов и крыс, а также для проверки процедуры у этих видов.
Двадцать боковые аневризмы были созданы в 10 кроликов путем зашвуя decellularized артериального сосуда мешок на сонную артерию донора кролика. Кроме того, 48 микрохирургических аневризм боковины были созданы у 48 крыс. Во время последующего наблюдения в течение одного месяца после создания, родительская артерия / аневризма комплекс был расчленен и FVA была выполнена с использованием внутривенного флуоресцеина (10%, 1 мл) инъекции через катетеризацию вен уха у кроликов и феморальной вены кашеризации у крыс. Затем были собраны аневризмы, а просачивание оценивалось макроскопически.
Макроскопически, 14 из 16 аневризм у кроликов указали отсутствие остаточной перфузии родительской артерии с полностью окклюзией светилами, однако 11 (79%) были обнаружены FVA. Четыре аневризмы были исключены из-за технических проблем. У крыс остаточная перфузия аневризмы наблюдалась в 25 из 48 случаев. Из 23 без макроскопических доказательств перфузии, FVA подтвердил заболеваемость 22 аневризмы (96%). Не было никаких побочных явлений, связанных с FVA. Флуоресцеин легко применим и не требуется специальное оборудование. Это безопасный и чрезвычайно эффективный метод для оценки целостности родительской артерии и аневризмы, прощупающей/остаточной перфузии в экспериментальной обстановке с кроликами и крысами. FVA использование флуоресцеина в качестве контрастного агента, как представляется, эффективны в контроле проходимости аневризм и основного сосуда и даже может быть адаптирована для шунтирования.
Introduction
Доказательства полной облестья аневризмы и целостности родительской артерии имеет первостепенное значение в хирургии аневризмы. Существует несколько вариантов подтверждения патологии родительской артерии и окклюзии аневризмы, таких как доплеровская сонография, обычная церебральная ангиография (DSA), компьютерная томография (КТА) или магнитно-резонансная ангиография (MRA)1, 2. Однако, это дорогостоящие и трудоемкие методы, которые часто не доступны в лабораторных условиях. Кроме того, они могут иметь соответствующие побочные эффекты, такие как облучение или необходимость дополнительного седации экспериментальных животных, чтобы избежать движения артефакта.
С появлением все большего числа новых эндоваскулярных устройств существует последовательная потребность в доклинических испытаниях таких устройств. Однако эти исследования часто опираются на посмертный анализ (например, макропатологию и гистологию) и не имеют информации о динамической перфузии. Кроме того, для исследователя может быть крайне важно получить немедленную и достоверную информацию во время экспериментальной хирургической процедуры. Фюрересценция ангиография является экономически эффективными простым в выполнении техники визуализации 1,3,4.
Таким образом, индоцианин зеленый (ICG) видео ангиография часто используется в клинических нейрохирургических процедур и широко изучены5,6. Флуоресценовая видеоангиография (FVA) является альтернативной техникой, с дополнительным преимуществом создания флуоресценции сигнал, который находится в диапазоне длины волны человеческого зрения, и, таким образом, может быть видно невооруженным глазом без расширенного спектра инфракрасной камеры 7. Флуоресцеин видео ангиография реже используется в клинической цереброваскулярной хирургии и отчеты о FVA в экспериментальных условиях не хватает1,4.
Целью настоящего доклада является демонстрация осуществимости и масштабов применения FVA в крысиных и кроликов доклинических цереброваскулярных исследований.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Грызуны были размещены в учреждении по уходу за животными, и эксперименты были рассмотрены и одобрены Комитетом по защите животных в Бернском университете, Швейцария (BE 108/16) и (BE65/16). Все животные содержались на стандартной лабораторной диете с бесплатным доступом к пище и воде. Все эксперименты на животных проводились при тщательном рассмотрении 3Rs (замена, сокращение и уточнение). Десять женщин Новой Зеландии Белые кролики и 48 мужчин Wistar крыс были включены. ПРАВИЛО руководящие принципы были соблюдены строго8.
ПРИМЕЧАНИЕ: Двадцать боковины аневризмы были созданы в 10 кроликов путем зашвуения decellularized артериального сосуда мешок на сонную артерию донора кролика. Кроме того, 48 микрохирургических аневризм боковины были созданы в 48 крыс, как описано до4,9. Процедура визуализации и макроскопический анализ были проведены через 4 недели после создания аневризмы.
1. Подготовка материала, необходимого для флуоресцеина видео ангиографии
- Измените фонарик, закрепив на синем фильтре bandpass (см. таблицуматериалов), который будет функционировать как фильтр возбуждения. Факел должен затем излучать только синий свет. Используйте черную ленту, чтобы избежать утечки нефильтрованного света.
- Оборудуйте камеру (например, прикрепленную к микроскопу) зеленым фильтром полос (см. таблицуматериалов), который будет функционировать как световой фильтр. Только зеленый свет должен теперь быть в состоянии пройти.
2. Подготовка рабочих мест и материалов
- Дезинфицировать рабочее пространство дезинфицирующим раствором.
- Накройте стол стерильными шторами, чтобы предотвратить загрязнение.
- Используйте стерильные инструменты для операции.
3. Подготовка животных к операции
- Взвесьте животных.
- Индуцируйте анестезию и регулируйте дозу в зависимости от веса.
- Для кроликов,начать сбалансированную анестезию. Защитите глаза одной рукой во время инъекции, чтобы уменьшить их реакцию испуга. Обложка клетки с листом, чтобы помочь усыпить животных.
- Анестезируйтесь крыс в газовой камере с 4% изофруран и 96% кислорода до инъекции.
- Мониторинг глубины анестезии. Pinch между пальцами ног, чтобы убедиться, что животные спят.
- Переложить кроликов на спину. Они не должны реагировать.
- Для крыс, ущипнуть их хвосты и убедитесь, что никакой реакции наблюдается.
- Нанесите мазь на глаза грызунов, чтобы предотвратить сухость. Вытащите языки крыс, чтобы избежать каких-либо шансов на глотание.
- Начните с сохранения анестезии.
- Для кроликов, катетеризм (22 G экранированный IV катетер с портвейном впрыска, см. Таблицаматериалов) вену уха. Поддерживать сбалансированную анестезию. Используйте трехсторонний стоп-ход, чтобы включить несколько одновременных инъекций.
- Для крыс, вводят 50 мг/кг гидрохлорида кетамина и 0,5 мг/кг гидрохлорида гидрохлорида интраперитоне. Мониторинг анестезии с вредным ног щепотку во время операции. В случае реакции вводят дополнительную анестезию.
- Лента животных на доске в положении на спине и тщательно бритьразрез месте. Дезинфицировать область бетасептиком.
- Для кроликов,дезинфицировать шею, особенно вокруг стерноклейдомастоидной мышцы.
- Для крыс, дезинфицировать области от мочевого пузыря до трансверс толстой кишки.
- Администрирование кислорода через маску на протяжении всей операции и поддерживать температуру тела с нагревательной кошкой.
4. Подготовка артерии
- Для достижения наилучших результатов тщательно вскрытьвыбранный сосуд из окружающей ткани 9,10.
- Для крыс, определить хвоствены (менее инвазивных, предпочтительно используется для выживших животных) или вскрыть бедренную вену для флуоресцеина инъекции4,11.
ПРИМЕЧАНИЕ: Для кроликов,никаких дальнейших вскрытия сосудов не требуется для флуоресцеина инъекции, как ухо вены уже используется для анестезии.
- Для крыс, определить хвоствены (менее инвазивных, предпочтительно используется для выживших животных) или вскрыть бедренную вену для флуоресцеина инъекции4,11.
- Расположите белую подушечку под выбранным сосудом, чтобы увеличить контраст с окружающими тканями.
- Сосредоточьте камеру, установленную на микроскоп, на расчлененных артериях.
5. Флуоресцеин видео ангиография
- Обложка 5 мл шприц заполнены флуоресцеина натрия (100 мг /мл, см. Таблица материалов) с алюминиевой фольгой для защиты от воздействия света. Выключите свет (как можно больше) и введите флуоресцеин натрия внутривенно. Вводят в темноте, чтобы предотвратить фотоотбеление.
- Для кроликов,вводят 0,3 мл/кг флуоресцеина натрия через трехсторонний стопкок в катетеризированную вену уха.
- Для крыс, вводят 0,4 мл/кг флуоресцеина натрия в бедренную вену через катетер или 25 G иглы.
- Промыть иглу или катетер с 0,5 мл соленового раствора, чтобы убедиться, что все красители вводят.
- Осветите хирургическое поле с помощью модифицированного фонарика.
- Начало съемок с измененной камерой. Поток крови должен быть виден через несколько секунд после инъекции(рисунок 1).
ПРИМЕЧАНИЕ: Здесь мы использовали частоту кадров 50 кадров/с, фокусное расстояние 70 мм и F3.4.
6. Макроскопический анализ
- Resect аневризмы и родительских артерий комплекса, и оценить пакурсность макроскопически, открыв родительскую артерию с микро-ножницами и оценить просвет родительской артерии и отверстия анерисма (см. Рисунок 1, 2)9. Измерьте размеры аневризм. Аневризма-родитель-артери-комплекс может храниться для дальнейшего анализа (например, гистология).
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Во время операции наблюдалось частота сердечных приступов и артериального давления. Средняя частота сердечных приступов составляла 193/мин у кроликов и 196/мин у крыс. Вес тела кроликов варьировался 3,05-4,18 кг, а крысы весили 335-690 г.
Мы смогли выполнить FVA в восемь из десяти кроликов(рисунок 1). Четыре аневризмы экзаменов в двух кроликов не были записаны с камерой из-за технических трудностей. О каких-либо технических трудностях, связанных с FVA у крыс, не сообщалось. Тем не менее, FVA не может быть выполнена в одной крысы из-за трудностей прокалывание бедренной вены.
Из 16 аневризм у восьми кроликов две аневризмы показали стойкую перфузию родительской артерии (подтвержденная макроскопически) (см. таблицу1), в то время как FVA определила пять случаев с остаточной перфузией. 14 аневризмы кролика показали отсутствие остаточной перфузии макроскопически, однако 11 (79%) были впоследствии обнаружены с помощью FVA. Остаточная перфузия наблюдалась макроскопически у 25 из 48 крыс(таблица1), а остальные 23 крысы не показали макроскопических признаков остаточной перфузии (Рисунок 2). 22 из этих 23 аневризм были затем подтверждены с помощью FVA (96%). В общей сложности можно было бы подтвердить 25 из 27 случаев заболевания, что привело к положительному прогнозному значению 92,6%, чувствительности 100% и специфичности 94,1%. (Таблица 2).
Таким образом, 25 аневризмы показали остаточной перфузии, 53 родительских артерий были патенты и 11 были occluded как подтвердил макроскопически и на видео ангиографии. Были только незначительные усложнения связанные с FVA в кроликах; например, перфорация маргинальной вены уха во время катетеризации. Других неблагоприятных событий не наблюдалось. О каких-либо случаях смерти и заболеваемости в связи с ФВА не сообщалось.
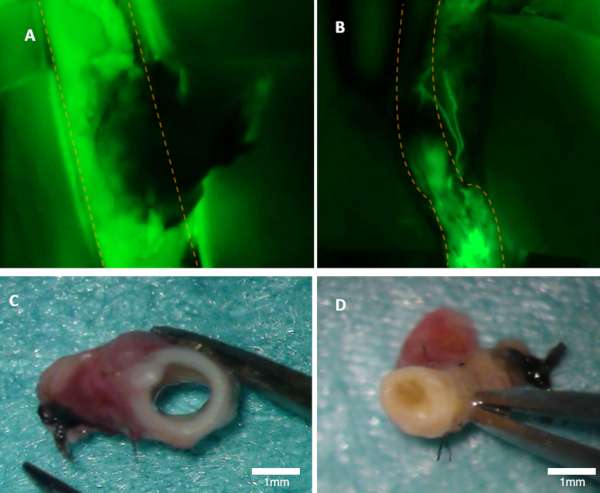
Рисунок 1 : Визуализация просачивания у кролика. (A) Патентность родительской артерии хорошо видна на флуоресценции изображение (зеленый выброс от флуоресцеина видны). (B) Эта артерия окклюзионная (флуоресценция изображение). Обе артерии были проверены макроскопически(C-D). Панель(C) показывает в артерии от панели A; просвет открыт. Панель(D) показывает артерию от панели B где occlusion можно увидеть макроскопически. Оранжевые пунктирные линии обозначают границы родительской артерии. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 2 : Визуализация перфузии у крысы. (A) Эта панель показывает остаточную пронизаемную аневризму (красная пунктирная линия отмечает остаточную перфузию). (B) Нет перфузии может быть обнаружена. Панель(C) показывает артерию от панели A во время макроскопического рассмотрения; аневризма может быть открыта. (D) Макроскопический вид неоинтима на окклюзионной аневризмы. Оранжевые пунктирные линии отмечают родительскую артерию и купол аневризмы. Панели (A) и (B) являются флуоресценции только изображения и зеленый цвет показывает флуоресцеин выбросов. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
| Патентия/остаточная перфузия | ||||
| Макроскопический (масокопический) | Макроскопический - | Флуоресцейна | Флуоресцейн - | |
| Кроликов | 2 | 14 Год | 5 | 11 Год |
| Крыс | 23 | 25 | 22 Г. | 21 год |
| Общая | 25 | 39 | 27 | 32 год |
Таблица 1: Тестирование на патентии. Патентность родительской артерии была протестирована только у кроликов и проиллюстрирована здесь. Флуоресцеин обнаружил больше патенций родительских артерий, чем макроскопическая оценка. (Все крысы в этой обстановке имели открытую родительскую артерию, так как аневризмы зашивались на брюшной аорте.) Протагонисма аневризмы тестировалась только у крыс. Двадцать два из 23 макроскопически обнаруженных патенций были подтверждены с помощью FVA. Двадцать один из 25 не показал никакой просажение на FVA.
| Макроскопический позитив | Макроскопический негатив | Общая | |
| Флуоресцеин положительный | 25 | 2 | 27 |
| Флуоресцеин отрицательный | 0.00 | 32 год | 32 год |
| Общая | 25 | 34 |
Таблица 2: Таблица «два на два», используемая для расчета специфичности и чувствительности FVA.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
FVA является перспективным и незамысловатым методом изучения судов у грызунов и может выполняться с помощью коммерческих устройств и готового оборудования. FVA может быть реализована во время любой операции, где внутриоперационная оценка целостности сосуда необходима, так как сосуды нуждаются в надлежащем вскрытии в первую очередь.
Авторы предпочли венозной инъекции для артериальной инъекции из-за более низкого риска случайных событий, таких как инфекция, ишемия и синдром отсека12. Внутривенная инъекция позволяет надежной, пространственно ограниченной, высококонцентрированной окрашивания, и требует небольших доз красителя13,14. Кроме того, венозная инъекция позволяет быстро раскидыхать флуоресцеин14,15. Альтернативный метод заключается в том, чтобы вводить контрастный агент непосредственно в выбранную артерию. Этот метод не был использован в этих экспериментах, как исследователи хотели, чтобы предотвратить загрязнение хирургического поля с кровью и флуоресценгом. Для того, чтобы уменьшить этот риск, периферийный венозный контрастный агент инъекции рекомендуется13.
Преимущества FVA являются высокий контраст (легко обнаруживаемый с человеческим глазом), высокая чувствительность, как показано выше(Таблица 2), низкая стоимость и легкая обработка16. Флуоресцеин натрий был выбранным контрастным агентом для изучения перфузии. Видимый свет только может быть использован для возбуждения красителя и излучения типичного зеленого света. Тем не менее, этот контрастный агент лучше всего работает с синим светом (примерно 480 нм) и излучает сильный зеленый свет (длина волны около 530 нм)15. Согласно Yoshioka et al., флуоресцеин красит артерию очень быстро14. Кроме того, поток флуоресцеина обогащенной крови можно наблюдать в режиме реального времени15,17. Короткое время, необходимое для FVA представляет собой еще одно преимущество; в этой серии потребовалось в среднем 2 мин (1 мин) для проведения одного FVA.
Недостатком использования флуоресцеина в качестве контрастного агента является то, что он хорошо работает только с тонкими стенками артерий, которые требуют очень тщательного вскрытия. Ichikawa et al. показали вымирание красителя из-за сорванного излучения света через более толстые стенки путем кальцификации или неразделимых артерий15. После инъекции флуоресцеин метаболизируется в флуоресцентный флуоресцентный глюкуронид в печени. В течение 30 минут после инъекции концентрация флюоресцеина глюкуронид превышает концентрацию флуоресцеина18. Флуоресцейн требует длительного времени оформления. Немедленная повторная инъекция после внутривенной инъекции флуоресцеина не рекомендуется, так как артерия и аневризма уже флуоресцентны с первой инъекции17.
Молекулярный вес флуоресцеина составляет всего 376 кДа, что позволяет протекать красителя. Сосудистая стенка также становится флуоресцентной, что может привести к ложноположительной оценке потока (увеличение со временем после нанесения). Пятнистое окраска стенки сосуда наблюдалась начиная примерно с 5 мин после инъекции флуоресцеина14. Пятнистое окраска, однако, наблюдалось только в больших артериях. Малые и средние артерии не показали эту структуру окрашивания17. Рекомендуется немедленно оценить аневризму, чтобы обнаружить остаточную начинку.
Хотя существует очень низкий риск токсичности, некоторые случаи флуоресцеина, приводящего к сердечной и дыхательной реакции были описаны14. В этом исследовании не произошло никаких серьезных побочных явлений; единственными осложнениями были 2 случая перфорации уха. По Лейн и др., флуоресцеин натрия не является вредным даже при использовании в организме человека17. С другой стороны, флуоресцеин является довольно нестабильным и не должны подвергаться воздействию белого света16 - красный источник света может быть использован вместо.
Для того, чтобы выбрать концентрацию флуоресцеина для кроликов, исследователи начали с самой низкой известной рабочей дозы у крыс (0,2 мл 100 мг/мл флюоресцеина натрия) и увеличили его постепенно до 1 мл. В этой дозе был зарегистрирован сильный флуоресценционный сигнал. Дозировка была увеличена постепенно, чтобы проверить, если флуоресценция улучшается - что не так. Авторы решили продолжить с 1 мл 100 мг /мл флюоресцейна натрия13.
Еще один краситель для изучения сосудов интраоперации является ICG. Его размер составляет 775 кДа и такие едва проникает в окружающие ткани14. Из-за своей более длинной длины волны выбросов, ткани проникают легче, потому что ткани являются более прозрачными на 800 нм19 и более глубокие структуры становятся видимыми14,16. Длина волны в пределах 750-800 нм требуется16,20 идлина волны выбросов от контрастного агента составляет около 800 нм16, что делает оба невидимыми для человеческого глаза. Из-за своего короткого период полураспада в плазме крови, краситель можно вводить и повторно использовать неоднократно16. Ограничения на использование этого красителя включают проблемы с толстыми стенками артерий20 и необходимость света за пределами видимого спектра13. Как следствие, МКГр зависит от дорогостоящего оборудования и не всегда применима в каждой лаборатории.
В заключение, FVA является быстрым, недорогим и надежным методом с высокой чувствительностью к экрану, проясняемую аневризмы и родительские артерии в моделях аневризмы грызунов. Это связано практически с отсутствием заболеваемости и смертности. Это позволяет в режиме реального времени мониторинг кровотока во время операции и последующей деятельности. Чтобы повысить его эффективность, инъекция должна проводиться в темное время суток и лучше всего выполняться на тщательно расчлененных сосудах. Этот метод может легко и безопасно быть реализован в цереброваскулярной лаборатории, и может свести к минимуму затраты на эксперимент.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Все авторы не подтверждают никакого конфликта интересов.
Acknowledgments
Это исследование было частично поддержано исследовательским грантом от Kantonsspital Aarau, Швейцария.
Materials
| Name | Company | Catalog Number | Comments |
| For rabbits | |||
| Aluminium foil | |||
| Animal shaver | |||
| Black tape | |||
| Blue filter | Thorlabs MF475-35 | ||
| Body warm plate | |||
| Camera | Sony NEX-5R | ||
| Catheter | 22G Vasofix Safety | ||
| Disinfictant | |||
| Fluorescein sodium | Fluorescein Faure 10% | ||
| Glas plate | |||
| Green filter | Thorlabs MF539-43 | ||
| Incontinence pad | |||
| Infusion pump | Perfusor Secura | ||
| Ketamine hydrochloride | any generic products | ||
| Needle | 25G | ||
| Oxygen | |||
| Ringer's Solution | |||
| Sterile sheets | |||
| Surgical instruments | micro forceps, micro scissor, blunt surgical scissor | ||
| Surgical microscope | OPMI, Carl Zeiss AG, Oberkochen, Germany | ||
| Syringe 2ml, 5ml, 50ml | |||
| Tape | |||
| Three-way-stopcock | |||
| Torch light | |||
| Xylazin | any generic products | ||
| For rats | |||
| Aluminium foil | |||
| Animal shaver | |||
| Black tape | |||
| Blue filter | Thorlabs MF475-35 | ||
| Body warm plate | |||
| Camera | Sony NEX-5R | ||
| Disinfictant | |||
| Fluorescein sodium | Fluorescein Faure 10% | ||
| Green filter | Thorlabs MF539-43 | ||
| Incontinence pad | |||
| Isoflurane | |||
| Ketamine hydrochloride | any generic products | ||
| Medetomidine hydrochloride | any generic products | ||
| Needle | 25G | ||
| Oxygen | |||
| Plate | |||
| Ringer's Solution | |||
| Sterile sheets | |||
| Surgical instruments | micro forceps, micro scissor, blunt surgical scissor | ||
| Surgical microscope | OPMI, Carl Zeiss AG, Oberkochen, Germany | ||
| Syringe 2ml, 5ml | |||
| Tape | |||
| Torch light |
References
- Kakucs, C., Florian, I. A., Ungureanu, G., Florian, I. S. Fluorescein Angiography in Intracranial Aneurysm Surgery: A Helpful Method to Evaluate the Security of Clipping and Observe Blood Flow. World Neurosurgery. 105, 406-411 (2017).
- Ajiboye, N., Chalouhi, N., Starke, R. M., Zanaty, M., Bell, R. Unruptured Cerebral Aneurysms: Evaluation and Management. ScientificWorldJournal. 2015, 954954 (2015).
- Suzuki, K., et al. Confirmation of blood flow in perforating arteries using fluorescein cerebral angiography during aneurysm surgery. Journal of Neurosurgery. 107 (1), 68-73 (2007).
- Gruter, B. E., et al. Fluorescence Video Angiography for Evaluation of Dynamic Perfusion Status in an Aneurysm Preclinical Experimental Setting. Operative Neurosurgery. , Hagerstown. (2019).
- Raabe, A., et al. Prospective evaluation of surgical microscope-integrated intraoperative near-infrared indocyanine green videoangiography during aneurysm surgery. Journal of Neurosurgery. 103 (6), 982-989 (2005).
- Riva, M., Amin-Hanjani, S., Giussani, C., De Witte, O., Bruneau, M. Indocyanine Green Videoangiography in Aneurysm Surgery: Systematic Review and Meta-Analysis. Neurosurgery. , (2017).
- Kuroda, K., et al. Intra-arterial injection fluorescein videoangiography in aneurysm surgery. Neurosurgery. 72, 2 Suppl Operative 141-150 (2013).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving Bioscience Research Reporting: The ARRIVE Guidelines for Reporting Animal Research. PLOS Biology. 8 (6), 1000412 (2010).
- Marbacher, S., et al. The Helsinki rat microsurgical sidewall aneurysm model. Journal of Visualized Experiments. (92), e51071 (2014).
- Marbacher, S., et al. Complex bilobular, bisaccular, and broad-neck microsurgical aneurysm formation in the rabbit bifurcation model for the study of upcoming endovascular techniques. American Journal of Neuroradiology. 32 (4), 772-777 (2011).
- Shurey, S., et al. The rat model in microsurgery education: classical exercises and new horizons. Archives of Plastic Surgery. 41 (3), 201-208 (2014).
- Foster, S. D., Lyons, M. S., Runyan, C. M., Otten, E. J. A mimic of soft tissue infection: intra-arterial injection drug use producing hand swelling and digital ischemia. World Journal of Emergency Medicine. 6 (3), 233-236 (2015).
- Flower, R. W. Injection technique for indocyanine green and sodium fluorescein dye angiography of the eye. Investigative Ophthalmology & Visual Science. 12 (12), 881-895 (1973).
- Yoshioka, H., et al. Advantage of microscope integrated for both indocyanine green and fluorescein videoangiography on aneurysmal surgery: case report. Neurologia medico-chirurgica (Tokyo). 54 (3), 192-195 (2014).
- Ichikawa, T., et al. Development of and Clinical Experience with a Simple Device for Performing Intraoperative Fluorescein Fluorescence Cerebral Angiography: Technical Notes. Neurologia medico-chirurgica. 56 (3), 141-149 (2016).
- Alander, J. T., et al. A review of indocyanine green fluorescent imaging in surgery. International Journal of Biomedical Imaging. 2012, 940585 (2012).
- Lane, B., Bohnstedt, B. N., Cohen-Gadol, A. A. A prospective comparative study of microscope-integrated intraoperative fluorescein and indocyanine videoangiography for clip ligation of complex cerebral aneurysms. Journal of Neurosurgery. 122 (3), 618-626 (2015).
- Blair, N. P., Evans, M. A., Lesar, T. S., Zeimer, R. C. Fluorescein and fluorescein glucuronide pharmacokinetics after intravenous injection. Investigative Ophthalmology & Visual Science. 27 (7), 1107-1114 (1986).
- Hillmann, D., et al. In vivo optical imaging of physiological responses to photostimulation in human photoreceptors. Proceedings of the National Academy of Sciences of the United States of America. 113 (46), 13138-13143 (2016).
- Golby, A. J. Image-Guided Neurosurgery. , Elsevier Science. (2015).



