Summary
Nós apresentamos um protocolo para avaliar eficientemente a perfusão do aneurysm e a permeabilidade da embarcação do aneurysm do Sidewall nos ratos e nos coelhos, usando a angiografia Video Fluorescein-baseada da fluorescência (FVA). Com um valor preditivo positivo de 92,6%, é um método simples, mas muito eficaz e econômico, sem necessidade de equipamentos especiais.
Abstract
O tratamento do aneurisma cerebral concentra-se em alcançar a oclusão completa, bem como preservar o fluxo sanguíneo na artéria mãe. O sódio da fluoresceína e o verde do do indocyanine são usados para permitir a observação do estado da circulação sanguínea e da perfusão da embarcação, respectivamente. O objetivo deste estudo é aplicar a FVA para verificar o fluxo sanguíneo em tempo real, o estado de perfusão dos vasos e a oclusão de aneurismas após a indução de aneurismas laterais em coelhos e ratos, bem como validar o procedimento nessas espécies.
Vinte aneurismas do Sidewall foram criados em 10 coelhos suturando uma bolsa arterial descelularizados da embarcação na artéria carotídea de um coelho fornecedor. Além disso, 48 aneurismas de parede lateral microcirúrgica foram criados em 48 ratos. Durante o seguimento em um mês após a criação, o complexo de artéria/aneurisma dos pais foi dissecado e a FVA foi realizada por meio de uma injeção intravenosa de fluoresceina (10%, 1 mL) por meio de cateterismo da veia orelha em coelhos e uma catherização da veia femoral em ratos. Os aneurismas foram então colhidos, e a patência foi avaliada macroscopicamente.
Macroscopicamente, 14 dos 16 aneurismas em coelhos não indicaram perfusão residual da artéria parental com luminae totalmente oclusada, porém 11 (79%) foram detectados pelo FVA. Quatro aneurismas foram excluídos devido a problemas técnicos. Em ratos, a perfusão de aneurisma residual foi observada macroscopicamente em 25 dos 48 casos. Dos 23 sem evidência macroscópica de perfusão, a FVA confirmou a incidência de 22 aneurismas (96%). Não houve eventos adversos associados à FVA. A fluoresceina é facilmente aplicável e nenhum equipamento especial é necessário. É um método seguro e extremamente efetivo para avaliar a integridade da artéria parental e a permeabilidade do aneurisma/perfusão residual em um ambiente experimental com coelhos e ratos. FVA usando fluoresceina como um agente de contraste parece ser eficaz no controle da permeabilidade dos aneurismas e do vaso subjacente e pode até mesmo ser adaptado para a cirurgia de bypass.
Introduction
A evidência do obliteração completo do aneurysm e da integridade da artéria do pai é da importância máxima na cirurgia do aneurysm. Existem várias opções para confirmar a permeabilidade da artéria parental e a oclusão do aneurisma, como a ultrassonografia Doppler, a angiografia cerebral convencional (DSA), a angiografia por tomografia computadorizada (CTA) ou a angiografia por ressonância magnética (ARM)1, 2. no entanto, estes são métodos caros e demorados, que muitas vezes não estão disponíveis em um ambiente de laboratório. Além disso, podem ter efeitos secundários relevantes, tais como a exposição à radiação ou a necessidade de sedação adicional de animais experimentais para evitar artefactos de movimento.
Com um número crescente de novos dispositivos endovasculares emergentes, há uma necessidade consecutiva de testes pré-clínicos de tais dispositivos. No entanto, esses estudos muitas vezes dependem de análise post-mortem (por exemplo, macro patologia e histologia) e falta de informações sobre a perfusão dinâmica. Além disso, para o pesquisador pode ser crucial obter informações imediatas e confiáveis durante um procedimento cirúrgico experimental. A angiografia por fluorescência é um custo-eficaz e fácil de executar a técnica de visualização1,3,4.
Como tal, a angiografia video do verde do do indocyanine (ICG) é usada frequentemente em procedimentos Neurosurgical clínicos e extensivamente foi estudada5,6. A angiografia video da Fluorescein (FVA) é uma técnica alternativa, com a vantagem adicional de criar um sinal da fluorescência que esteja dentro da escala do comprimento de onda da visão humana, e possa assim ser visto pelo olho despido sem uma câmera infravermelha prolongada do espectro 7. a angiografia video da Fluorescein é usada menos frequentemente na cirurgia cerebrovascular clínica e os relatórios em FVA em ajustes experimentais são escassos1,4.
O objetivo deste relato é demonstrar a viabilidade e o escopo das aplicações de FVA na pesquisa cerebrovascular pré-clínica de ratos e coelhos.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Os roedores foram alojados em uma instalação do cuidado animal e os experimentos foram revistos e aprovados pelo Comitê para o bem-estar animal na Universidade de Berna, Switzerland (seja 108/16) e (BE65/16). Todos os animais foram mantidos em uma dieta de laboratório padrão com acesso livre à comida e água. Todos os experimentos com animais foram conduzidos cuidadosa consideração dos 3Rs (reposição, redução e refinamento). Dez coelhos fêmeas da Nova Zelândia branca e 48 ratos Wistar machos foram incluídos. As directrizes da chegada foram seguidas estritamente8.
Nota: vinte aneurismas laterais foram criados em 10 coelhos, suturando uma bolsa de vasos arteriais decelularizada na artéria carótida de um coelho doador. Além disso, 48 aneurismas microcirúrgicos de parede lateral foram criados em 48 ratos, conforme descrito antes de4,9. O procedimento de imagem e a análise macroscópica foram realizados 4 semanas após a criação do aneurisma.
1. preparação do material necessário para a angiografia video da fluoresceína
- Modifique a lanterna gravando em um filtro de bandpass azul (veja a tabela de materiais), que funcionará como um filtro de excitação. A tocha deve então emitir somente a luz azul. Use fita preta para evitar qualquer vazamento de luz não filtrada.
- Equipar a câmera (por exemplo, anexada ao microscópio) com um filtro de passe verde (veja a tabela de materiais), que funcionará como um filtro de luz de emissão. Apenas a luz verde deve agora ser capaz de passar.
2. preparação do local de trabalho e dos materiais
- Desinfetante o espaço de trabalho com solução desinfetante.
- Cubra a mesa com cortinas estéreis para evitar a contaminação.
- Use instrumentos estéreis para a cirurgia.
3. preparação de animais para a cirurgia
- Pese os animais.
- Induzir anestesia e ajustar a dose de acordo com o peso.
- Para coelhos, iniciar a anestesia equilibrada. Proteja seus olhos com uma mão durante a injeção para reduzir sua reação do susto. Cubra a gaiola com uma folha para ajudar a sedar os animais.
- Anestesie ratos em uma câmara de gás com isoflurano 4% e 96% de oxigênio antes da injeção.
- Monitore a profundidade da anestesia. Aperte entre os dedos dos pés para se certificar de que os animais estão dormindo.
- Reposicione os coelhos nas costas. Eles não devem reagir.
- Para ratos, aperte suas caudas e certifique-se de que nenhuma reação é observada.
- Aplique pomada nos olhos dos roedores para evitar a secura. Retire as línguas dos ratos para evitar qualquer chance de engolir.
- Comece com a preservação do anaesthesia.
- Para coelhos, cateterismo (cateter IV blindado de 22 G com porta de injecção, ver a tabela de materiais) a veia da orelha. Manter a anestesia equilibrada. Use um torneira de três vias para permitir múltiplas injeções simultâneas.
- Para ratos, injete 50 mg/kg de cloridrato de cetamina e 0,5 mg/kg de cloridrato de medetomidina intraperitonealmente. Monitore a anestesia com uma pitada nocivas do dedo do pé durante a cirurgia. No caso de reação, administrar anestesia adicional.
- Tape os animais para a placa em uma posição supina e raspar de perto o local da incisão. Desinfete a área com Betasséptica.
- Para coelhos, desinfecte o pescoço, especialmente em torno do músculo esternocleidomastoide.
- Para ratos, desinfete a área da bexiga para transversos cólon.
- Administrar o oxigênio através de uma máscara durante toda a cirurgia e manter a temperatura do corpo com uma almofada de aquecimento.
4. preparação da artéria
- Para melhores resultados, dissecar completamente a embarcação escolhida do tecido circunvizinho9,10.
- Para ratos, identificar a veia cauda (menos invasiva, preferencialmente usada para animais sobreviventes) ou dissecar uma veia femoral para a injeção de fluoresceina4,11.
Nota: para coelhos, não é necessária qualquer dissecção adicional de vasos para a injeção de fluoresceina, pois a veia da orelha já está sendo usada para anestesia.
- Para ratos, identificar a veia cauda (menos invasiva, preferencialmente usada para animais sobreviventes) ou dissecar uma veia femoral para a injeção de fluoresceina4,11.
- Posicione uma almofada branca a embarcação escolhida para aumentar o contraste com o tecido circundante.
- Concentre a câmera montada no microscópio da artéria dissecada.
5. Fluorescein angiografia vídeo
- Cubra a seringa de 5 mL preenchida com fluoresceina sódica (100 mg/mL, ver a tabela de materiais) com folha de alumínio para proteger da exposição de luz. Desligue as luzes (tanto quanto possível) e injete sódio fluoresceína intravenosamente. Injete a escuridão para evitar o fotobranqueamento.
- Para coelhos, injete 0,3 ml/kg de fluoresceina sódica através da torneira de três vias na veia da orelha cateterizada.
- Para ratos, injete 0,4 ml/kg de fluoresceina sódica na veia femoral através de um cateter ou de uma agulha de 25 G.
- Lave a agulha ou o cateter com 0,5 mL de solução salina para garantir que todos os corantes sejam injetados.
- Ilumine o campo cirúrgico com a lanterna modificada.
- Comece a filmar com a câmera modificada. O fluxo sanguíneo deve ser visível alguns segundos após a injeção (Figura 1).
Nota: aqui, usamos a taxa de quadros = 50 frames/s, distância focal = 70 mm, e F 3.4.
6. análise macroscópica
- Ressecar os aneurismas e o complexo arterial dos pais e avaliar a patência macroscópica abrindo a artéria mãe com Microtesoura e avaliar o lúmen da artéria mãe e o orifício do anerysm (ver Figura 1,2)9. Meça os tamanhos dos aneurismas. O aneurysm-pai-artéria-complexo pode então ser armazenado para uma análise mais adicional (por exemplo, histologia).
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
A frequência cardíaca e a pressão arterial foram monitoradas durante a cirurgia. A frequência cardíaca média foi de 193/min em coelhos e 196/min em ratos. O peso corporal dos coelhos variou de 3,05 a 40, 5kg, e os ratos pesaram 335-690 g.
Pudemos realizar FVA em oito dos dez coelhos (Figura 1). Quatro examinações do aneurysm em dois coelhos não foram gravadas com a câmera devido às dificuldades técnicas. Não foram relatadas dificuldades técnicas envolvendo FVA em ratos. Entretanto, o FVA não pôde ser executado em um rato devido às dificuldades que puncionam a veia femoral.
Dos 16 aneurismas em oito coelhos, dois aneurismas mostraram perfusão persistente da artéria mãe (confirmada macroscopicamente) (ver tabela 1), enquanto a FVA identificou cinco casos com perfusão residual. 14 aneurismas de coelhos não mostraram perfusão residual macroscópica, porém 11 (79%) foram detectados subseqüentemente usando o FVA. A perfusão residual foi observada macroscopicamente em 25 dos 48 ratos (tabela 1), e os outros 23 ratos não apresentaram sinais macroscópicos de perfusão residual (Figura 2). 22 desses 23 aneurismas foram então confirmados com FVA (96%). Ao todo, 25 dos 27 casos puderam ser confirmados, resultando em um valor preditivo positivo de 92,6%, uma taxa de sensibilidade de 100% e especificidade de 94,1%. (Tabela 2).
Em síntese, 25 aneurismas mostraram perfusão residual, 53 artérias-mãe foram patentes e 11 foram fechadas como confirmadas macroscopicamente e em vídeo-angiografia. Houve apenas pequenas complicações associadas à FVA em coelhos; como a perfuração da veia marginal da orelha durante o cateterismo. Não foram experimentados mais acontecimentos adversos. Nenhuma mortalidade e nenhuma morbosidade devido a FVA foram relatadas.
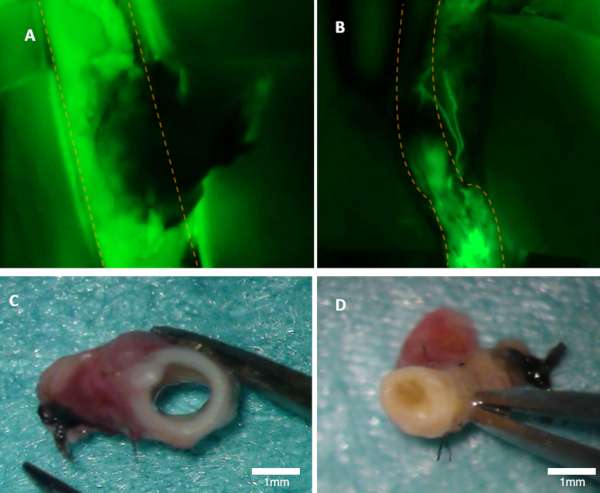
Figura 1 : Visualizando o patência em um coelho. (A) a patência da artéria parental é claramente visível na imagem de fluorescência (a emissão verde da fluoresceina é observada). (B) esta artéria é oclusada (imagem de fluorescência). Ambas as artérias foram inspecionadas macroscopicamente (C-D). Painel (C) mostra na artéria do painel a; o lúmen está aberto. O painel (D) mostra a artéria do painel B onde a oclusão pode ser vista macroscopicamente. As linhas pontilhadas alaranjadas marcam as beiras da artéria do pai. Por favor clique aqui para ver uma versão maior desta figura.

Figura 2 : Visualizando a perfusão em um rato. (A) este painel mostra um aneurisma perfusionado residual (a linha pontilhada vermelha marca a perfusões residuais). (B) não pode ser detectada perfusão. O painel (C) mostra a artéria do painel a durante o escrutínio macroscópico; o orifício do aneurisma está aberto. (D) visão macroscópica da neoíntima em aneurisma oclusado. As linhas pontilhadas alaranjadas marcam a artéria do pai e a abóbada do aneurysm. Os painéis (A) e (B) são imagens somente fluorescência e a cor verde mostra a emissão de fluoresceina. Por favor clique aqui para ver uma versão maior desta figura.
| Patency/perfusão residual | ||||
| Macroscópica + | Morfodiagnoses | Fluorescein + | Fluoresceína | |
| Coelhos | 2 | 14 | 5 | 11 |
| Ratos | 23 | 25 | 22 | 21 |
| Total | 25 | 39 | 27 | 32 |
Tabela 1: teste de patência. O patency da artéria do pai foi testado somente nos coelhos e é ilustrado aqui. A fluoresceina detectou mais patências das artérias progenitores do que a avaliação macroscópica. (Todos os ratos neste ajuste tiveram uma artéria aberta do pai, porque os aneurismas foram suturados na aorta abdominal.) A patência dos aneurismas foi testada apenas em ratos. Vinte e dois de 23 patências macroscopicamente detectadas foram confirmadas com FVA. Vinte e um de 25 não mostraram nenhuma patência em FVA.
| Positivo macroscópico | Negativo macroscópico | Total | |
| Fluorescein positivo | 25 | 2 | 27 |
| Fluoresceina negativa | 0 | 32 | 32 |
| Total | 25 | 34 |
Tabela 2: tabela dois-por-dois usada para calcular a especificidade e a sensibilidade de FVA.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
O FVA é um método promissor e não complicado para examinar vasos em roedores e pode ser realizado com dispositivos comerciais e equipamentos de prateleira. FVA pode ser executado durante toda a cirurgia onde a avaliação intraoperativa da integridade da embarcação é necessária enquanto os vasos precisam a dissecção apropriada primeiramente.
Os autores preferiram a injeção venosa à injeção arterial devido ao risco mais baixo de eventos inadvertidos tais como a infecção, a isquemia e a síndrome do compartimento12. A injeção intravenosa permite a coloração confiável, espacialmente limitada, altamente concentrada, e requer pequenas dosagens de corante13,14. Adicionalmente, a injeção venosa permite uma rápida depuração da fluoresceina14,15. Um método alternativo é injetar o agente de contraste diretamente na artéria escolhida. Este método não foi utilizado nestes experimentos, pois os investigadores queriam evitar contaminar o campo cirúrgico com sangue e fluoresceina. A fim de reduzir esse risco, recomenda-se a injeção de agente de contraste venoso periférico13.
Vantagens do FVA são de alto contraste (facilmente detectável com o olho humano), alta sensibilidade como mostrado acima (tabela 2), baixo custo e fácil manuseio16. A fluoresceina sódica foi o agente de contraste escolhido para examinar a perfusão. A luz visível sozinho pode ser usada para a excitação do corante e a emissão da luz verde típica. No entanto, este agente de contraste funciona melhor com luz azul (aproximadamente 480 nm) e emite uma luz verde forte (comprimento de onda aproximadamente 530 nm)15. De acordo com Yoshioka et al., a fluoresceina colore a artéria extremamente rapidamente14. Além disso, o fluxo de sangue enriquecido com fluoresceina pode ser observado em tempo real15,17. O curto período de tempo necessário para a FVA apresenta outra vantagem; nesta série demorou uma média de 2 min (± 1min) para conduzir um FVA.
A desvantagem de usar o fluoresceína como um agente do contraste é que trabalha bem com somente as paredes finas da artéria que exigem a dissecção muito cuidadosa. Ichikawa et al. mostraram a extinção da tintura devido à emissão de luz frustrada através de paredes mais grossas por calcificação ou artérias não dissecadas15. Após a injecção, a fluoresceina é metabolizada para a fluoresceina fluorescente glucuronida no fígado. Dentro de 30 minutos após a injeção, a concentração de fluoresceina glucuronida excede a concentração de fluoresceina18. A fluoresceina requer um longo tempo de folga. Uma reinjecção imediata após a injeção intravenosa da fluoresceina não é recomendada porque a artéria e o aneurysm são já fluorescentes da primeira injeção17.
O peso molecular da fluoresceina é apenas 376 kDa que permite o vazamento do corante. A parede vascular também se torna fluorescente que pode levar a avaliações de fluxo falso positivo (aumentando com o tempo após a aplicação). Uma coloração desigual da parede da embarcação foi observada que começa aproximadamente 5 minutos após a injeção da fluoresceína14. A coloração manchada, entretanto, foi observada somente em artérias maiores. As artérias pequenas e médias não mostraram esta estrutura de coloração17. Recomenda-se avaliar imediatamente o aneurysm a fim detectar o enchimento residual.
Embora haja um risco muito baixo de toxicidade, alguns casos da fluoresceína que conduzem às reações cardíacas e respiratórias foram descritos14. Neste estudo nenhum evento adverso severo ocorreu; as únicas complicações eram 2 casos da perfuração da veia da orelha. De acordo com Lane et al., a fluoresceina sódica não é prejudicial mesmo quando utilizada em humanos17. Por outro lado, a fluoresceina é bastante instável e não deve ser exposta à luz branca16 -uma fonte de luz vermelha pode ser usada em seu lugar.
A fim de escolher a concentração de fluoresceina para coelhos, os investigadores iniciaram com a dose de trabalho mais baixa conhecida em ratos (0,2 mL de 100 mg/mL de fluoresceina sódica) e aumentaram gradualmente para 1 mL. Um sinal forte da fluorescência foi registado nessa dose. A dosagem foi aumentada gradualmente para testar se a fluorescência melhora-que não era o caso. Os autores decidiram continuar com 1 mL de 100 mg/mL de fluoresceina sódica13.
Um outro corante disponível para examinar as embarcações intraoperatively é ICG. Seu tamanho é 775 kDa e tal mal penetra os tecidos circunvizinhos14. Por causa de seus comprimentos de onda mais longos da emissão, o tecido é penetrado mais fàcilmente porque os tecidos são mais transparentes em 800 nanômetro19 e as estruturas mais profundas tornam-se visíveis14,16. O comprimento de onda da excitação dentro do 750-800 nanômetro é exigido16,20 e o comprimento de onda da emissão do agente do contraste é aproximadamente 800 nanômetro16, fazendo ambos invisível ao olho humano. Devido ao seu curto tempo de meia-vida no plasma sanguíneo, o corante pode ser injetado e reutilizado repetidamente16. Limitações ao uso deste corante incluem problemas com artérias de paredes grossas20 e a necessidade de luz fora do espectro visível13. Como consequência, o ICG é dependente de equipamentos caros e não é prontamente aplicável em todos os laboratórios.
Em conclusão, o FVA é um método rápido, barato e de confiança com sensibilidade elevada à permeabilidade da tela dos aneurismas e das artérias do pai em modelos do aneurysm do roedor. Está associado virtualmente a nenhuma morbosidade e mortalidade. Permite a monitoração em tempo real do fluxo sanguíneo durante a cirurgia e a continuação. Para melhorar a sua eficácia, a injeção deve ser realizada no escuro e é melhor realizada em vasos meticulosamente dissecados. Este método pode facilmente e com segurança ser executado em um laboratório cerebrovascular, e pode minimizar custos da experimentação.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Todos os autores não confirmam conflitos de interesse.
Acknowledgments
Este estudo foi apoiado em parte por uma subvenção de pesquisa da Kantonsspital Aarau, Suíça.
Materials
| Name | Company | Catalog Number | Comments |
| For rabbits | |||
| Aluminium foil | |||
| Animal shaver | |||
| Black tape | |||
| Blue filter | Thorlabs MF475-35 | ||
| Body warm plate | |||
| Camera | Sony NEX-5R | ||
| Catheter | 22G Vasofix Safety | ||
| Disinfictant | |||
| Fluorescein sodium | Fluorescein Faure 10% | ||
| Glas plate | |||
| Green filter | Thorlabs MF539-43 | ||
| Incontinence pad | |||
| Infusion pump | Perfusor Secura | ||
| Ketamine hydrochloride | any generic products | ||
| Needle | 25G | ||
| Oxygen | |||
| Ringer's Solution | |||
| Sterile sheets | |||
| Surgical instruments | micro forceps, micro scissor, blunt surgical scissor | ||
| Surgical microscope | OPMI, Carl Zeiss AG, Oberkochen, Germany | ||
| Syringe 2ml, 5ml, 50ml | |||
| Tape | |||
| Three-way-stopcock | |||
| Torch light | |||
| Xylazin | any generic products | ||
| For rats | |||
| Aluminium foil | |||
| Animal shaver | |||
| Black tape | |||
| Blue filter | Thorlabs MF475-35 | ||
| Body warm plate | |||
| Camera | Sony NEX-5R | ||
| Disinfictant | |||
| Fluorescein sodium | Fluorescein Faure 10% | ||
| Green filter | Thorlabs MF539-43 | ||
| Incontinence pad | |||
| Isoflurane | |||
| Ketamine hydrochloride | any generic products | ||
| Medetomidine hydrochloride | any generic products | ||
| Needle | 25G | ||
| Oxygen | |||
| Plate | |||
| Ringer's Solution | |||
| Sterile sheets | |||
| Surgical instruments | micro forceps, micro scissor, blunt surgical scissor | ||
| Surgical microscope | OPMI, Carl Zeiss AG, Oberkochen, Germany | ||
| Syringe 2ml, 5ml | |||
| Tape | |||
| Torch light |
References
- Kakucs, C., Florian, I. A., Ungureanu, G., Florian, I. S. Fluorescein Angiography in Intracranial Aneurysm Surgery: A Helpful Method to Evaluate the Security of Clipping and Observe Blood Flow. World Neurosurgery. 105, 406-411 (2017).
- Ajiboye, N., Chalouhi, N., Starke, R. M., Zanaty, M., Bell, R. Unruptured Cerebral Aneurysms: Evaluation and Management. ScientificWorldJournal. 2015, 954954 (2015).
- Suzuki, K., et al. Confirmation of blood flow in perforating arteries using fluorescein cerebral angiography during aneurysm surgery. Journal of Neurosurgery. 107 (1), 68-73 (2007).
- Gruter, B. E., et al. Fluorescence Video Angiography for Evaluation of Dynamic Perfusion Status in an Aneurysm Preclinical Experimental Setting. Operative Neurosurgery. , Hagerstown. (2019).
- Raabe, A., et al. Prospective evaluation of surgical microscope-integrated intraoperative near-infrared indocyanine green videoangiography during aneurysm surgery. Journal of Neurosurgery. 103 (6), 982-989 (2005).
- Riva, M., Amin-Hanjani, S., Giussani, C., De Witte, O., Bruneau, M. Indocyanine Green Videoangiography in Aneurysm Surgery: Systematic Review and Meta-Analysis. Neurosurgery. , (2017).
- Kuroda, K., et al. Intra-arterial injection fluorescein videoangiography in aneurysm surgery. Neurosurgery. 72, 2 Suppl Operative 141-150 (2013).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving Bioscience Research Reporting: The ARRIVE Guidelines for Reporting Animal Research. PLOS Biology. 8 (6), 1000412 (2010).
- Marbacher, S., et al. The Helsinki rat microsurgical sidewall aneurysm model. Journal of Visualized Experiments. (92), e51071 (2014).
- Marbacher, S., et al. Complex bilobular, bisaccular, and broad-neck microsurgical aneurysm formation in the rabbit bifurcation model for the study of upcoming endovascular techniques. American Journal of Neuroradiology. 32 (4), 772-777 (2011).
- Shurey, S., et al. The rat model in microsurgery education: classical exercises and new horizons. Archives of Plastic Surgery. 41 (3), 201-208 (2014).
- Foster, S. D., Lyons, M. S., Runyan, C. M., Otten, E. J. A mimic of soft tissue infection: intra-arterial injection drug use producing hand swelling and digital ischemia. World Journal of Emergency Medicine. 6 (3), 233-236 (2015).
- Flower, R. W. Injection technique for indocyanine green and sodium fluorescein dye angiography of the eye. Investigative Ophthalmology & Visual Science. 12 (12), 881-895 (1973).
- Yoshioka, H., et al. Advantage of microscope integrated for both indocyanine green and fluorescein videoangiography on aneurysmal surgery: case report. Neurologia medico-chirurgica (Tokyo). 54 (3), 192-195 (2014).
- Ichikawa, T., et al. Development of and Clinical Experience with a Simple Device for Performing Intraoperative Fluorescein Fluorescence Cerebral Angiography: Technical Notes. Neurologia medico-chirurgica. 56 (3), 141-149 (2016).
- Alander, J. T., et al. A review of indocyanine green fluorescent imaging in surgery. International Journal of Biomedical Imaging. 2012, 940585 (2012).
- Lane, B., Bohnstedt, B. N., Cohen-Gadol, A. A. A prospective comparative study of microscope-integrated intraoperative fluorescein and indocyanine videoangiography for clip ligation of complex cerebral aneurysms. Journal of Neurosurgery. 122 (3), 618-626 (2015).
- Blair, N. P., Evans, M. A., Lesar, T. S., Zeimer, R. C. Fluorescein and fluorescein glucuronide pharmacokinetics after intravenous injection. Investigative Ophthalmology & Visual Science. 27 (7), 1107-1114 (1986).
- Hillmann, D., et al. In vivo optical imaging of physiological responses to photostimulation in human photoreceptors. Proceedings of the National Academy of Sciences of the United States of America. 113 (46), 13138-13143 (2016).
- Golby, A. J. Image-Guided Neurosurgery. , Elsevier Science. (2015).



