Summary
אנו מציגים פרוטוקול כדי להעריך ביעילות את הפרזיה ומפרצת של כלי הקיבול של מפרצת sidewall בחולדות וארנבים, באמצעות fluorescein מבוססי וידאו אנגיוגרפיה וידיאו (FVA). עם ערך ניבוי חיובי של 92.6%, היא שיטה פשוטה אך יעילה מאוד וחסכונית ללא ציוד מיוחד נדרש.
Abstract
טיפול במפרצת במוח מתמקד בהשגת חסימה מלאה, כמו גם שימור זרימת הדם בעורק האב. Fluorescein נתרן ו indocyanine ירוק משמשים כדי לאפשר התבוננות של זרימת הדם ואת מצב זלוף הספינה, בהתאמה. מטרת מחקר זה היא להחיל FVA כדי לוודא זרימת הדם בזמן אמת, מעמד של הספינה וחסימה של האניוסיאמים לאחר האינדוקציה של מחלת העור הצדדית בארנבים וחולדות, כמו גם כדי לאמת את ההליך במינים אלה.
עשרים מילישניות שנוצרו ב -10 ארנבים על ידי הdecellularized נרתיק של כלי קיבול עורקי בעורק הראשי של ארנב תורם. בנוסף, 48 שנוצרו בשנת 48 חולדות. במהלך המעקב בחודש אחד לאחר היצירה, מורכב העורק הראשי/מפרצת היה גזור FVA התבצע באמצעות פלואורוסקופים ורידי (10%, 1 מ ל) הזרקה באמצעות צנתור וריד האוזן בארנבים והעורק הירך ורידים בחולדות. לאחר מכן, היתה הערכה לאחר מכן.
מאקרו, 14 מתוך 16 היורו בארנבים הצביעו על כך שאין שרידים של עורק הורים עם מנורות שאינן מסומנות באופן מוחלט, עם זאת 11 (79%) זוהו על ידי FVA. ארבעה מופרצות לא נכללו עקב בעיות טכניות. בחולדות, הפרזיה שיורית מפרצת הייתה. מאקרופית ב -25 מתוך 48 מקרים מתוך 23 ללא ראיות מאקרוסקופיות של הפרזיה, FVA אישר את השכיחות של 22 היורו (96%). לא היו אירועים לוואי הקשורים FVA. Fluorescein ישימה בקלות, אין צורך בציוד מיוחד. זוהי שיטה בטוחה ויעילה ביותר להערכת שלמות עורק העורקים ומפרצת/שיורית בהגדרה ניסיונית עם ארנבים וחולדות. FVA באמצעות fluorescein כסוכן ניגודיות מופיע להיות יעיל בשליטה על הפטנטיות של אניומיאמים ואת הספינה הבסיסית והוא יכול אפילו להיות מותאם לעקוף את הניתוח.
Introduction
ושלמות עורק ההורה היא. בעלת חשיבות עליונה בניתוח מפרצת קיימות מספר אפשרויות לאישור הדלקת עורקים של עורק ומפרצת, כגון סונגרפיה דופלר, אנגיוגרפיה מוחית (DSA), מחשב טומוגרפיה ממוחשבת (CTA) או אנגיוגרפיה מגנטית (MRA)1, 2. עם זאת, אלו שיטות יקרות וגוזלת זמן שלעיתים קרובות אינן זמינות בסביבה מעבדה. יתר על כן, הם עשויים להיות תופעות לוואי רלוונטיות כגון חשיפה לקרינה או צורך הרגעה נוספת של בעלי חיים ניסיוניים כדי למנוע פריט התנועה.
עם מספר גדל והולך של מכשירים אנדוכלי חדש המתעוררים, יש צורך עוקב עבור בדיקות טרום קליני של מכשירים כאלה. עם זאת, מחקרים אלה מסתמכים לעתים קרובות על ניתוח שלאחר המוות (למשל, פתולוגיה מאקרו והיסטולוגיה) וחוסר מידע על perfusion דינמי. יתרה מזאת, עבור החוקר הוא עשוי להיות חיוני כדי לקבל מידע מיידי ואמין במהלך הליך כירורגי ניסיוני. אנגיוגרפיה פלואורסצנטית היא חסכונית וקל לבצע ויזואליזציה טכניקה1,3,4.
ככזה, indocyanine ירוק (icg) וידאו אנגיוגרפיה משמש לעתים קרובות בהליכים נוירוכירורגית קלינית והוא למד בהרחבה5,6. Fluorescein וידאו אנגיוגרפיה (FVA) היא טכניקה חלופית, עם יתרון נוסף של יצירת אות פלואורסצנטית כי הוא בטווח אורך הגל של החזון האנושי, ולכן ניתן לראות על ידי העין בלתי ללא מצלמה מורחבת הספקטרום אינפרא אדום 7. fluorescein וידאו אנגיוגרפיה משמש פחות לעתים קרובות בניתוח קליני ודוחות על fva בהגדרות ניסיוני נדירים1,4.
מטרת דו ח זה היא להדגים את הכדאיות ואת היקף היישומים של FVA ב החולדה והארנב מחקר הפרה-קלינית מראש.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
המכרסמים שוכנו במתקן לטיפול בבעלי חיים ובניסויים נבדקו ואושרו על-ידי הוועדה לרווחת בעלי חיים באוניברסיטת ברן, שוויץ (להיות 108/16) ו (BE65/16). כל החיות שמרו על דיאטת מעבדה סטנדרטית עם גישה חופשית למזון ולמים. כל הניסויים בבעלי חיים נערכו תחת שיקול קפדני של 3Rs (החלפה, הפחתה ועידון). עשר נשים שפנים לבנות ניו זילנד ו-48 זכר וויסטאר חולדות נכללו. ההנחיות להגיע הגיעו רק8.
הערה: עשרים מילישניות שנוצרו ב -10 ארנבים על ידי הdecellularized נרתיק של כלי קיבול עורקי בעורק הראשי של ארנב תורם. בנוסף, 48 מיקרוניתוחי מיקרו-כירורגי הינם נוצרים ב-48 חולדות כמתואר לפני4,9. הליך הדמיה וניתוח מאקרוסקופי בוצעו 4 שבועות לאחר יצירת מפרצת.
1. הכנת החומר הדרוש לפלואורוסקופים וידאו אנגיוגרפיה
- שינוי הפנס באמצעות הקלטה על פילטר כחול (ראה טבלת חומרים), שישמש כמסנן עירור. הלפיד צריך לפלוט רק אור כחול. השתמש בקלטת שחורה כדי למנוע דליפה של אור לא מסונן.
- לצייד את המצלמה (למשל, מצורף למיקרוסקופ) עם מסנן bandpass ירוק (לראות את הטבלה של חומרים), אשר ישמש כמסנן אור פליטה. רק אור ירוק צריך עכשיו. להיות מסוגל לעבור
2. הכנת מקום העבודה והחומרים
- לחטא את סביבת העבודה עם פתרון חיטוי.
- לכסות את השולחן עם וילונות סטרילי כדי למנוע זיהום.
- השתמש בכלים סטריליים לניתוח.
3. הכנת בעלי חיים לניתוח
- . שוקלים את החיות
- לגרום הרדמה ולהתאים את המינון על פי המשקל.
- לארנבים, התחילו בהרדמה מאוזנת. מגנים את עיניהם ביד אחת במהלך ההזרקה כדי להפחית את תגובת הפחד שלהם. כסו את הכלוב בסדין. שיעזור להרגיע את החיות
- עם 4 % מ96. וחמצן לפני הזריקה
- . פקח על עומק ההרדמה צבוט בין הבהונות שלהם. כדי לוודא שהחיות ישנות
- מיקום הארנבים על גבם. . הם לא צריכים להגיב
- עבור חולדות, לצבוט זנבות שלהם ולהבטיח כי שום תגובה לא נצפתה.
- החלת משחה על העיניים של המכרסמים כדי למנוע יובש. להוציא את לשונות חולדות כדי למנוע כל סיכוי לבלוע.
- . תתחיל בשימור ההרדמה
- עבור ארנבים, צנתור (22 גרם מסוכך על קטטר הרביעי עם יציאת הזרקה, לראות את הטבלה של חומרים) וריד האוזן. שמור על הרדמה מאוזנת. השתמש בעצירת שלושה כיוון כדי לאפשר זריקות בו מרובות.
- עבור חולדות, הכנס 50 mg/ק"ג הידרוכלוריד ו 0.5 מ"ג/ק"ג medetomidine intraperitoneally הידרוכלוריד. הצג הרדמה עם הבוהן צביטה רעילים במהלך הניתוח. במקרה של תגובה, לנהל הרדמה נוספת.
- הקלטת את החיות על הלוח במצב פרקדן ולגלח היטב את מיקום החתך. לחטא את האזור באמצעות ב, באמצעות באמצעות באמצעות.
- לארנבים, לחטא את הצוואר, במיוחד סביב שריר השריר.
- עבור חולדות, לחטא את האזור משלפוחית השתן כדי transvers המעי הגס.
- מנהל חמצן באמצעות מסכה לאורך הניתוח ולשמור על טמפרטורת הגוף עם כרית חימום.
4. הכנת העורק
- לקבלת התוצאות הטובות ביותר, לנתח ביסודיות את הספינה הנבחרת מן הרקמה שמסביב9,10.
- עבור חולדות, לזהות את הווריד הזנב (פחות פולשנית, רצוי בשימוש עבור בעלי חיים ששרדו) או לנתח וריד הירך עבור fluorescein הזרקת4,11.
הערה: לארנבים, אין צורך בניתוח נוסף של כלי קיבול להזרקה בזמן שווריד האוזן משמש כבר להרדמה.
- עבור חולדות, לזהות את הווריד הזנב (פחות פולשנית, רצוי בשימוש עבור בעלי חיים ששרדו) או לנתח וריד הירך עבור fluorescein הזרקת4,11.
- הצב משטח לבן תחת הספינה שנבחרה כדי להגביר את הניגודיות עם הרקמה הסובבת.
- למקד את המצלמה רכוב למיקרוסקופ על העורק.
5. פלואור וידאו-אנגיוגרפיה
- לכסות את 5 מזרק mL מלא fluorescein נתרן (100 mg/mL, לראות את הטבלה של חומרים) עם רדיד אלומיניום כדי להגן מפני חשיפה של אור. כבו את האורות (ככל האפשר) והזרק fluorescein נתרן באופן מידי. להזריק תחת החושך כדי למנוע הלבנת.
- לארנבים, הכנס 0.3 mL/ק ג פלואורואסעין נתרן דרך הזין שלושה כיוון לתוך הווריד האוזן הצנתור.
- עבור חולדות, להזריק 0.4 mL/ק"ג fluorescein נתרן לתוך וריד הירך באמצעות קטטר או 25 גרם מחט.
- ריקון המחט או קטטר עם 0.5 mL תמיסת מלח כדי להבטיח כי כל הצבע מוזרק.
- יאיר את השדה הכירורגי עם הפנס שהשתנה.
- . התחל לצלם עם המצלמה המתוקנת זרימת הדם אמורה להיות גלויה כמה שניות לאחר ההזרקה (איור 1).
הערה: כאן, השתמשנו שיעור מסגרת = 50 מסגרות/s, אורך מוקד = 70 מ"מ, ו-F 3.4.
6. ניתוח מקרוסקופי
- לכרות את מתחם העורק הראשי והאב, ולהעריך את הפתסיתיים על ידי פתיחת עורק האב עם מיקרו-מספריים ולהעריך את לומן העורק הראשי ואת הנחיר של אנאריזם (ראה איור 1, 2)9. למדוד את גודל המיפרצות. מפרצת-אב-עורק-מורכב לאחר מכן ניתן לאחסן לניתוח נוסף (למשל, היסטולוגיה).
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
קצב הלב ולחץ הדם. היו מנוטרים במהלך הניתוח שיעור לב מרושע היה 193/דקות בארנבים ו-196/מינימום בחולדות. משקל הגוף של הארנבים נעו 3.05-4.18 ק ג, והעכברושים שקלו 335-690 g.
הצלחנו לבצע את FVA בשמונה מתוך עשרה ארנבים (איור 1). ארבעה בדיקות מפרצת בשני ארנבים לא נרשמו עם המצלמה עקב קשיים טכניים. אין בעיות טכניות הקשורות FVA בחולדות דווחו. עם זאת, לא ניתן לבצע את FVA בחולדה אחת בשל קשיים העלולים להיכנס לווריד הירך.
מתוך 16 מנות בשמונה ארנבים, שתי מנות נוספות הראו שילוב מתמשך של עורק ההורה (ראה טבלה 1) ואילו fva זיהה חמישה מקרים עם פרזיה שיורית. 14 הארנב מראה לא שאריות מאקרופי, עם זאת 11 (79%) זוהו לאחר מכן באמצעות FVA. פרזיה שיורית נצפתה באופן מאקרואני ב -25 של 48 עכברושים (שולחן 1), ו -23 העכברושים האחרים לא הראו סימנים מאקרוסקופיים של פרזיה שיורית (איור 2). 22 מתוך 23 היורו הללו אושרו לאחר מכן באמצעות FVA (96%). בסך הכל, 25 מתוך 27 מקרים יכול להיות מאושר, וכתוצאה מכך ערך ניבוי חיובי של 92.6%, שיעור רגישות של 100% וספציפיות של 94.1%. (שולחן 2).
לסיכום, 25 מילישניות הראו perfusion שיורית, 53 עורקים ההורה היו פטנט ו -11 היו שנפגעו כאשר אישר מאקרופי ועל אנגיוגרפיה וידאו. היו רק סיבוכים קטנים הקשורים FVA בארנבים; כגון ניקוב וריד אוזן שולי במהלך הצנתור. אין עוד אירועים לוואי שהיו מנוסים. אין תמותה ולא התחלואה עקב FVA דווחה.
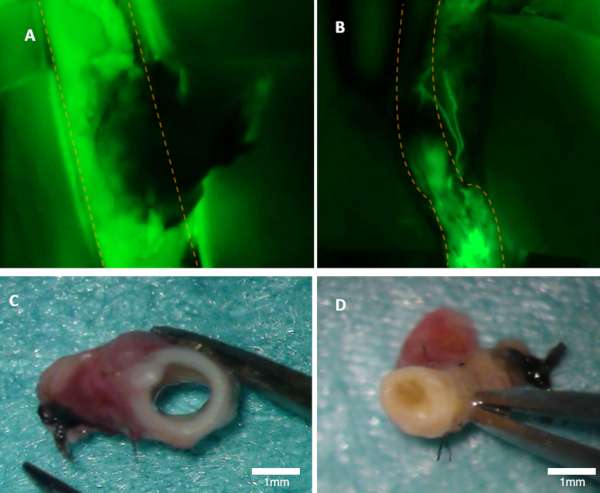
איור 1 : מדמיין התמדה בארנב. (א) הפנסיה של עורק ההורה נראה בבירור על התמונה הפלואורסצנטית (פליטת ירוק מ fluorescein נראים). (ב) עורק זה מחולק (תמונה פלואורסצנטית). שני העורקים נבדקו באופן מאקרואני (C-D). פאנל (ג) מראה בעורק מלוח A; לומן פתוח. פאנל (ד) מראה עורק מלוח B בו ניתן לראות את החסימה באופן מאקרואני. קווים מנוקדים כתומים מציינים את גבולות עורק האב. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 2 : לדמיין את הפרזיה בחולדה. (א) לוח זה מראה מפרצת מתחת לשקעים (קו מנוקד אדום מסמן את הפרזיה השיורית). (ב) לא ניתן לזהות את הפרפיוז. פאנל (ג) מראה את העורק מלוח A במהלך בדיקה מקרוסקופית; פתח המפרצת פתוח (ד) מאקרוסקופי לראות את הנאובימה על מפרצת מאוטם. קווים מנוקדים כתומים מסמנים את עורק האב ואת כיפת המפרצת. פאנלים (A) ו-(ב) הם תמונות של הזריחה בלבד והצבע הירוק מראה פליטת fluorescein. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
| פטנסיה/פרזיה שיורית | ||||
| מאקרו + | מאקרו- | Fluorescein + | פלואורוסקופים | |
| ארנבים | 2 | 14 | מיכל 5 | 11 |
| חולדות | 23 | 25 | 22 | 21 |
| כולל | 25 | 39 | 27 | 32 |
. שולחן 1: בדיקת פטנסי הפנסיה של עורק ההורה נבדקה רק בארנבים ומומחש כאן. Fluorescein זיהה יותר השהיות של עורקים ההורה מאשר הערכה macroscopical (לכל העכברושים בסביבה זו היה עורק אב פתוח, כאשר מפרצות היו מסולצות על אבי העורקים הבטני.) . נבדק בחולדות בלבד עשרים ושתיים מתוך 23 השהיות מקרופיפיתיים אושרו באמצעות FVA. עשרים ואחת מתוך 25 לא הראו. שום התמדה ברדיו
| מקרוסקופי חיובי | מקרוסקופי שלילי | כולל | |
| פלואורואסעין חיובי | 25 | 2 | 27 |
| פלואור שלילי | 0 | 32 | 32 |
| כולל | 25 | 34 |
שולחן 2: טבלה המשמשת לחישוב ספציפיות ורגישות של FVA.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
FVA היא שיטה מבטיחה מסובכת כדי לבחון את כלי מכרסמים ניתן לבצע עם מכשירים מסחריים וציוד מחוץ למדף. FVA יכול להיות מיושם במהלך כל ניתוח שבו הערכה תוך-אופרטיבית של שלמות כלי נדרש כמו כלי צריך הניתוח המתאים הראשון.
מחברים הזרקת ורידים העדיפו הזרקה העורקים עקב הסיכון הנמוך של אירועים באופן בכיוון כגון זיהום, איסכמיה ותסמונת תא12. הזרקת ורידי מאפשר אמין, מרחב מוגבלת, כתמים מרוכז מאוד, ודורש צבע קטן במינונים13,14. בנוסף, הזרקת ורידי מאפשר סיווג מהיר של fluorescein14,15. שיטה חלופית היא הזרקת סוכן הניגוד ישירות לתוך העורק הנבחר. שיטה זו לא היתה בשימוש בניסויים אלה כמו החוקרים רצו למנוע זיהום השדה הכירורגי עם דם ו fluorescein. על מנת להפחית את הסיכון, הזרקת הסוכן היקפי ניגודיות היקפית מומלץ13.
היתרונות של FVA הם חדות גבוהה (ניתן לזיהוי בקלות עם העין האנושית), רגישות גבוהה כפי שמוצג לעיל (שולחן 2), עלות נמוכה וטיפול קל16. פלואורואסעין נתרן היה הסוכן הניגוד הנבחר לבחון perfusion. אור נראה לבדו יכול לשמש עירור של הצבע והפליטה של אור ירוק אופייני. עם זאת, זה סוכן ניגודיות עובד הכי טוב עם אור כחול (כ 480 ננומטר) ופולט אור ירוק חזק (אורך הגל כ 530 ננומטר)15. על פי יושיאוקה ואח ', fluorescein צובע את העורק במהירות הגבוהה ביותר14. יתר על כן, זרימת דם fluorescein מועשר ניתן לצפות בזמן אמת15,17. הזמן הקצר הדרוש ל-FVA מציג יתרון נוסף; בסדרה זו לקח ממוצע של 2 דקות (± 1min) כדי לבצע FVA אחד.
החיסרון של שימוש fluorescein כסוכן ניגודיות הוא שזה עובד היטב עם קירות עורק דק בלבד אשר דורשים ניתוח זהיר מאוד. איצ'יקאווה ואח ' הראה את השמדת הצבע בשל פליטת האור המסוכבת באמצעות קירות עבים יותר על-ידיהסתיידות או העורקים הבלתי מעורקלים. לאחר ההזרקה, fluorescein הוא חילוף חומרים לפלורסנט פלואורואסעין גלוקורוניאן בכבד. בתוך 30 דקות לאחר ההזרקה, את הריכוז של fluorescein גלוקורונידה עולה על הריכוז של fluorescein18. . פלואורואסעין דורש זמן הרשאה ארוך הזרקה מיידית לאחר הזרקה ורידית של fluorescein לא מומלץ כמו עורק מפרצת הם כבר פלורסנט מן הזריקה הראשונה17.
המשקל המולקולרי של fluorescein הוא רק 376 kDa אשר מאפשר דליפה של הצבע. הקיר כלי הדם גם הופך פלורסנט אשר יכול להוביל הערכות זרימה חיובית שווא (הגדלת עם הזמן לאחר היישום). צבע בלתי סדיר של הקיר כלי נצפתה החל כ 5 דקות לאחר ההזרקה של fluorescein14. הצבע הוכתם, לעומת זאת, נצפה רק בעורקים גדולים יותר. עורקים קטנים ובינוניים לא הראו את מבנה ההכתמים הזה17. מומלץ להעריך את המפרצת מיד על מנת לזהות שרידי מילוי.
למרות שיש סיכון נמוך מאוד של רעילות, מקרים מסוימים של fluorescein המובילים לתגובות לב ודרכי הנשימה תוארו14. במחקר זה לא התרחשה התרחשות חמורה לרעה; הסיבוכים היחידים היו שני מקרים של וריד אוזניים. לדברי ליין ואח ', נתרן fluorescein אינו מזיק גם כאשר משתמשים בבני אדם17. מצד שני, fluorescein הוא לא יציב למדי, לא צריך להיות חשוף לאור לבן16 -מקור אור אדום ניתן להשתמש במקום.
כדי לבחור את הריכוז של fluorescein לארנבים, החוקרים החלו עם המינון הנמוך ביותר עובד בחולדות (0.2 mL של 100 mg/mL fluorescein נתרן) והגדיל אותו בהדרגה ל 1 mL. סימן של זריחה חזקה. נרשם במינון הזה המינון הוגדל בהדרגה כדי לבדוק אם הזריחה משפרת-וזה לא היה המקרה. המחברים החליטו להמשיך עם 1 מ ל של 100 mg/mL fluorescein נתרן13.
צבע נוסף זמין כדי לבחון את כלי הפעולה הפנימי הוא ICG. גודלו הוא 775 kDa וככזה בקושי חודר את הרקמות הסובבות14. בגלל אורכי הגל הארוך שלה פליטה, הרקמה היא חדרה יותר בקלות, כי הרקמות שקופים יותר ב 800 ננומטר19 ומבנים עמוקים להפוך לגלויים14,16. הריגוש אורך הגל בתוך 750-800 ננומטר נדרשים16,20 ואת אורך הגל הפליטה של סוכן הניגודיות הוא כ 800 nm16, מה שהופך את שני בלתי נראה לעין האנושית. בשל הזמן הקצר מחצית החיים של פלזמה בדם, הצבע ניתן להזריק ולהשתמש בו שוב ושוב16. מגבלות לשימוש בצבע זה כוללות בעיות עם עורקים בעלי חומה עבה20 ואת הצורך של אור מחוץ לספקטרום הנראה13. כתוצאה מכך, ICG תלויה בציוד יקר ולא ישימה בקלות בכל מעבדה.
לסיכום, FVA היא שיטה מהירה, זולה ואמינה עם רגישות גבוהה למסך הפטנטיות של מפרצות ועורקים הורים מכרסמים מפרצת מודלים. היא מקושרת לכמעט ללא תחלואה ותמותה. זה מאפשר ניטור זרימת הדם בזמן אמת במהלך הניתוח ומעקב. כדי לשפר את יעילותה, יש לבצע את ההזרקה בחשכה והיא מבוצעת בדרך הטובה ביותר על כלי קיבול בקפדנות. שיטה זו יכולה בקלות ובבטחה להיות מיושם במעבדה מוחי וסקולרית, והוא יכול למזער את עלויות הניסוי.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
כל המחברים מאשרים שאין ניגודי אינטרסים.
Acknowledgments
מחקר זה היה נתמך בחלקו על ידי מענק מחקר של Kantonsspital Aarau, שוויץ.
Materials
| Name | Company | Catalog Number | Comments |
| For rabbits | |||
| Aluminium foil | |||
| Animal shaver | |||
| Black tape | |||
| Blue filter | Thorlabs MF475-35 | ||
| Body warm plate | |||
| Camera | Sony NEX-5R | ||
| Catheter | 22G Vasofix Safety | ||
| Disinfictant | |||
| Fluorescein sodium | Fluorescein Faure 10% | ||
| Glas plate | |||
| Green filter | Thorlabs MF539-43 | ||
| Incontinence pad | |||
| Infusion pump | Perfusor Secura | ||
| Ketamine hydrochloride | any generic products | ||
| Needle | 25G | ||
| Oxygen | |||
| Ringer's Solution | |||
| Sterile sheets | |||
| Surgical instruments | micro forceps, micro scissor, blunt surgical scissor | ||
| Surgical microscope | OPMI, Carl Zeiss AG, Oberkochen, Germany | ||
| Syringe 2ml, 5ml, 50ml | |||
| Tape | |||
| Three-way-stopcock | |||
| Torch light | |||
| Xylazin | any generic products | ||
| For rats | |||
| Aluminium foil | |||
| Animal shaver | |||
| Black tape | |||
| Blue filter | Thorlabs MF475-35 | ||
| Body warm plate | |||
| Camera | Sony NEX-5R | ||
| Disinfictant | |||
| Fluorescein sodium | Fluorescein Faure 10% | ||
| Green filter | Thorlabs MF539-43 | ||
| Incontinence pad | |||
| Isoflurane | |||
| Ketamine hydrochloride | any generic products | ||
| Medetomidine hydrochloride | any generic products | ||
| Needle | 25G | ||
| Oxygen | |||
| Plate | |||
| Ringer's Solution | |||
| Sterile sheets | |||
| Surgical instruments | micro forceps, micro scissor, blunt surgical scissor | ||
| Surgical microscope | OPMI, Carl Zeiss AG, Oberkochen, Germany | ||
| Syringe 2ml, 5ml | |||
| Tape | |||
| Torch light |
References
- Kakucs, C., Florian, I. A., Ungureanu, G., Florian, I. S. Fluorescein Angiography in Intracranial Aneurysm Surgery: A Helpful Method to Evaluate the Security of Clipping and Observe Blood Flow. World Neurosurgery. 105, 406-411 (2017).
- Ajiboye, N., Chalouhi, N., Starke, R. M., Zanaty, M., Bell, R. Unruptured Cerebral Aneurysms: Evaluation and Management. ScientificWorldJournal. 2015, 954954 (2015).
- Suzuki, K., et al. Confirmation of blood flow in perforating arteries using fluorescein cerebral angiography during aneurysm surgery. Journal of Neurosurgery. 107 (1), 68-73 (2007).
- Gruter, B. E., et al. Fluorescence Video Angiography for Evaluation of Dynamic Perfusion Status in an Aneurysm Preclinical Experimental Setting. Operative Neurosurgery. , Hagerstown. (2019).
- Raabe, A., et al. Prospective evaluation of surgical microscope-integrated intraoperative near-infrared indocyanine green videoangiography during aneurysm surgery. Journal of Neurosurgery. 103 (6), 982-989 (2005).
- Riva, M., Amin-Hanjani, S., Giussani, C., De Witte, O., Bruneau, M. Indocyanine Green Videoangiography in Aneurysm Surgery: Systematic Review and Meta-Analysis. Neurosurgery. , (2017).
- Kuroda, K., et al. Intra-arterial injection fluorescein videoangiography in aneurysm surgery. Neurosurgery. 72, 2 Suppl Operative 141-150 (2013).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving Bioscience Research Reporting: The ARRIVE Guidelines for Reporting Animal Research. PLOS Biology. 8 (6), 1000412 (2010).
- Marbacher, S., et al. The Helsinki rat microsurgical sidewall aneurysm model. Journal of Visualized Experiments. (92), e51071 (2014).
- Marbacher, S., et al. Complex bilobular, bisaccular, and broad-neck microsurgical aneurysm formation in the rabbit bifurcation model for the study of upcoming endovascular techniques. American Journal of Neuroradiology. 32 (4), 772-777 (2011).
- Shurey, S., et al. The rat model in microsurgery education: classical exercises and new horizons. Archives of Plastic Surgery. 41 (3), 201-208 (2014).
- Foster, S. D., Lyons, M. S., Runyan, C. M., Otten, E. J. A mimic of soft tissue infection: intra-arterial injection drug use producing hand swelling and digital ischemia. World Journal of Emergency Medicine. 6 (3), 233-236 (2015).
- Flower, R. W. Injection technique for indocyanine green and sodium fluorescein dye angiography of the eye. Investigative Ophthalmology & Visual Science. 12 (12), 881-895 (1973).
- Yoshioka, H., et al. Advantage of microscope integrated for both indocyanine green and fluorescein videoangiography on aneurysmal surgery: case report. Neurologia medico-chirurgica (Tokyo). 54 (3), 192-195 (2014).
- Ichikawa, T., et al. Development of and Clinical Experience with a Simple Device for Performing Intraoperative Fluorescein Fluorescence Cerebral Angiography: Technical Notes. Neurologia medico-chirurgica. 56 (3), 141-149 (2016).
- Alander, J. T., et al. A review of indocyanine green fluorescent imaging in surgery. International Journal of Biomedical Imaging. 2012, 940585 (2012).
- Lane, B., Bohnstedt, B. N., Cohen-Gadol, A. A. A prospective comparative study of microscope-integrated intraoperative fluorescein and indocyanine videoangiography for clip ligation of complex cerebral aneurysms. Journal of Neurosurgery. 122 (3), 618-626 (2015).
- Blair, N. P., Evans, M. A., Lesar, T. S., Zeimer, R. C. Fluorescein and fluorescein glucuronide pharmacokinetics after intravenous injection. Investigative Ophthalmology & Visual Science. 27 (7), 1107-1114 (1986).
- Hillmann, D., et al. In vivo optical imaging of physiological responses to photostimulation in human photoreceptors. Proceedings of the National Academy of Sciences of the United States of America. 113 (46), 13138-13143 (2016).
- Golby, A. J. Image-Guided Neurosurgery. , Elsevier Science. (2015).



