Summary
우리는 형광계 형광 비디오 혈관 조영술 (FVA)를 사용하여 쥐와 토끼에 있는 측벽 동맥류의 동맥류 관류 및 혈관 점성을 능률하게 평가하기 위하여 프로토콜을 제시합니다. 92.6 %의 긍정적 인 예측 값으로, 특별한 장비가 필요하지 않은 간단하지만 매우 효과적이고 경제적 인 방법입니다.
Abstract
뇌 동맥류 치료는 완전한 폐색을 달성뿐만 아니라 부모 동맥의 혈류를 보존에 초점을 맞추고있습니다. 플루오레세인 나트륨과 인도시아닌 녹색은 각각 혈류 및 혈관 관류 상태를 관찰하는 데 사용된다. 이 연구의 목적은 토끼와 쥐의 측벽 동맥류 유도 후 실시간 혈류, 혈관 관류 상태 및 동맥류의 폐색을 확인하고 이러한 종의 절차를 검증하기 위해 FVA를 적용하는 것입니다.
20 개의 측벽 동맥류는 기증자 토끼의 경동맥에 탈세포화 된 동맥 혈관 주머니를 봉합하여 10 마리의 토끼에서 만들어졌습니다. 또한, 48 마리의 미세 수술 측벽 동맥류가 48 마리의 쥐에서 만들어졌습니다. 생성 후 한 달에 후속 동안, 부모 동맥류 복합체는 해부되었고 FVA는 토끼의 귀 정맥 카테터 삽입과 쥐의 대퇴 정맥 캐터 삽입을 통해 정맥 플루오레세인 (10 %, 1 mL) 주사를 사용하여 수행되었습니다. 동맥류를 수확한 후, 가부장제가 거시적으로 평가되었습니다.
거시적으로, 토끼에 있는 16동맥류 중 14는 완전히 가려진 루미나에 있는 잔여 부모 동맥 관류가 없음을, 그러나 11 (79%) 표시했습니다 FVA에 의해 감지되었습니다. 4개의 동맥류는 기술적인 문제로 인해 제외되었습니다. 쥐에서, 잔류 동맥류 관류는 48건 중 25건에서 거시적으로 관찰되었다. 관류의 거시적 증거가없는 23 의 FVA는 22 동맥류 (96 %)의 발생률을 확인했습니다. FVA와 관련 된 불리 한 이벤트 는 없었다. 플루오레세인은 쉽게 적용할 수 있으며 특별한 장비가 필요하지 않습니다. 토끼와 쥐와 실험 환경에서 부모 동맥 무결성 및 동맥류 개통 /잔류 관류를 평가하기위한 안전하고 매우 효과적인 방법입니다. FVA는 조영제로 플루오레세신을 사용하여 동맥류와 기본 혈관의 개통을 제어하는 데 효과적인 것으로 보이며 심지어 수술을 우회하도록 조정할 수도 있습니다.
Introduction
완전한 동맥류 말살 및 부모 동맥 무결성의 증거는 동맥류 수술에서 가장 중요합니다. 도플러 초음파 검사, 기존의 대뇌 혈관 조영술 (DSA), 컴퓨터 단층 조영술 (CTA) 또는 자기 공명 혈관 조영술 (MRA) 1과 같은 부모 동맥개통 및 동맥류 폐색을 확인하는 몇 가지 옵션이있습니다. 2. 그러나, 이들은 종종 실험실 설정에서 사용할 수없는 비용이 많이 들고 시간이 많이 걸리는 방법입니다. 더욱이, 그(것)들은 운동 유물을 피하기 위하여 실험동물의 추가 적인 감미료를 위한 방사선 노출 또는 필요와 같은 관련 있는 부작용이 있을 수 있습니다.
새로운 혈관 내 장치의 수가 증가함에 따라 이러한 장치의 전임상 테스트가 연속적으로 필요합니다. 그러나, 이 연구 결과는 수시로 사후 분석 (예를 들면, 거시 병리학 및 조직학)에 의존하고 동적 관류에 대한 정보가 부족합니다. 또한, 연구원에 대 한 실험 적인 수술 절차 동안 즉각적이 고 신뢰할 수 있는 정보를 얻을 하는 것이 중요 할 수 있습니다. 형광 혈관 조영법은 비용 효율적이고 시각화 기술을 수행하기쉬운 1,3,4.
이와 같이, 인도시아닌 녹색 (ICG) 비디오 혈관 조영술은 임상 신경 외과적 절차에 자주 사용되며 광범위하게 5,6을연구하고있다. 플루오레세인 비디오 혈관 조영술(FVA)은 인간 시력의 파장 범위 내에 있는 형광 신호를 생성하는 추가적인 이점을 가진 대체 기술이며, 따라서 확장 스펙트럼 적외선 카메라없이 육안으로 볼 수 있습니다. 7. Fluorescein 비디오 혈관 조영술은 임상 뇌혈관 수술에 덜 자주 사용되며실험 환경에서 FVA에 대한 보고는 1,4가부족합니다.
이 보고서의 목적은 쥐와 토끼 전임상 뇌혈관 연구에서 FVA의 타당성 및 적용 범위를 입증하는 것입니다.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
설치류는 동물 보호 시설에 보관되었고 실험은 스위스 베른 대학 (BE 108/16)과 (BE65/16)의 동물 복지위원회에 의해 검토되고 승인되었습니다. 모든 동물은 음식과 물에 무료로 접근 할 수있는 표준 실험실 식단에서 유지되었습니다. 모든 동물 실험은 3Rs(교체, 감소 및 정제)를 신중하게 고려하여 수행하였다. 10마리의 암컷 뉴질랜드 흰 토끼와 48마리의 수컷 위스타 쥐가 포함되었다. 도착 지침은 엄격하게8을 따랐다.
참고: 20개의 측벽 동맥류는 기증자 토끼의 경동맥에 탈세포화된 동맥 혈관 주머니를 봉합하여 10마리의 토끼에서 만들어졌습니다. 또한, 48마리의 미세수술측벽 동맥류가4,9전에 기재된 바와 같이 48마리의 쥐에서 생성되었다. 이미징 절차 및 거시적 분석은 동맥류 생성 후 4주 후에 수행되었습니다.
1. 플루오레세인 비디오 혈관 조영술에 필요한 재료의 준비
- 여기 필터로 작동하는 파란색 밴드패스 필터(재료 표참조)를 눌러 손전등을 수정합니다. 그러면 토치는 청색광만 방출해야 합니다. 여과되지 않은 빛이 누출되지 않도록 검은 색 테이프를 사용하십시오.
- 녹색 밴드 패스 필터 (예 : 현미경에 부착)를 장착하여 방출 광 필터로 작동합니다. 이제 녹색 표시등만 통과할 수 있습니다.
2. 작업장 및 자재 준비
- 소독제로 작업 공간을 소독합니다.
- 오염을 방지하기 위해 멸균 커튼으로 테이블을 덮습니다.
- 수술시 멸균 기구를 사용하십시오.
3. 수술을위한 동물의 준비
- 동물의 무게.
- 마취를 유도하고 체중에 따라 복용량을 조정하십시오.
- 토끼의경우 균형 잡힌 마취를 시작하십시오. 주사 중 한 손으로 눈을 보호하여 공포 반응을 줄입니다. 동물을 진정시키는 데 도움이 시트로 케이지를 덮는다.
- 주입 전에 4 % 이소플루란과 96 % 산소로 가스실에서 쥐를 마취.
- 마취의 깊이를 모니터링합니다. 발가락 사이를 꼬집어 동물이 잠들어 있는지 확인합니다.
- 토끼를 등에 대고 재배치합니다. 그들은 반응해서는 안됩니다.
- 쥐의경우 꼬리를 꼬집고 반응이 관찰되지 않도록하십시오.
- 설치류의 눈에 연고를 바르면 건조를 방지할 수 있습니다. 쥐의 혀를 당겨 삼키는 기회를 피하십시오.
- 마취의 보존으로 시작합니다.
- 토끼의경우, 카테터화 (주입 포트가있는 22 G 차폐 IV 카테터, 재료 표참조) 귀 정맥. 균형 잡힌 마취를 유지하십시오. 3방향 스톱콕을 사용하여 여러 번동시 주사를 할 수 있습니다.
- 쥐의경우 50 mg /kg 의 케타민 염산염과 0.5 mg / kg의 염산염염을 복강 내로 주입하십시오. 수술 중 유해한 발가락 핀치로 마취를 모니터링하십시오. 반응의 경우 추가 마취를 투여하십시오.
- 동물을 스파인 위치에 테이프로 부착하고 절개 위치를 면밀히 면도합니다. 베타세닉으로 부위를 소독하십시오.
- 토끼의경우, 특히 흉골 레도 마스타스 당 근육 주위에 목을 소독하십시오.
- 쥐의경우 방광에서 트랜스버 결장으로 영역을 소독하십시오.
- 수술 내내 마스크를 통해 산소를 관리하고 가열 패드로 체온을 유지하십시오.
4. 동맥의 준비
- 최상의 결과를 얻으려면 선택한 혈관을 주변 조직9,10에서철저히 해부하십시오.
- 쥐의경우, 꼬리 정맥을 식별 (덜 침습, 바람직하게는 생존 동물에 사용) 또는 불소 주입대퇴정맥을 해부4,11.
참고 : 토끼의경우 귀 정맥이 이미 마취에 사용되고 있기 때문에 플루오레세인 주사에는 혈관의 추가 해부가 필요하지 않습니다.
- 쥐의경우, 꼬리 정맥을 식별 (덜 침습, 바람직하게는 생존 동물에 사용) 또는 불소 주입대퇴정맥을 해부4,11.
- 주변 조직과의 대비를 높이기 위해 선택한 용기 아래에 흰색 패드를 배치합니다.
- 해부된 동맥의 현미경에 장착된 카메라를 초점.
5. 형광 화상 혈관 조영술
- 빛의 노출로부터 보호하기 위해 플루오레세인 나트륨 (100 mg / mL, 재료 표참조)으로 채워진 5 mL 주사기를 알루미늄 호일로 덮습니다. 불을 끄고 (가능한 한) 불소 나트륨을 정맥 내로 주입하십시오. 광표백을 방지하기 위해 어둠 속에서 주입하십시오.
- 토끼의경우, 카테터화 된 귀 정맥에 3 방향 스톱콕을 통해 0.3 mL / kg 플루오레세인 나트륨을 주입하십시오.
- 쥐의경우 카테터 또는 25G 바늘을 통해 대퇴 정맥에 0.4 mL / kg 플루오레세인 나트륨을 주입하십시오.
- 바늘이나 카테터를 0.5 mL 식염수로 씻어 모든 염료가 주입되도록 하십시오.
- 수정된 손전등으로 수술장을 비춥시합니다.
- 수정된 카메라로 촬영을 시작합니다. 혈류는 주사 후 몇 초후에 볼 수 있어야합니다 (그림 1).
참고: 여기서는 프레임 속도 = 50프레임/s, 초점 거리 = 70mm 및 F3.4를 사용했습니다.
6. 거시적 분석
- 동맥류 및 모동맥 복합체를 절제하고, 미세가위로 모동맥을 열어 개통하여 개통을 거시적으로 평가하고, 모동맥과 음역의 오리피스의 내강을 평가한다(도 1,2)9. 동맥류의 크기를 측정합니다. 동맥류-부모-동맥 복합체는 추가 분석을 위해 저장될 수 있습니다 (예를 들면, 학문).
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
수술 중 심박수와 혈압을 모니터링했습니다. 평균 심박수는 토끼에서 193/min, 쥐의 경우 196/min이었습니다. 토끼의 체중은 3.05-4.18 kg이고 쥐의 무게는 335-690g이었습니다.
우리는 10 마리의 토끼 중 8 개에서 FVA를 수행 할 수있었습니다(그림1). 두 마리 토끼의 동맥류 검사 4회는 기술적인 문제로 인해 카메라로 기록되지 않았습니다. 쥐에 있는 FVA를 관련시키는 아무 기술적인 어려움도 보고되지 않았습니다. 그러나, FVA는 대퇴 정맥을 천공하는 어려움 때문에 1개의 쥐에서 수행될 수 없었다.
8마리의 토끼에서 16개의 동맥류 중, 2개의 동맥류는 부모 동맥의 지속적인 관류를 보였다(거시적으로 확인됨) (표 1참조) FVA는 잔류 관류를 가진 5개의 케이스를 확인했습니다. 14 마리의 토끼 동맥류는 거시적으로 잔류 관류가 없었지만 11 (79 %)은 FVA를 사용하여 나중에 감지되었습니다. 잔류 관류는 48마리 중 25마리(표 1)에서 거시적으로 관찰되었고, 나머지 23마리의 쥐는 잔류 관류의 거시적 징후를 나타내지 않았다(도2). 그 23동맥류의 22는 FVA (96%)를 사용하여 그 때 확인되었습니다. 27건 중 25건이 확정되어 긍정 예측값이 92.6%, 감도100%, 특이성 94.1%를 나타냈다. (표2).
요약하면, 25개의 동맥류는 잔류 관류를 보였고, 53개의 모부 동맥은 특허였으며 11명은 거시적 및 비디오 혈관 조영술에서 확인된 것으로 폐색되었다. 토끼에 있는 FVA와 관련되었던 단지 사소한 합병증이 있었습니다; 카테터 화 중 한계 귀 정맥의 천천과 같은. 더 이상 부작용이 발생하지 않았습니다. FVA로 인한 사망률과 이환율이 보고되지 않았습니다.
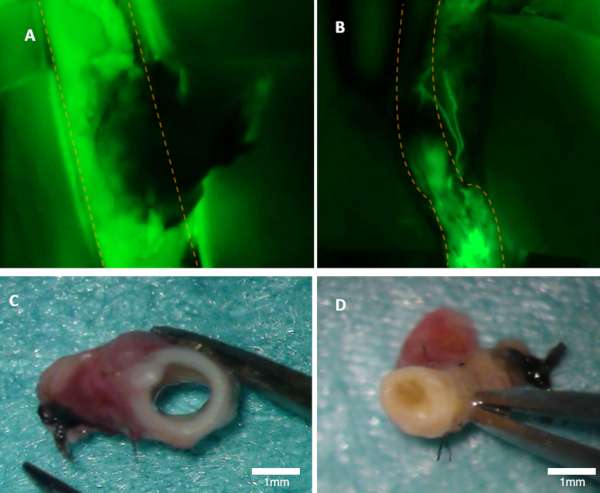
그림 1 : 토끼의 개미를시각화합니다. (A) 부모 동맥의 가성형은 형광 이미지에서 명확하게 볼 수 있습니다 (형광에서 녹색 방출이 보입니다). (B) 이 동맥은 가려져 있습니다 (형광 이미지). 두 동맥 모두 거시적 검사(C-D). 패널(C)은 패널 A로부터 동맥에 나타난다; 루멘이 열려 있습니다. 패널(D)은 패널 B로부터 의 동맥을 나타내며, 여기서 폐색은 거시적으로 볼 수 있다. 주황색 점선은 상위 동맥의 테두리를 표시합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2 : 쥐의 관류 시각화. (A) 이 패널은 잔류 관류 동맥류를 나타낸다(빨간색 점선은 잔류 관류를 표시한다). (B) 관류가 감지되지 않습니다. 패널(C)는 거시적 조사 동안 패널 A로부터의 동맥을 나타낸다; 동맥류 오리피스가 열려 있습니다. (D) 폐색 된 동맥류에 네오인티마의 매크로 스코픽보기. 주황색 점선은 부모 동맥과 동맥류 돔을 표시합니다. 패널(A) 및 (B)는 형광 전용 이미지이고 녹색은 형광 방출을 나타낸다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 개전성/잔류 관류 | ||||
| 거시적 + | 매크로코피컬 - | 플루오레세인 + | 플루오레세인 - | |
| 토끼 | 2개 | 14세 | 5개 | 11세 |
| 쥐 | 23세 | 25개 | 22세 | 21세 |
| 총 | 25개 | 39세 | 27세 | 32세 |
표 1: 가성 테스트. 부모 동맥의 개적성은 토끼에서만 테스트되었으며 여기에 설명되어 있습니다. 플루오레세인은 거시적 평가보다 부모 동맥의 더 많은 치직을 검출했습니다. (이 설정에있는 모든 쥐는 동맥류가 복부 대동맥에 봉합되었기 때문에 열린 부모 동맥을 가지고 있었습니다.) 동맥류의 개미는 쥐에서만 테스트되었습니다. 23개의 거시적 검출된 patencies의 22개는 FVA를 사용하여 확인되었습니다. 25명 중 21명은 FVA에 대한 애국심을 보이지 않았습니다.
| 거시적 긍정적 인 | 거시적 음수 | 총 | |
| 플루오레세인 양성 | 25개 | 2개 | 27세 |
| 플루오레세인 음성 | 0 | 32세 | 32세 |
| 총 | 25개 | 34세 |
표 2: FVA의 특이성과 민감도를 계산하는 데 사용되는 2대2 테이블입니다.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
FVA는 설치류의 혈관을 검사하는 유망하고 단순한 방법이며 상용 장치 및 기성 장비로 수행 할 수 있습니다. FVA는 혈관이 먼저 적절한 해부를 필요로하기 때문에 혈관 무결성의 수술 중 평가가 필요한 수술 중에 구현 될 수 있습니다.
저자는 감염, 허혈 및 구획 증후군12와같은 부주의한 사건의 더 낮은 리스크 때문에 동맥 주입에 정맥 주입을 선호했습니다. 정맥 주사는 신뢰할 수있는, 공간 제한, 고농축 염색, 작은 염료 투여량13,14가필요합니다. 또한 정맥 주사는 플루오레세인14,15의빠른 클리어런스를 허용합니다. 다른 방법은 선택한 동맥에 직접 조영제를 주입하는 것입니다. 이 방법은 조사자가 혈액과 플루오레세인으로 수술 분야를 오염시키는 것을 방지하고 싶었기 때문에 이러한 실험에서 사용되지 않았다. 이러한 위험을 줄이기 위해 말초 정맥 조영제 주사를 권장합니다13.
FVA의 장점은 높은 콘트라스트(사람의 눈으로 쉽게 감지가능),상기와 같이 고감도(표 2), 저비용 및 취급용용(16)이다. 플루오레세인 나트륨은 관류를 검사하기 위해 선택된 조영제였다. 가시광선만으로도 염료의 여기및 일반적인 녹색광의 방출에 사용할 수 있다. 그럼에도 불구하고, 이 조영제는 청색광(약 480 nm)과 가장 잘 작동하며 강한녹색광(파장 약 530 nm)을 방출한다 15. 요시오카 등에 따르면, 플루오레세인은 매우 빠르게 동맥을 색을 채색합니다14. 또한, 플루오레세이진이 풍부한 혈액의 흐름을 실시간으로15,17에서관찰할 수 있다. FVA에 필요한 짧은 시간은 또 다른 이점을 제공합니다. 이 시리즈에서는 하나의 FVA를 수행하는 데 평균 2 분 (± 1 분)이 걸렸습니다.
조영제로 플루오레세인을 사용하는 단점은 매우 신중한 해부를 요구하는 얇은 동맥 벽에서만 잘 작동한다는 것입니다. 이치카와 등은 석회화 또는 비분리된 동맥에 의한 두꺼운 벽을 통한 빛의 막힌 방출로 인한 염료의 소멸을 보여주었다15. 주사 후, 플루오레세인은 간에서 형광 형광 글루쿠로나이드로 대사됩니다. 주사 후 30 분 이내에, 플루오레세인 글루쿠로니드의 농도는 플루오레세인(18)의농도를 초과한다. 플루오레세인은 긴 클리어런스 시간이 필요합니다. 불소의 정맥 주사 후 즉각적인 재주사는 동맥과 동맥류가 이미 첫 번째 주사(17)에서형광되기 때문에 권장되지 않습니다.
플루오레세인의 분자량은 염료의 누출을 허용하는 단지 376 kDa입니다. 혈관 벽은 또한 거짓 양성 유량 평가로 이어질 수있는 형광이됩니다 (적용 후 시간이 지남에 따라 증가). 혈관벽의 누덕착은 플루오레세인(14)을 주사한후 약 5분 후에 부터 관찰되었다. 그러나 스포트티 착색은 더 큰 동맥에서만 관찰되었습니다. 중소형 동맥은 이 염색구조(17)를나타내지 않았다. 잔류 충전을 감지하기 위해 즉시 동맥류를 평가하는 것이 좋습니다.
독성의 위험이 매우 낮지만, 심장 및 호흡기 반응으로 이어지는 플루오레세인의 일부 사례는14에기술되어 있다. 이 연구에서 는 심각한 부작용발생; 유일한 합병증은 귀 정맥 천포의 2 경우였습니다. Lane et al.에 따르면, 플루오레세이트 나트륨은인간17에서사용될 때에도 유해하지 않다. 다른 한편으로는, 플루오레세인은 매우 불안정하고 백색광(16)에 노출되어서는 안 된다- 대신에 적색 광원을 사용할 수 있다.
토끼에 대한 플루오레세인의 농도를 선택하기 위해, 연구자들은 쥐에서 가장 낮은 알려진 작업 용량 (0.2 mL의 100 mg / mL 플루오레세인 나트륨)으로 시작하여 점차적으로 1 mL로 증가시켰습니다. 강한 형광 신호는 그 복용량에 등록되었다. 형광이 개선되는지 테스트하기 위해 투여량이 점차 증가하였고, 이는 그렇지 않았다. 저자는 100 mg/mL 플루오레세인 나트륨13의1 mL로 계속하기로 결정했습니다.
수술 중 혈관을 검사할 수 있는 또 다른 염료는 ICG입니다. 그 크기는 775 kDa이며 주변 조직14에거의 침투하지 않습니다. 그것의 더 긴 방출 파장 때문에, 조직은 800 nm19에서 더 투명하고 더 깊은 구조물이 보이기 때문에 조직은 더 쉽게 침투합니다14,16. 750-800 nm 내의 여기 파장이16,20및 조영제로부터의 방출 파장이 약 800 nm16으로인간의 눈에 보이지 않게 된다. 혈장에서의 짧은 반감기 로 인해 염료를 반복적으로 주입하고 재사용할 수 있습니다16. 이러한 염료사용에 대한 제한사항으로는 두꺼운 벽으로 둘러싸인 동맥(20)과 가시스펙트럼(13)밖에서빛의 필요성에 대한 문제점이 있다. 결과적으로 ICG는 고가의 장비에 의존하며 모든 실험실에서 쉽게 적용할 수 없습니다.
결론적으로, FVA는 설치류 동맥류 모델에서 동맥류와 부모 동맥의 스크린 개테성에 높은 감도를 가진 빠르고 저렴하고 신뢰할 수있는 방법입니다. 그것은 거의 이환율 및 사망률과 연관되지 않습니다. 그것은 수술 및 후속 동안 실시간 혈류 모니터링을 할 수 있습니다. 그 효능을 향상시키기 위해, 주사는 어둠 속에서 수행되어야하며 꼼꼼하게 해부 된 혈관에서 가장 잘 수행됩니다. 이 방법은 뇌혈관 실험실에서 쉽고 안전하게 구현될 수 있으며 실험 비용을 최소화할 수 있습니다.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
모든 저자는 이해 상충을 확인하지 않습니다.
Acknowledgments
이 연구는 스위스 칸톤스피탈 아라우의 연구 보조금에 의해 부분적으로 지원되었다.
Materials
| Name | Company | Catalog Number | Comments |
| For rabbits | |||
| Aluminium foil | |||
| Animal shaver | |||
| Black tape | |||
| Blue filter | Thorlabs MF475-35 | ||
| Body warm plate | |||
| Camera | Sony NEX-5R | ||
| Catheter | 22G Vasofix Safety | ||
| Disinfictant | |||
| Fluorescein sodium | Fluorescein Faure 10% | ||
| Glas plate | |||
| Green filter | Thorlabs MF539-43 | ||
| Incontinence pad | |||
| Infusion pump | Perfusor Secura | ||
| Ketamine hydrochloride | any generic products | ||
| Needle | 25G | ||
| Oxygen | |||
| Ringer's Solution | |||
| Sterile sheets | |||
| Surgical instruments | micro forceps, micro scissor, blunt surgical scissor | ||
| Surgical microscope | OPMI, Carl Zeiss AG, Oberkochen, Germany | ||
| Syringe 2ml, 5ml, 50ml | |||
| Tape | |||
| Three-way-stopcock | |||
| Torch light | |||
| Xylazin | any generic products | ||
| For rats | |||
| Aluminium foil | |||
| Animal shaver | |||
| Black tape | |||
| Blue filter | Thorlabs MF475-35 | ||
| Body warm plate | |||
| Camera | Sony NEX-5R | ||
| Disinfictant | |||
| Fluorescein sodium | Fluorescein Faure 10% | ||
| Green filter | Thorlabs MF539-43 | ||
| Incontinence pad | |||
| Isoflurane | |||
| Ketamine hydrochloride | any generic products | ||
| Medetomidine hydrochloride | any generic products | ||
| Needle | 25G | ||
| Oxygen | |||
| Plate | |||
| Ringer's Solution | |||
| Sterile sheets | |||
| Surgical instruments | micro forceps, micro scissor, blunt surgical scissor | ||
| Surgical microscope | OPMI, Carl Zeiss AG, Oberkochen, Germany | ||
| Syringe 2ml, 5ml | |||
| Tape | |||
| Torch light |
References
- Kakucs, C., Florian, I. A., Ungureanu, G., Florian, I. S. Fluorescein Angiography in Intracranial Aneurysm Surgery: A Helpful Method to Evaluate the Security of Clipping and Observe Blood Flow. World Neurosurgery. 105, 406-411 (2017).
- Ajiboye, N., Chalouhi, N., Starke, R. M., Zanaty, M., Bell, R. Unruptured Cerebral Aneurysms: Evaluation and Management. ScientificWorldJournal. 2015, 954954 (2015).
- Suzuki, K., et al. Confirmation of blood flow in perforating arteries using fluorescein cerebral angiography during aneurysm surgery. Journal of Neurosurgery. 107 (1), 68-73 (2007).
- Gruter, B. E., et al. Fluorescence Video Angiography for Evaluation of Dynamic Perfusion Status in an Aneurysm Preclinical Experimental Setting. Operative Neurosurgery. , Hagerstown. (2019).
- Raabe, A., et al. Prospective evaluation of surgical microscope-integrated intraoperative near-infrared indocyanine green videoangiography during aneurysm surgery. Journal of Neurosurgery. 103 (6), 982-989 (2005).
- Riva, M., Amin-Hanjani, S., Giussani, C., De Witte, O., Bruneau, M. Indocyanine Green Videoangiography in Aneurysm Surgery: Systematic Review and Meta-Analysis. Neurosurgery. , (2017).
- Kuroda, K., et al. Intra-arterial injection fluorescein videoangiography in aneurysm surgery. Neurosurgery. 72, 2 Suppl Operative 141-150 (2013).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving Bioscience Research Reporting: The ARRIVE Guidelines for Reporting Animal Research. PLOS Biology. 8 (6), 1000412 (2010).
- Marbacher, S., et al. The Helsinki rat microsurgical sidewall aneurysm model. Journal of Visualized Experiments. (92), e51071 (2014).
- Marbacher, S., et al. Complex bilobular, bisaccular, and broad-neck microsurgical aneurysm formation in the rabbit bifurcation model for the study of upcoming endovascular techniques. American Journal of Neuroradiology. 32 (4), 772-777 (2011).
- Shurey, S., et al. The rat model in microsurgery education: classical exercises and new horizons. Archives of Plastic Surgery. 41 (3), 201-208 (2014).
- Foster, S. D., Lyons, M. S., Runyan, C. M., Otten, E. J. A mimic of soft tissue infection: intra-arterial injection drug use producing hand swelling and digital ischemia. World Journal of Emergency Medicine. 6 (3), 233-236 (2015).
- Flower, R. W. Injection technique for indocyanine green and sodium fluorescein dye angiography of the eye. Investigative Ophthalmology & Visual Science. 12 (12), 881-895 (1973).
- Yoshioka, H., et al. Advantage of microscope integrated for both indocyanine green and fluorescein videoangiography on aneurysmal surgery: case report. Neurologia medico-chirurgica (Tokyo). 54 (3), 192-195 (2014).
- Ichikawa, T., et al. Development of and Clinical Experience with a Simple Device for Performing Intraoperative Fluorescein Fluorescence Cerebral Angiography: Technical Notes. Neurologia medico-chirurgica. 56 (3), 141-149 (2016).
- Alander, J. T., et al. A review of indocyanine green fluorescent imaging in surgery. International Journal of Biomedical Imaging. 2012, 940585 (2012).
- Lane, B., Bohnstedt, B. N., Cohen-Gadol, A. A. A prospective comparative study of microscope-integrated intraoperative fluorescein and indocyanine videoangiography for clip ligation of complex cerebral aneurysms. Journal of Neurosurgery. 122 (3), 618-626 (2015).
- Blair, N. P., Evans, M. A., Lesar, T. S., Zeimer, R. C. Fluorescein and fluorescein glucuronide pharmacokinetics after intravenous injection. Investigative Ophthalmology & Visual Science. 27 (7), 1107-1114 (1986).
- Hillmann, D., et al. In vivo optical imaging of physiological responses to photostimulation in human photoreceptors. Proceedings of the National Academy of Sciences of the United States of America. 113 (46), 13138-13143 (2016).
- Golby, A. J. Image-Guided Neurosurgery. , Elsevier Science. (2015).



