Summary
Vi præsenterer en protokol til effektivt at evaluere aneurisme perfusion og fartøjs patency af sidevæg aneurisme i rotter og kaniner, ved hjælp af fluorescein-baseret fluorescens video angiografi (fva). Med en positiv prædiktiv værdi på 92,6% er det en enkel, men meget effektiv og økonomisk metode, hvor der ikke kræves noget særligt udstyr.
Abstract
Hjernen aneurisme behandling fokuserer på at opnå komplet okklusion, samt bevare blodgennemstrømningen i moder arterien. Fluorescein natrium og indocyanine grøn bruges til at muliggøre observation af blodgennemstrømning og fartøjs perfusion status, hhv. Formålet med denne undersøgelse er at anvende fva til at verificere real-time blodgennemstrømning, fartøjs perfusion status og okklusion af aneurismer efter induktion af sidevæg aneurismer i kaniner og rotter, samt at validere proceduren i disse arter.
Tyve sidevæg aneurismer blev oprettet i 10 kaniner ved at suturere en decellularized arteriel beholder pose på carotis arterien af en donor kanin. Hertil kommer, 48 mikrokirurgisk sidevæg aneurismer blev oprettet i 48 rotter. Under opfølgningen på en måned efter oprettelsen blev det overordnede arterie/aneurisme-kompleks dissekeret, og FVA blev udført ved hjælp af en intravenøs fluorescein (10%, 1 mL) injektion via en øreblodåre kateterisering hos kaniner og en femoral vene catherization i rotter. Aneurismer blev derefter høstet, og patency blev evalueret makroskopisk.
Makroskopisk viste 14 ud af 16 aneurismer hos kaniner ingen residualarterie perfusion med totalt okklameret luminae, men 11 (79%) blev opdaget af FVA. Fire aneurismer blev udelukket på grund af tekniske problemer. Hos rotter blev resterende aneurisme perfusion makroskopisk observeret i 25 ud af 48 tilfælde. Af de 23 uden makroskopiske tegn på perfusion bekræftede FVA forekomsten af 22 aneurismer (96%). Der var ingen bivirkninger forbundet med FVA. Fluorescein er let anvendelig, og der er ikke behov for specialudstyr. Det er en sikker og yderst effektiv metode til at evaluere forælder arterie integritet og aneurisme patency/rest perfusion i en eksperimentel indstilling med kaniner og rotter. FVA, der bruger fluorescein som kontrastmiddel, synes at være effektivt til at kontrollere patency af aneurismer og det underliggende fartøj og kan endda tilpasses til bypass kirurgi.
Introduction
Bevis for komplet aneurisme udslette og forælder arterie integritet er af allerstørste betydning i aneurisme kirurgi. Der er flere muligheder for at bekræfte forældre arterie patency og aneurisme okklusion, såsom Doppler sonography, konventionel cerebral angiografi (DSA), computertomografi angiografi (CTA) eller magnetisk resonans angiografi (MRA)1, 2. men disse er dyre og tidskrævende metoder, som ofte ikke er tilgængelige i et laboratorium indstilling. Desuden kan de have relevante bivirkninger såsom udsættelse for stråling eller behov for yderligere sedation af forsøgsdyr for at undgå bevægelse artefakt.
Med et stigende antal nye endovaskulære anordninger dukker op, er der et fortløbende behov for præklinisk testning af sådanne anordninger. Disse undersøgelser er imidlertid ofte afhængige af post mortem-analyse (f. eks. makro patologi og histologi) og mangler oplysninger om dynamisk perfusion. For forskeren kan det desuden være afgørende at opnå omgående og pålidelig information under en eksperimentel kirurgisk procedure. Fluorescens angiografi er en omkostningseffektiv og nem at udføre visualisering teknik1,3,4.
Som sådan anvendes indocyanin grøn (ICG) video angiografi ofte i kliniske neurokirurgiske procedurer og er i udstrakt grad blevet undersøgt5,6. Fluorescein video angiografi (FVA) er en alternativ teknik, med den yderligere fordel at skabe et fluorescens signal, der er inden for bølgelængdeområdet af menneskets vision, og kan således ses af det blotte øje uden et udvidet spektrum infrarødt kamera 7. fluorescein video angiografi er sjældnere anvendes i klinisk cerebrovaskulær kirurgi og rapporter om fva i eksperimentelle indstillinger er knappe1,4.
Formålet med denne rapport er at påvise gennemførligheden og omfanget af FVA'S anvendelse af præklinisk cerebrovaskulær forskning i rotter og kaniner.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Gnavere blev anbragt i en dyrepleje facilitet, og eksperimenter blev gennemgået og godkendt af Udvalget for dyrevelfærd ved universitetet i Bern, Schweiz (BE 108/16) og (BE65/16). Alle dyr blev opretholdt på en standard laboratorie diæt med fri adgang til mad og vand. Alle dyreforsøg blev udført under omhyggelig overvejelse af 3R'er (udskiftning, reduktion og forfinelse). Ti kvindelige New Zealand hvide kaniner og 48 mandlige Wistar rotter blev inkluderet. ANKOMME retningslinjer blev fulgt strengt8.
Bemærk: tyve sidevæg aneurismer blev oprettet i 10 kaniner ved at suturere en decellularized arteriel beholder pose på carotis arterien af en donor kanin. Desuden, 48 mikrokirurgisk sidevæg aneurismer blev oprettet i 48 rotter som beskrevet før4,9. Imaging procedure og makroskopisk analyse blev udført 4 uger efter aneurisme skabelse.
1. klargøring af materiale, der er nødvendigt for fluorescein video angiografi
- Ændre lommelygten ved at tape på en blå båndpas filter (Se tabellen over materialer), som vil fungere som en excitation filter. Faklen skal derefter kun udsende blåt lys. Brug sort tape for at undgå lækage af ufiltreret lys.
- Udstyre kameraet (f. eks, fastgjort til mikroskopet) med en grøn båndpas filter (Se tabellen over materialer), som vil fungere som en emission lys filter. Kun grønt lys bør nu være i stand til at passere igennem.
2. forberedelse af arbejdspladsen og materialer
- Desinficerende arbejdsområde med desinfektionsopløsning.
- Dæk bordet med sterile gardiner for at forhindre kontaminering.
- Brug sterile instrumenter til operationen.
3. forberedelse af dyrene til operationen
- Afvejes dyrene.
- Fremkald anæstesi, og justér dosis i henhold til vægten.
- For kaniner, starte afbalanceret anæstesi. Beskyt deres øjne med den ene hånd under injektionen for at reducere deres skræk reaktion. Dæk buret med et ark for at hjælpe adstadige dyrene.
- Anæstetize rotter i et gaskammeret med 4% isofluran og 96% ilt før injektionen.
- Overvåge dybden af anæstesi. Knib mellem tæerne for at sikre, at dyrene sover.
- Flyt kaninerne på ryggen. De bør ikke reagere.
- For rotter, Knib deres haler og sikre, at ingen reaktion er observeret.
- Påfør salve på gnavere øjne for at forhindre tørhed. Træk rotternes tunger ud for at undgå enhver risiko for at synke.
- Begynd med konservering af anæstesi.
- For kaniner, kateterize (22 G AFSKÆRMET IV kateter med injektions port, se tabellen over materialer) øret vene. Opretholde afbalanceret anæstesi. Brug en tre-vejs stophane til at muliggøre flere samtidige injektioner.
- For rotterindsprøjtes 50 mg/kg ketaminhydrochlorid og 0,5 mg/kg medetomidin hydrochlorid intraperitonealt. Overvåg anæstesi med en skadelig tå knivspids under operationen. I tilfælde af reaktion, administrere yderligere anæstesi.
- Tape dyrene på brættet i en liggende position og tæt barbering indsnit placering. Desinficer området med Betaseptisk.
- For kaniner, desinficere halsen, især omkring sternocleidomastoideus muskel.
- For rotter, desinficere området fra blære til transvers kolon.
- Administrer ilt gennem en maske under hele operationen og opretholde kropstemperaturen med en varmepude.
4. klargøring af arterien
- For de bedste resultater, grundigt dissekere det valgte fartøj fra det omgivende væv9,10.
- For rotter, identificere hale vene (mindre invasive, fortrinsvis anvendes til overlevende dyr) eller dissekere en femoral vene for fluorescein injektion4,11.
Bemærk: for kaninerer der ikke behov for yderligere dissektion af beholdere til fluorescein injektion, da øreblodåre allerede anvendes til anæstesi.
- For rotter, identificere hale vene (mindre invasive, fortrinsvis anvendes til overlevende dyr) eller dissekere en femoral vene for fluorescein injektion4,11.
- Placer en hvid pude under valgt fartøj for at øge kontrasten med det omgivende væv.
- Fokuser kameraet monteret på mikroskopet på den dissekeret arterie.
5. fluorescein video angiografi
- Dæk den 5 mL sprøjte fyldt med fluorescein natrium (100 mg/mL, se tabellen over materialer) med aluminiumsfolie for at beskytte mod udsættelse af lys. Sluk lysene (så meget som muligt) og Injicér fluorescein natrium intravenøst. Injicer under mørke for at forhindre foto blegning.
- For kaninerindsprøjtes 0,3 ml/kg fluorescein natrium gennem trevejs stophanen i den kateteriserede øre vene.
- For rotterindsprøjtes 0,4 ml/kg fluorescein natrium i femoral vene via et kateter eller en 25 G nål.
- Skyl nålen eller kateteret med 0,5 mL saltvandsopløsning for at sikre, at alle farvestof injiceres.
- Oplys det kirurgiske felt med den modificerede lommelygte.
- Begynd at filme med det modificerede kamera. Blodgennemstrømningen skal være synlig et par sekunder efter injektionen (figur 1).
Bemærk: her brugte vi frame rate = 50 frames/s, brændvidde = 70 mm, og F 3.4.
6. makroskopisk analyse
- Resect aneurismer og forældre-arterie komplekset, og Evaluer patency makroskopisk ved at åbne den forælder arterien med mikro-saks og evaluere lumen af moder arterien og anerysm 's åbning (Se figur 1, 2)9. Måle størrelserne af aneurismer. Aneurisme-forældre-arterie-kompleks kan derefter lagres til yderligere analyse (f. eks. histologi).
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Hjertefrekvens og blodtryk blev overvåget under operationen. Gennemsnitlig hjertefrekvens var 193/min hos kaniner og 196/min hos rotter. Kaninerne legemsvægt varierede 3.05-4.18 kg, og rotterne vejede 335-690 g.
Vi var i stand til at udføre FVA i otte ud af ti kaniner (figur 1). Fire aneurisme undersøgelser i to kaniner blev ikke indspillet med kameraet på grund af tekniske vanskeligheder. Der blev ikke indberettet tekniske vanskeligheder med FVA hos rotter. FVA kunne dog ikke udføres hos en rotte på grund af vanskeligheder med at punktere femoral vene.
Af 16 aneurismer i otte kaniner viste to aneurismer vedvarende perfusion af moder pulsåren (bekræftet makroskopisk) (Se tabel 1), mens fva identificerede fem tilfælde med rest perfusion. 14 kaninaneurismer viste ingen rest perfusion makroskopisk, men 11 (79%) efterfølgende blev detekteret ved hjælp af FVA. Rest perfusion blev observeret makroskopisk hos 25 ud af 48 rotter (tabel 1), og de øvrige 23 rotter udviste ingen makroskopiske tegn på rest perfusion (figur 2). 22 af disse 23 aneurismer blev derefter bekræftet ved hjælp af FVA (96%). I alt kunne 25 ud af 27 tilfælde bekræftes, hvilket resulterede i en positiv prædiktiv værdi på 92,6%, en følsomheds procent på 100% og specificitet på 94,1%. (Tabel 2).
Kort sagt, 25 aneurismer viste resterende perfusion, 53 forælder arterier var patent og 11 blev blokeret som bekræftet makroskopisk og på video angiografi. Der var kun mindre komplikationer forbundet med FVA hos kaniner; Perforering af marginal øre vene under kateterisering. Der blev ikke oplevet yderligere bivirkninger. Der blev ikke indberettet nogen dødelighed og sygelighed på grund af FVA.
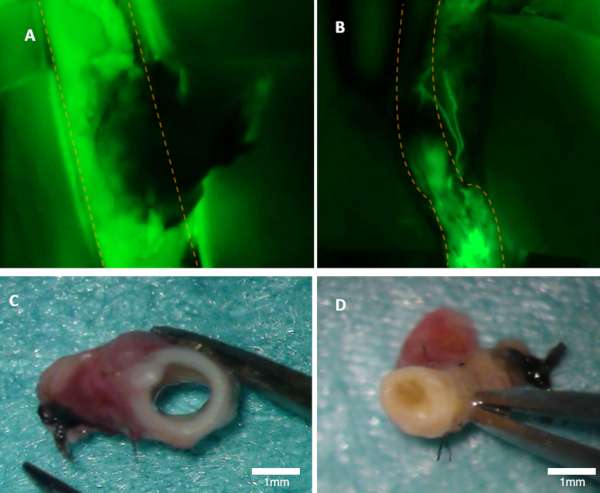
Figur 1 : Visualisering af patency i en kanin. A) den overordnede arterie gennemsigtighed er tydeligt synlig på fluorescens billedet (grøn emission fra fluorescein ses). B) denne arterie er blokeret (Fluorescens billede). Begge arterier blev inspiceret makroskopisk (C-D). Panel (C) viser i arterien fra panel A; lumen er åben. Panel (D) viser arterien fra panel B, hvor okklusion kan ses makroskopisk. Orange stiplede linjer markerer grænserne for den overordnede arterie. Venligst klik her for at se en større version af dette tal.

Figur 2 : Visualisering af perfusion i en rotte. (A) dette panel viser en residualt perfaneurisme (rød punkteret linje markerer den resterende perfusion). B) der kan ikke påvises perfusion. Panel (C) viser arterien fra panel A under makroskopisk kontrol; aneurisme-åbningen er åben. D) makroskopisk syn på neointima på en occineret aneurisme. Orange punkterede linjer markerer forældre arterien og aneurisme ' Dome. Paneler (A) og (B) er kun fluorescens-billeder, og den grønne farve viser fluorescein emission. Venligst klik her for at se en større version af dette tal.
| Åbenhed/resterende perfusion | ||||
| Macroscopical + | Macroscopical- | Fluorescein + | Fluorescein | |
| Kaniner | 2 | 14 | 5 | 11 |
| Rotter | 23 | 25 | 22 | 21 |
| Samlede | 25 | 39 | 27 | 32 |
Tabel 1: afprøvning af åbenhed. Patency af forældre arterien blev kun testet i kaniner og er illustreret her. Fluorescein detekterede flere patencer af forælder arterier end makroskopisk evaluering. (Alle rotter i denne indstilling havde en åben forælder arterien, som aneurismer blev sutureret på abdominal aorta.) Patency af aneurismer blev kun afprøvet i rotter. Tyve-to af 23 makroskopisk detekterede patencer blev bekræftet ved hjælp af FVA. 21 af 25 viste ingen patency på FVA.
| Makroskopisk positiv | Makroskopisk negativ | Samlede | |
| Fluorescein positiv | 25 | 2 | 27 |
| Fluorescein negativ | 0 | 32 | 32 |
| Samlede | 25 | 34 |
Tabel 2: to-til-to-tabel, der bruges til at beregne FVA'S specificitet og følsomhed.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
FVA er en lovende og ukompliceret metode til at undersøge fartøjer i gnavere og kan udføres med kommercielle anordninger og off-the-shelf udstyr. FVA kan implementeres under enhver operation, hvor der er behov for intraoperativ evaluering af fartøjs integriteten, da skibene først skal have den rette dissektion.
Forfatterne foretrak venøs injektion til arteriel injektion på grund af den lavere risiko for utilsigtede hændelser såsom infektion, iskæmi og rum syndrom12. Intravenøs injektion muliggør pålidelig, rumlig begrænset, stærkt koncentreret farvning, og kræver små farvestof doser13,14. Desuden giver venøs injektion en hurtig clearance af fluorescein14,15. En alternativ metode er at injicere kontrastmiddel direkte ind i den valgte arterie. Denne metode blev ikke anvendt i disse eksperimenter, da efterforskerne ønskede at forhindre kontaminerende operationsområdet med blod og fluorescein. For at reducere denne risiko, Perifer venøs kontrastmiddel injektion anbefales13.
Fordelene ved FVA er høj kontrast (let detekterbare med det menneskelige øje), høj følsomhed som vist ovenfor (tabel 2), lave omkostninger og nem håndtering16. Fluorescein natrium var den valgte kontrastmiddel til at undersøge perfusion. Synligt lys alene kan bruges til excitation af farvestof og emission af det typiske grønne lys. Ikke desto mindre virker dette kontrastmiddel bedst med blåt lys (ca. 480 nm) og udsender et stærkt grønt lys (bølgelængde ca. 530 nm)15. Ifølge Yoshioka et al., fluorescein farver arterien ekstremt hurtigt14. Desuden kan strømmen af fluorescein-beriget blod observeres i realtid15,17. Den korte tid, der er nødvendig for FVA, giver en anden fordel. i denne serie tog det et gennemsnit på 2 min (± 1min) at gennemføre en FVA.
Ulempen ved at bruge fluorescein som kontrastmiddel er, at det fungerer godt med kun tynde arterie vægge, som kræver meget omhyggelig dissektion. Ichikawa et al. viste udslettelse af farvestof på grund af den forpurede emission af lys gennem tykkere vægge ved forkalkning eller undissected arterier15. Efter injektion metaboliseres fluorescein til fluorescerende fluorercein glucuronid i leveren. Inden for 30 minutter efter injektion overskrider koncentrationen af fluorescein glucuronid koncentrationen af fluorescein18. Fluorescein kræver en lang clearance tid. En øjeblikkelig injektion efter intravenøs injektion af fluorescein anbefales ikke, da arterien og aneurisme allerede er lysstofrør fra den første injektion17.
Den molekylære vægt af fluorescein er kun 376 kDa, som tillader lækage af farvestoffet. Den vaskulære væg også bliver fluorescerende, som kan føre til falsk positive flow evalueringer (stigende med tiden efter påføring). En ujævn farvning af beholderen væggen blev observeret starter ca 5 min efter injektion af fluorescein14. Den plettet farvning, dog, blev kun observeret i større arterier. Små og mellemstore arterier viste ikke denne farvnings struktur17. Det anbefales at evaluere aneurisme med det samme for at detektere rest fyldning.
Selv om der er en meget lav risiko for toksicitet, nogle tilfælde af fluorescein fører til hjerte-og respiratoriske reaktioner er blevet beskrevet14. I denne undersøgelse forekom der ingen alvorlig bivirkning. de eneste komplikationer var 2 tilfælde af øre vene perforation. Ifølge Lane et al., natriumfluorescein er ikke skadeligt, selv når det anvendes i mennesker17. På den anden side, fluorescein er ganske ustabil og bør ikke udsættes for hvidt lys16 -en rød lyskilde kan bruges i stedet.
For at vælge koncentrationen af fluorescein for kaniner, begyndte investigatorerne med den lavest kendte arbejds dosis hos rotter (0,2 mL af 100 mg/mL fluorescein natrium) og øgede det gradvist til 1 mL. Der blev registreret et stærkt fluorescens signal ved denne dosis. Doseringen blev gradvist forøget for at teste, om fluorescensen forbedres-hvilket ikke var tilfældet. Forfatterne besluttet at fortsætte med 1 mL af 100 mg/mL fluorescein natrium13.
Et andet farvestof til rådighed til at undersøge fartøjer intraoperativt er ICG. Dens størrelse er 775 kDa og så næppe trænger de omgivende væv14. På grund af sin længere emission bølgelængder, væv er trængt lettere, fordi væv er mere gennemsigtige på 800 nm19 og dybere strukturer bliver synlige14,16. Excitation bølgelængde inden for 750-800 nm er påkrævet16,20 og emissionen bølgelængde fra kontrastmidlet er ca 800 nm16, hvilket gør begge usynlige for det menneskelige øje. På grund af sin korte Half-Life tid i blodplasma, kan farvestoffet injiceres og genbruges gentagne gange16. Begrænsninger for at bruge dette farvestof omfatter problemer med tyk-walled arterier20 og nødvendigheden af lys uden for det synlige spektrum13. Som følge heraf er ICG afhængig af dyrt udstyr og ikke umiddelbart anvendelig i alle laboratorier.
Afslutningsvis, FVA er en hurtig, billig og pålidelig metode med høj følsomhed over for skærm patency af aneurismer og forælder arterier i gnavere aneurisme modeller. Det er forbundet med stort set ingen sygelighed og dødelighed. Det giver mulighed for realtidsovervågning af blodgennemstrømningen under kirurgi og opfølgning. For at forbedre virkningen skal injektionen udføres i mørke og udføres bedst på omhyggeligt dissekerede fartøjer. Denne metode kan nemt og sikkert implementeres i et cerebrovaskulær laboratorium, og kan minimere eksperiment omkostninger.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Alle forfattere bekræfter, at der ikke er interessekonflikter.
Acknowledgments
Denne undersøgelse blev delvis støttet af et forskningsstipendium fra Kantonsspital Aarau, Schweiz.
Materials
| Name | Company | Catalog Number | Comments |
| For rabbits | |||
| Aluminium foil | |||
| Animal shaver | |||
| Black tape | |||
| Blue filter | Thorlabs MF475-35 | ||
| Body warm plate | |||
| Camera | Sony NEX-5R | ||
| Catheter | 22G Vasofix Safety | ||
| Disinfictant | |||
| Fluorescein sodium | Fluorescein Faure 10% | ||
| Glas plate | |||
| Green filter | Thorlabs MF539-43 | ||
| Incontinence pad | |||
| Infusion pump | Perfusor Secura | ||
| Ketamine hydrochloride | any generic products | ||
| Needle | 25G | ||
| Oxygen | |||
| Ringer's Solution | |||
| Sterile sheets | |||
| Surgical instruments | micro forceps, micro scissor, blunt surgical scissor | ||
| Surgical microscope | OPMI, Carl Zeiss AG, Oberkochen, Germany | ||
| Syringe 2ml, 5ml, 50ml | |||
| Tape | |||
| Three-way-stopcock | |||
| Torch light | |||
| Xylazin | any generic products | ||
| For rats | |||
| Aluminium foil | |||
| Animal shaver | |||
| Black tape | |||
| Blue filter | Thorlabs MF475-35 | ||
| Body warm plate | |||
| Camera | Sony NEX-5R | ||
| Disinfictant | |||
| Fluorescein sodium | Fluorescein Faure 10% | ||
| Green filter | Thorlabs MF539-43 | ||
| Incontinence pad | |||
| Isoflurane | |||
| Ketamine hydrochloride | any generic products | ||
| Medetomidine hydrochloride | any generic products | ||
| Needle | 25G | ||
| Oxygen | |||
| Plate | |||
| Ringer's Solution | |||
| Sterile sheets | |||
| Surgical instruments | micro forceps, micro scissor, blunt surgical scissor | ||
| Surgical microscope | OPMI, Carl Zeiss AG, Oberkochen, Germany | ||
| Syringe 2ml, 5ml | |||
| Tape | |||
| Torch light |
References
- Kakucs, C., Florian, I. A., Ungureanu, G., Florian, I. S. Fluorescein Angiography in Intracranial Aneurysm Surgery: A Helpful Method to Evaluate the Security of Clipping and Observe Blood Flow. World Neurosurgery. 105, 406-411 (2017).
- Ajiboye, N., Chalouhi, N., Starke, R. M., Zanaty, M., Bell, R. Unruptured Cerebral Aneurysms: Evaluation and Management. ScientificWorldJournal. 2015, 954954 (2015).
- Suzuki, K., et al. Confirmation of blood flow in perforating arteries using fluorescein cerebral angiography during aneurysm surgery. Journal of Neurosurgery. 107 (1), 68-73 (2007).
- Gruter, B. E., et al. Fluorescence Video Angiography for Evaluation of Dynamic Perfusion Status in an Aneurysm Preclinical Experimental Setting. Operative Neurosurgery. , Hagerstown. (2019).
- Raabe, A., et al. Prospective evaluation of surgical microscope-integrated intraoperative near-infrared indocyanine green videoangiography during aneurysm surgery. Journal of Neurosurgery. 103 (6), 982-989 (2005).
- Riva, M., Amin-Hanjani, S., Giussani, C., De Witte, O., Bruneau, M. Indocyanine Green Videoangiography in Aneurysm Surgery: Systematic Review and Meta-Analysis. Neurosurgery. , (2017).
- Kuroda, K., et al. Intra-arterial injection fluorescein videoangiography in aneurysm surgery. Neurosurgery. 72, 2 Suppl Operative 141-150 (2013).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving Bioscience Research Reporting: The ARRIVE Guidelines for Reporting Animal Research. PLOS Biology. 8 (6), 1000412 (2010).
- Marbacher, S., et al. The Helsinki rat microsurgical sidewall aneurysm model. Journal of Visualized Experiments. (92), e51071 (2014).
- Marbacher, S., et al. Complex bilobular, bisaccular, and broad-neck microsurgical aneurysm formation in the rabbit bifurcation model for the study of upcoming endovascular techniques. American Journal of Neuroradiology. 32 (4), 772-777 (2011).
- Shurey, S., et al. The rat model in microsurgery education: classical exercises and new horizons. Archives of Plastic Surgery. 41 (3), 201-208 (2014).
- Foster, S. D., Lyons, M. S., Runyan, C. M., Otten, E. J. A mimic of soft tissue infection: intra-arterial injection drug use producing hand swelling and digital ischemia. World Journal of Emergency Medicine. 6 (3), 233-236 (2015).
- Flower, R. W. Injection technique for indocyanine green and sodium fluorescein dye angiography of the eye. Investigative Ophthalmology & Visual Science. 12 (12), 881-895 (1973).
- Yoshioka, H., et al. Advantage of microscope integrated for both indocyanine green and fluorescein videoangiography on aneurysmal surgery: case report. Neurologia medico-chirurgica (Tokyo). 54 (3), 192-195 (2014).
- Ichikawa, T., et al. Development of and Clinical Experience with a Simple Device for Performing Intraoperative Fluorescein Fluorescence Cerebral Angiography: Technical Notes. Neurologia medico-chirurgica. 56 (3), 141-149 (2016).
- Alander, J. T., et al. A review of indocyanine green fluorescent imaging in surgery. International Journal of Biomedical Imaging. 2012, 940585 (2012).
- Lane, B., Bohnstedt, B. N., Cohen-Gadol, A. A. A prospective comparative study of microscope-integrated intraoperative fluorescein and indocyanine videoangiography for clip ligation of complex cerebral aneurysms. Journal of Neurosurgery. 122 (3), 618-626 (2015).
- Blair, N. P., Evans, M. A., Lesar, T. S., Zeimer, R. C. Fluorescein and fluorescein glucuronide pharmacokinetics after intravenous injection. Investigative Ophthalmology & Visual Science. 27 (7), 1107-1114 (1986).
- Hillmann, D., et al. In vivo optical imaging of physiological responses to photostimulation in human photoreceptors. Proceedings of the National Academy of Sciences of the United States of America. 113 (46), 13138-13143 (2016).
- Golby, A. J. Image-Guided Neurosurgery. , Elsevier Science. (2015).



