Summary
Denne protokollen bruker G6PI blandede peptider for å konstruere revmatoid artritt modeller som er nærmere den av menneskelig revmatoid artritt i CD4+ T celler og cytokiner. Høy renhet invariant naturlige killer T celler (hovedsakelig iNKT2) med spesifikke fenotyper og funksjoner ble oppnådd ved in vivo induksjon og in vitro rensing for adoptivimmunterapi.
Abstract
Revmatoid artritt (RA) er en kompleks kronisk inflammatorisk autoimmun sykdom. Sykdomspatogenesen er relatert til invariant naturlige killer T (iNKT) celler. Pasienter med aktiv RA presenterer færre iNKT-celler, defekt cellefunksjon og overdreven polarisering av Th1. I denne studien ble det etablert en RA-dyremodell ved hjelp av en blanding av hGPI325-339 og hGPI469-483 peptider. INKT-cellene ble oppnådd ved in vivo induksjon og in vitrorensing, etterfulgt av infusjon i RA-mus for adoptivimmunterapi. In vivo bildesystem (IVIS) sporing viste at iNKT celler ble hovedsakelig distribuert i milt og lever. På dag 12 etter cellebehandling bremset sykdomsprogresjonen betydelig, de kliniske symptomene ble lindret, overflodav iNKT-celler i thymus økte, andelen iNKT1 i thymus redusert, og nivåene av TNF-α, IFN-γ og IL-6 i serumet redusert. Adoptivimmunterapi av iNKT-celler gjenopprettet balansen mellom immunceller og korrigert ei overdreven betennelse i kroppen.
Introduction
Revmatoid artritt (RA) er en autoimmun sykdom preget av kronisk, progressiv invasivhet med 0,5–1 % insidens1,2. Den underliggende patogenesen tilskrives unormal spredning av autoreaktive CD4+ og CD8+ T-celler, manifestert av en økning i andelen CD4+IFN-γ+ og CD4+IL-17A+ T-celler, og redusert antall CD4+IL-4+ og CD4+CD25+FoxP3+ T-celler. Derfor øker sekresjonen av inflammatoriske cytokiner, og en overdreven inflammatorisk reaksjon ødelegger den innfødte balansen og toleransefunksjonen til kroppens immunsystem. Videre hjelperen T lymfocytter (Th) 1 celler som trenger inn i leddet forverre inflammatorisk respons og leddskade. Derfor er hemming av overdreven inflammatorisk respons og restaurering av immuntoleranse og immunbalanse nøkkelen til behandling av RA3,4.
INKT-cellene har både NK-celle- og T-cellefunksjoner og egenskaper. INKT-cellene har en distinkt, invariant T cellereseptor (TCR) α-kjede med begrenset TCR β-kjede repertoar5 og gjenkjenner glykolipidantigenet presentert av det store histokompatibilitetskomplekset (MHC) klasse I molekyl CD1d på overflaten av antigenpresenterende celler. Mitsuo et al.6 oppdaget et stort antall iNKT-celler og funksjonsfeil i mange autoimmune sykdommer, inkludert RA. Aurore et al.7 viste at iNKT-celler har en positiv effekt på å opprettholde autoimmun toleranse, og at når antall et tall og funksjon av iNKT-celler gjenopprettes, lindres sykdommen. I tillegg fant Miellot-Gafsou et al.8 at iNKT-celler ikke bare avskaffet sykdommen, men også økte sykdomsprogresjonen. Disse motstridende resultatene tyder på at iNKT-celler er heterogene T-celler, og funksjonen til forskjellige undergrupper kan reverseres. I en klinisk studie av RA korrelerte hyppigheten av iNKT-celler med poengsummen av sykdomsaktiviteten9. Resultatene bekreftet også at frekvensen av iNKT ble redusert hos RA-pasienter, antall CD4+IFN-γ+ T celleundergrupper økte, og sekretoriske nivåer av inflammatoriske cytokiner IFN-γ og TNF-α økte10,11. I tillegg undersøkte Sharif et al.12 type 1 diabetes (T1D) og fant at selektiv infusjon av iNKT-celler oppregulerte uttrykket av inflammatorisk cytokin IL-4, opprettholdt immuntoleranse og forhindret utviklingen av type 1 diabetes. Derfor øker adoptivinfusjon av spesifikke iNKT-celler eller målrettet aktivering av iNKT-celler nivået av iNKT-celler hos RA-pasienter, noe som kan være et gjennombrudd i RA-behandling.
Cellulær immunterapi er for tiden av stor interesse og har blitt mye brukt i kreftbehandling. INKT-celler er imidlertid sjeldne, heterogene immunregulatoriske celler (bare 0,3% av det totale antallet PBMCer)13, som begrenser potensielle kliniske applikasjoner. Disse cellene er hovedsakelig delt inn i tre underpopulasjoner: 1) iNKT1 celler, som har et høyt uttrykk for promyelocytisk leukemi sink-finger protein (PLZF) og T-boks transkripsjonfaktor (T-bet); 2) iNKT2 celler med mellomliggende uttrykk for PLZF og GATA bindende protein 3 (GATA3); 3) iNKT17 celler med lavt uttrykk for PLZF og retinoid-relaterte foreldreløse kjernefysiskreseptor (ROR)-γt som skiller IFN-γ, IL-4, og IL-1714. Aktiverte iNKT-celler skiller ut Th1, Th2 og Th17-lignende cytokiner, som bestemmer de forskjellige immunmodulatoriske effektene av iNKT-celler15. Immunmodulerende og immunterapeutiske effekter av spesifikk aktivering av ulike underpopulasjoner av iNKT-celler er forskjellige. Derfor kan valg av spesifikke fenotyper av iNKT-celler (hovedsakelig iNKT2) med antiinflammatoriske funksjoner for å regulere immunresponsen i kroppen korrigere immunubalansen og immunsykdommer i RA.
Etableringen av en ideell dyremodell er av stor betydning for behandling og studier av RA patogenese. For tiden inkluderer de mest brukte og modne dyremodellene kollagenindusert artritt, adjuvant artritt, zymosan-indusert artritt og polysakkaridindusert artritt16–17. Det er imidlertid ingen modell som fullt ut kan simulere alle funksjonene i menneskelig RA. Type II kollagen-indusert artritt (CIA) er en klassisk leddgikt modell. CIA induseres av immunisering av mus med type II kollagenspesifikke monoklonale antistoffer, noe som gjenspeiler antistoffavhengigheten til denne sykdomsmodellen. Benurs et al. beskrev en modell med systemisk immunrespons mot glukose-6-fosfat isomerase (G6PI), som induserer perifer symmetrisk polyartritt hos mottakelige musestammer18,19. I denne modellen avhenger utviklingen av leddgikt på T-celler, B-celler og medfødt immunitet18,19,20. Horikoshi21 fant at RA-modeller som følge av immunisering av DBA/1 mus med G6PI polypeptidfragmenter er mer lik menneskelig RA når det gjelder CD4+ T-celler og cytokiner (dvs. IL-6 og TNF-α) enn CIA-modellene. For å øke den stimulerende effekten på TCR-gjenkjenningsstedet, ble de blandede polypeptidfragmentene av G6PI (hGPI325-339 og hGPI469-483) brukt til å immunisere DBA/1 mus for å konstruere RA-musemodellen. Suksessraten for denne tilnærmingen kan høy fordi hGPI325-339 og hGPI469-483 er immundominerende for I-A q-begrenset T celle respons. Derfor kan denne modellen simulere overproliferation av CD4+ T-celler og iNKT celledefekter hos RA-pasienter22. Den grunnleggende forskningen på RA immunopathology la grunnlaget for vår videre grundige undersøkelse.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Alle eksperimentelle mus (totalt 150) var friske mannlige DBA/1 mus, 6–8 uker gamle (20,0 ± 1,5 g), oppdratt i et bestemt patogenfritt (SPF)-miljø. Det er ingen spesiell behandling før modellering. Eksperimentet ble delt inn i en sunn kontrollgruppe (15 mus), en modellkontrollgruppe (15 mus) og en celleterapigruppe (55 mus). Denne studien ble godkjent av Dyrevelferds- og etisk komité ved Hebei University.
1. Konstruere sykdomsmodellen
- Duplisere RA-dyremodellen
- Vekt 1,75 mg både hG6PI 325-339 og hG6PI 469-483 fragmenter og oppløs dem i 5,25 ml 4 °C trippeldestillert vann.
- Oppløs Freunds adjuvans (CFA) i et vannbad på 50 °C, trekk 5,25 ml inn i et annet 10 ml sentrifugerør, og avkjøl det for bruk.
- Sett blandingen av hG6PI-oppløsning og CFA-løsning i en kunstig emulgeringsenhet med to glasssprøyter tilkoblet.
- Skyv sprøyten med en konstant hastighet og frekvens på 10–20x per min for å fullstendig emulgere blandet peptidløsning og CFA-oppløsning. Utfør operasjonen i et isbad, og hold emulsjonsdråpene i vannet i 10 minutter etter ferdigstillelse av emulgeringen uten å spre seg.
- Injiser 150 μL emulgerte hG6PIer i musens halerot subkutant.
- Injiser 200 mg pertussetoksin i musen intraperitonealt ved 0 t og 48 timer etter hG6PI injeksjon.
- Eksperimentell verifisering av RA-modellen
- Mål tykkelsen på musens pote med en Vernier-kaliper (2x om dagen).
- Vær oppmerksom på og merk graden av rødhet og hevelse i foten. Bruk følgende poengberegningskriterier: 1) tær med mild hevelse; 2) dorsum pedis og fotpute med klar rød hevelse; 3) ankel med rød hevelse.
- Euthanize musene under dyp anestesi ved intraperitoneal injeksjon av 1% natrium pentobarbital (50 mg /kg kroppsvekt) 14 dager etter modellering og fjerne potene for HE farging.
- Bestem sekresjonsnivåene av serum IL-2, IL-4, IL-6, IL-10, IL-17A, TNF-α og IFN-γ ved hjelp av en kommersiell cytometrisk perlematrise (CBA) analyse i henhold til produsentens protokoll.
2. Få iNKT-celler med adoptivcellulær terapi
- Retningsbestemt induksjon av iNKT-celler
- Injiser normale mus intraperitonealt med α-GalCer (0,1 mg/kg kroppsvekt).
- Isolering av iNKT-celler
- Tre dager etter modellering injiserer du mus intraperitonealt med 1 % natriumpentobarbital (50 mg/kg kroppsvekt) for beøvelse. Tilstrekkelig bedøvet mus viser ikke en bakpoteuttaksrespons på en tåklype.
- Isoler milten til en DBA/1-mus etter å ha injisert den intraperitonealt med α-GalCer. Forbered en enkeltcellesuspensjon ved å kutte og slipe milten i en 200 mesh sikt.
- Vask cellesuspensjonen med PBS, sentrifuge ved 200 x g i 5 min, og kast supernatanten. Gjenta.
- Resuspender cellene med 1 ml fullblod og vevfortynningsløsning. Tilsett 3 ml separasjonsmedium for muslymfocytter, og sentrifuge cellene i 20 min ved 300 x g ved romtemperatur.
- Samle laget av melkehvite lymfocytter (dvs. det andre laget fra toppen), vask det 2x med PBS, og tell med en automatisert celleteller.
- Magnetisk aktivert cellesortering (MACS)positiv utvelgelsesstrategi for rensing av iNKT-celler
MERK: For forbehandling av CD1d tetramers ble 1 mg/ml α-Galcer fortynnet til 200 μg/ml med 0,5 % av Tween-20 og 0,9 % av NaCl, og 5 μL av den resulterende løsningen ble lagt til 100 μL av CD1d tetramer-løsningen. Blandingen ble inkubert i 12 timer ved romtemperatur og plassert ved 4 °C for bruk. TCR β ble fortynnet 80x med deionisert vann. Alle andre antistoffer ble brukt som en lagerløsning.- Resuspender 107 celler med 100 μL 4 °C PBS, tilsett 10 μL α-GalCer-l-lastet CD1d Tetramer-PE, og inkuber dem ved 4 °C i 15 min i mørket.
- Vask cellene 2x med PBS og resuspender dem i 80 μL PBS.
- Tilsett 20 μL anti-PE-mikroperler og inkuber dem ved 4 °C i 20 minutter i mørket.
- Vask dem 2x med PBS og resuspender cellene med 500 μL PBS.
- Plasser sorteringskolonnen i magnetfeltet på MACS-sortereren og skyll med 500 μL PBS.
- Tilsett cellesuspensjonen fra trinn 2.3.4 i sorteringskolonnen, samle gjennomstrømningen og skyll 3x med PBS-buffer.
- Fjern magnetfeltet og samle cellene fra sorteringskolonnen. På dette punktet legger du til 1 ml PBS-buffer til sorteringskolonnen, og skyv stempelet raskt med et konstant trykk for å drive de merkede cellene til samlingsrøret og få rensede iNKT-celler. Tell med en automatisert celleteller.
- Identifikasjon av iNKT-cellefenotypen
- Ta 1 x 106 celler fra trinn 2,2,5 og 2,3,7, og resuspender dem på nytt i 50 μL PBS.
- Antistoffinkubasjon: Ikke tilsett antistoffet til det negative kontrollrøret, tilsett 0,5 μL α-GalCer-PE-CD1d Tetramer eller 10 μL FITC-TCR β i det ene positive kontrollrøret. Tilsett 0,5 μL α-GalCer-PE-CD1d tetramer og 10 μL FITC-TCR β i prøverøret. Inkuber dem ved 4 °C i 30 min i mørket.
- Vask cellene i PBS og deretter sentrifuge på 200 x g i 5 min.
- Kast supernatanten, tilsett 1 ml Foxp3 Foxation/Permeabilization arbeidsløsning, og inkuber cellene i 45 min ved 4 °C i mørket.
- Tilsett 1 ml 1x permeabilisering Buffer arbeidsløsning og sentrifuge cellene ved romtemperatur i 500 x g ved romtemperatur i 5 min.
- Kast supernatanten. Tilsett 1 μL Alexa Fluor 647 mus Anti-PLZF og 1 μL perCP-Cy 5,5 mus anti-T-bet (eller 1 μL PerCP-Cy 5,5 mus anti-RORΥt) i 30 min ved romtemperatur i mørket.
- Legg til 2 ml permeabiliseringbufferarbeidsløsning for rengjøring.
- Kast supernatanten, resuspender cellene i 500 μL PBS, og mål ved flytcytometri.
- Funksjonell identifisering av iNKT-celler
- Ta 3 x 106 iNKT celler fra trinn 2.3.7 og resuspenddem i 12 brønnplater med 1,5 ml RPMI-1640 ufullstendig medium (dvs. uten serum).
- Tilsett phorbol ester (PMA, 50 ng / ml) og ionomycin kalsium (IO, 1 μg / ml) og plasser i en CO2 inkubator for 24 timer.
- Samle cellen supernatant og oppdage sekresjonnivåer av IL-2, IL-17A, TNF-α, IL-6, IL-4, IFN-γ, og IL-10 ved hjelp av en kommersiell CBA analyse i henhold til produsentens protokoll.
- Eksperimentell studie om migrasjonsveien til iNKT-celler i RA-mus
- Oppløs DiR-dye (2,5 mg/ml) i DMSO.
- Resuspender iNKT-celler i 6 brønnplater med RPMI-1640 ufullstendig medium. Tettheten er 1 × 106 celler/ml.
- Tilsett DiR (5 μg/ml) oppløsning og inkubator i en CO 2-inkubator i 25 min.
- Vask med PBS og resuspender cellene (3 x 106/300 μL) for å få DiR-merkede iNKT-celler (DiR-iNKT).
- Injiser 1 % natriumpentobarbital (50 mg/kg kroppsvekt) intraperitonalt for å bedøve musene. Tilstrekkelig bedøvet mus viser ikke en bakpotetilbaketrekking til tåklemme. Påfør veterinærsalve på museøynene for å forhindre tørrhet mens du er under anestesi for bildebehandling.
- Injiser DiR-iNKT celler 3 x 106 per mus i halevenen med RA-modellen i 8 dager. Overvåk iNKT-cellene i mus etterinjeksjon i 0 min, 10 min, 30 min, 60 min og dag 0 (etter 3 timer), 1, 3, 6, 12, 26, 34, 38 og 42 dager ved hjelp av et lite in vivo bildesystem (IVIS). Eksitasjonsbølgelengden som ble brukt var 748 nm, utslippsbølgelengden var 780 nm, og eksponeringstiden var automatisk.
- Plasser hver mus i et eget bur etter hver observasjon og opprettholde sternal recumbency. Observer til utvinning fra anestesi.
3. Evaluering av adoptivimmunterapi av RA-mus med iNKT-celler
- iNKT celle adoptiv immunterapi for RA mus
- Injiser 3 x 106 celler iNKT celler per mus gjennom halevenen. Tilfeldig velge 15 mus som ble modellert 8 dager før og få iNKT celler uten DiR merking fra trinn 2.3.7 av halen vene infusjon.
- Evaluer effekten av adoptivimmunterapi for iNKT-celler.
- Mål tykkelsen på musens pote, kvantifiser hevelsen i ankelleddet, og score systematisk etter infusjonen av iNKT-celler som beskrevet i trinn 1.2.1-1.2.2.
- Vær oppmerksom på inflammatorisk celleinfiltrasjon og leddendringer i museleddene som beskrevet i trinn 1.2.3.
- Bestem sekresjonsnivåene til IL-2, IL-4, IL-6, IL-10, IL-17A, TNF-α og IFN-γ som beskrevet i trinn 1.2.4.
- Bestem frekvensen av iNKT-celler og undersett.
- Isoler musen thymus og forberede en enkelt celle suspensjon.
- Skill lymfocytter med lymfocytt separasjonsvæske.
- Bestem iNKT cellefrekvens og undergruppefrekvens som beskrevet i trinn 2.4.
- Statistisk analyse
MERK: Alle data presenteres som gjennomsnittlige ± SD. Verdier av P < 0,05 ble ansett som statistisk signifikante.- Bruk enfaktoranalyse av varians (ANOVA). Hvis variansen er oppfylt, bruker du LSD-testen for videre sammenligning.
- Hvis variansen ikke er ensartet, bruker du den ikke-parametriske testen. Bruk Kruskal-Wallis H-testen for videre sammenligning31.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Leddgikt indeks score og pote tykkelse økte etter modellering. Sammenlignet med kontrollgruppen begynte tærne i RA-modellgruppen å vise rød hevelse ved 6 dager etter modellering, med gradvis forverring. Ved 14 dager toppet den røde hevelsen i ankelleddet, etterfulgt av gradvis lettelse. Tykkelsen på poten endret seg på samme måte (P < 0,05) (Figur 1).
Den inflammatoriske celleinfiltrasjonen økte betydelig etter modellering. De patologiske resultatene viste at infiltrasjonsgraden av inflammatoriske celler i ankelsynovialvevet i RA-modellmusene var forskjellige på forskjellige stadier. Toppbetennelse oppstod på dag 14 etter modellering (Figur 2).
Inflammatoriske cytokiner økt og antiinflammatoriske cytokiner redusert i serum. I RA-modellgruppen økte serumnivåene av proinflammatoriske cytokiner (TNF-α, IFN-γ og IL-6) betydelig (P < 0,05), mens antiinflammatoriske cytokiner (IL-4 og IL-10) signifikant redusert (P < 0,05) (Figur 3).
INKT-cellene oppnådd ved in vivo induksjon og in vitro rensing besto hovedsakelig av iNKT2 celleundergrupper, som skiller ut antiinflammatoriske cytokiner. Intraperitoneal injeksjon av α-GalCer økte hyppigheten av iNKT-celler i kroppen, hovedsakelig iNKT2-undergruppen. Hyppigheten av milt iNKT-celler i normale DBA/1-mus var ca. 2 % av lymfocytter, (iNKT2 var ca. 5 %, iNKT1 ca. 15 %, iNKT17 ca. 10 %). Tre dager etter intraperitoneal injeksjon av α-GalCer, hyppigheten av iNKT celler var ca 6% av lymfocytter, (iNKT2 var ca 82%, iNKT1 ca 1,5%, og iNKT17 ca 0,5%). Etter rensing av MACS var renheten til iNKT-celler over 85%, hvorav iNKT2 var ca 92%, iNKT1 ca 0,4%, og iNKT17 ca 0,2% (figur 4).
De høstede iNKT-cellene utskilles mer antiinflammatoriske cytokiner og færre inflammatoriske cytokiner. INKT-cellene ble isolert fra miltene til normale mus og intraperitonealt injisert med α-GalCer 3 dager etter at musmilten (α-GalCer-gruppen) og cytokinnivåene i cellekulturen supernatant ble undersøkt. Sammenlignet med kontrollgruppen reduserte de inflammatoriske cytokinene (IL-17A, TNF-α, IFN-γ og IL-6) i α-GalCer-gruppen betydelig (P < 0,05), og det antiinflammatoriske cytokinIL-4-nivået økte betydelig (P < 0,05). Det var ingen signifikant forskjell i IL-10 (P > 0,05). IFN-γ/IL-4-forholdet ble signifikant redusert (P < 0,05) (figur 5).
IVIS-sporing bekreftet at DiR-iNKT-celler ble adoptivinfundert til RA-mus og dukket umiddelbart opp i lungene etterinjeksjon. Fluorescens ble påvist i leveren ved 10 min og i milten ved 60 min(figur 6AI, 6AII, 6AIII). I de isolerte organene var det ingen fluorescens i thymus og inguinal lymfeknuter innen 1 t. Fluorescens ble oppdaget i lungene ved 0 min, fluorescensintensiteten var størst ved 10 min, og deretter gradvis svekket. Det var svak fluorescens i leveren ved 0 min, og så økte den gradvis. Fluorescensen i milten ble påvist ved 30 min og økte gradvis (figur 6AIV, 6C).
Etter infusjonen av DiR-iNKT-celler i RA-mus var fluorescens hovedsakelig konsentrert i leveren og milten (figur 6BI, 6BII, 6BIII),men det var ingen fluorescens i thymus og inguinal lymfeknuter. Milten og leveren hadde den høyeste fluorescensintensiteten på dag 1 etter celleinfusjon, men den ble gradvis svekket. På dag 34 forsvant overflatefluorescensen. På dag 42 forsvant fluorescensen til de isolerte organene. Gjennomsnittlig fluorescenssignalintensitet av leveren etter celleinfusjonen var høyere enn milten (figur 6BIV, 6D).
Adoptivinfusjon av iNKT-celler i RA-mus kan lindre sykdomsprogresjon og forbedre kliniske symptomer. INKT-cellene forbedret de kliniske symptomene på RA-mus etter adoptivinfusjon. Sammenlignet med den ubehandlede RA-modellgruppen ble hevelsen i ankelleddet lettet i cellebehandlingsgruppen, og resultatene ble betydelig redusert fra dag 10 til dag 20 etterinjeksjon. I samme periode i cellebehandlingsgruppen ble inflammatorisk celleinfiltrasjon i synovialvevet redusert i forhold til RA-modellgruppen (figur 2).
Suksessratene for thymus iNKT-celler økte betydelig (P < 0,05). Sammenlignet med den sunne kontrollgruppen, i RA-modellgruppen, redusertfrekvensen av iNKT-celler i thymus ved fremdriften (dag 11), topp (dag 14) og utvinning (dag 20) stadier. På toppen betennelse, disse verdiene var minimal og rebounded i remisjonsfasen. Celleterapigruppen viste signifikant økte forekomster av iNKT-celler på det høyeste (dag 14) og utvinning (dag 20) stadier sammenlignet med RA-modellgruppen (P < 0,05) (Figur 7).
Etter iNKT celleinfusjon, suksessraten på iNKT1 og iNKT17 i thymus redusert og iNKT2 økt. Sammenlignet med kontrollgruppen, i RA-modellgruppen på dag 11 iNKT1 og iNKT17 i thymus, økte betydelig (P < 0,05), og iNKT2 betydelig redusert (P < 0,05). På dag 14, iNKT1 og iNKT2 i thymus betydelig økt(P & lt; 0,05) og iNKT17 betydelig redusert (P & lt; 0,05). På dag 20, iNKT1 i thymus betydelig økt (P < 0,05), iNKT2 ikke signifikant endring (P > 0,05), og iNKT17 betydelig redusert (P < 0,05). iNKT1/iNKT2-forholdet økte betydelig i alle tre stadiene(P < 0,05).
Sammenlignet med RA-modellgruppen, på dag 11 i α-GalCer og celleterapigruppene, var iNKT1 og iNKT17 signifikant lavere (P < 0,05) og iNKT2 betydelig økt (P < 0,05). På dag 14, i α-GalCer-gruppen iNKT1 og iNKT17 betydelig redusert (P < 0,05), og iNKT2 ikke signifikant endring (P > 0,05); i celleterapigruppen iNKT1 og iNKT17 ble signifikant redusert (P < 0,05) og iNKT2 økte signifikant (P < 0,05). På dag 20, i α-GalCer-gruppen, reduserte iNKT1 betydelig (P < 0,05), iNKT2 endret seg ikke betydelig (P > 0,05), og iNKT17 økte betydelig (P < 0,05); i celleterapigruppen iNKT1 og iNKT17 ble signifikant redusert (P < 0,05) og iNKT2 økte signifikant (P < 0,05). Forholdet mellom iNKT1/iNKT2 ble signifikant redusert i alle tre stadiene(P < 0,05) (figur 7).
Nivåene av inflammatoriske cytokiner ble økt i serum og de antiinflammatoriske cytokinene ble redusert etter iNKT celleinfusjon. I RA-modellgruppen økte nivåene av TNF-α, IFN-γ og IL-6in serum betydelig (P < 0,05), mens IL-4 og IL-10 viste markert reduserte mengder (P < 0,05) sammenlignet med kontrollgruppen. I iNKT celleterapigruppen, nivåene av TNF-α, IFN-γ, og IL-6 i serum betydelig redusert ved fremdrift og topp stadier av betennelse (P < 0,05), mens IL-4 og IL-10 betydelig økt (P < 0,05) i sammenligning med RA modellgruppen (Figur 3).
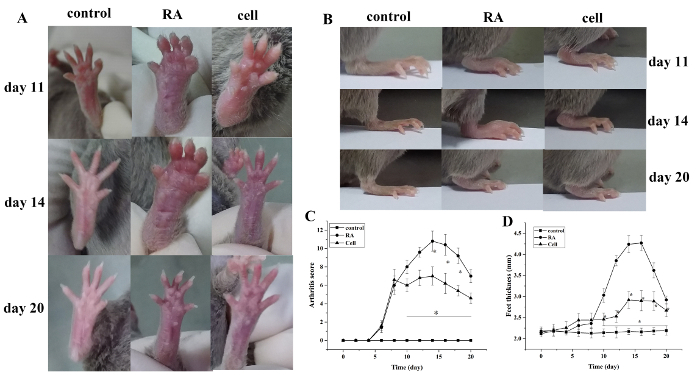
Figur 1: Leddhevelsespoengsummen og potetykkelsen endres hos mus. (A) Hevelse i ankelleddet hos mus. - Jeg har ikke noe åsi. Potetykkelse i forskjellige grupper. (C) Endringer i klinisk poengsum i ulike grupper. Poengsummen for musleddgikt og tykkelsen på poten ble signifikant redusert i celleterapigruppen på dag 10–20 (dvs. 2–12 dager etter behandling) etter modellering. *P < 0,05 vs. kontroll, **P < 0,05 vs. RA. Vennligst klikk her for å vise en større versjon av dette tallet.

Figur 2: Histopatologiske forandringer i ankelleddet. Infiltrasjon av inflammatoriske celler ble signifikant redusert i celleterapigruppen og ble betydelig økt i RA-gruppen på dag 14. ◊ = inflammatoriske celler. (A) 100x (B) 400x. Vennligst klikk her for å vise en større versjon av dette tallet.

Figur 3: Nivåene av serumcytokiner i hver gruppe. (A) Serum cytokiner nivåer hos mus på dag 11 etter modellering (pg / ml). (B) Serum cytokiner nivåer hos mus på dag 14 etter modellering (pg / ml). Nivåene av TNF-α, IFN-γ og IL-6 ble betydelig redusert, og nivåene av IL-4 og IL-10 økte signifikant i celleterapigruppen. enP < 0,05 vs. kontroll. bP < 0,05 vs. RA. Vennligst klikk her for å vise en større versjon av dette tallet.

Figur 4: Frekvensen av iNKT-celler og andel iNKT celleundergrupper. - Jeg har ikke noe åsi. Frekvensen av iNKT2 hos normale mus er ~ 5%. - Jeg har ikke noe åsi. Frekvensen av iNKT2 er ca 82% etter in vivo induksjon. (G, H, I) Frekvensen av iNKT2 er mer enn 92% etter MACS rensing. Vennligst klikk her for å vise en større versjon av dette tallet.

Figur 5: Cytokinnivåer i kultur supernatant av mus milt-avledet iNKT celler. Nivået på IL-4 økte betydelig, og nivåene av IL-17A, TNF-α, IFN-γ og IL-6 ble betydelig redusert. enP < 0,05 vs. kontroll. Vennligst klikk her for å vise en større versjon av dette tallet.

Figur 6: Distribusjon og metabolisme av iNKT-celler spores av caliper IVIS lumina II. - Jeg har ikke noe åsi. Overføringsbanen til iNKT-celler. (C) Endringen av gjennomsnittlig fluorescenssignalintensitet i milten, leveren og lungene. (D) Endringen av gjennomsnittlig fluorescenssignalintensitet i milten og leveren. Fluorescensen ble påvist i lungene og leveren ved 0 min, og deretter gradvis økt. Fluorescensintensiteten var sterkest ved 10 min i lungene og deretter redusert. Fluorescensen til milten ble oppdaget ved 30 min, deretter gradvis økt. Fluorescensen til alle organer forsvant på dag 42. Den gjennomsnittlige fluorescenssignalintensiteten i leveren er høyere enn milten etter celleinfusjon (I: supine; II: lateral liggende; III: utsatt; IV: isolert vev; a: kontrollgruppe; b: celleinfusjonsgruppe; 1, 2, 3, 4, 5 er thymus, milt, lever, inguinal lymfeknuter, lunger). Vennligst klikk her for å vise en større versjon av dette tallet.

Figur 7: Frekvensen av iNKT og dens undergrupper i musen thymus. (A) Frekvensen av iNKT celler på 11, 14 og 20 dager etter modellering. (B) Forholdet mellom iNKT1/iNKT2. - Jegharikke noe å si. Frekvensen av iNKT1, iNKT2 og iNKT17. På dag 11, 14 og 20 (dag 3, 6 og 12 etter cellebehandling), økte forekomsten av iNKT-celler betydelig, iNKT1 og iNKT17 av thymus signifikant redusert i celleterapigruppen, og iNKT2 ble betydelig økt. enP < 0,05 vs Kontroll. bP < 0,05 vs RA. Vennligst klikk her for å vise en større versjon av dette tallet.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
iNKT-celler er spesielle T-celler som bygger bro medfødte og adaptive immunitet og er hovedsakelig utviklet fra CD4++/CD8+ tyteocytter. iNKT-celler har ulike immunregulatoriske funksjoner og samhandler med andre immunceller ved direkte kontakt og sekresjon av forskjellige cytokiner23,som påvirker dendrittiske celler (DCer), makrofager, nøytrofiler, B-celler, T-celler og NK-celledifferensiering og utvikling24 . α-GalCer er en klassisk iNKT cellespesifikk aktivator ekstrahert fra svamper. Flere studier indikerer at milt iNKT cellefrekvens når en topp etter en enkelt intraperitoneal injeksjon av α-GalCer i 3 dager25. Våre eksperimentelle resultater viste overvekt av iNKT2-undergruppen hos mus milt i 3 dager etter en intraperitoneal injeksjon av α-GalCer, som hovedsakelig utskiller antiinflammatoriske cytokiner IL-4 og IL-10. Vi fant også at overflod av iNKT2 celler redusert og at av iNKT1 og iNKT17 celler økt i RA modell mus under den inflammatoriske fasen. Derfor isolerte vi iNKT-cellene i musmilten ved intraperitoneal injeksjon av α-GalCer i 3 dager. Disse ble brukt til å behandle RA-modellmusene. Frekvensen av iNKT2-undergruppen var 82% etter in vivo induksjon. Etter rensing av MACS, frekvensen av iNKT2 overskredet 92%.
Den spesifikke aktiveringen av iNKT-celler er ansatt som en ny biologisk behandling for RA. Horikoshi et al.21 viste at intradermal injeksjon av α-GalCer hemmet GPI peptid-indusert artritt ved å hemme antall CD4+ T-celler betydelig. Chiba et al.26 viste at gjentatte injeksjoner av syntetisk iNKT2 selektiv aktivator OCH hemmet CIA, mens α-GalCer viste en liten hemmende effekt. Vi injiserte milt-avledet iNKT i RA modell mus, og resultatene viste at graden av hevelse i ankelleddene i celleterapigruppen og antall inflammatoriske celler infiltrere i leddene ble redusert. Nivået av antiinflammatoriske cytokiner i serum (f.eks. IL-4 og IL-10) økte, og sekresjonen av proinflammatoriske cytokiner (f.eks. IFN-γ og TNF-α) ble redusert. målrettet aktivering av iNKT-celler var i stand til å lindre utviklingen av RA og hemme den inflammatoriske responsen. I tillegg oppdaget vi frekvensen av iNKT i thymus og fant at antall iNKT-celler i RA-modellgruppen ble betydelig redusert, mens frekvensen i thymus økte etter infusjon av iNKT-cellene. På grunn av tilstedeværelsen av blod-thymus barriere systemet, vi ikke vurdere adoptivinfundert økning i nivået av iNKT i thymus som ble bekreftet i senere eksperimenter. Videre påvisning av underpopulasjoner av iNKT-celler i thymus viste at sammenlignet med den sunne kontrollgruppen økte antall iNKT1-celler i RA-modellgruppen betydelig i løpet av de tre stadiene av betennelse og maksimalt under toppen av betennelse, mens andelen av iNKT2-undergruppen begynte å øke på toppen av betennelse. Spesielt kan iNKT1-undergruppen være involvert i tidlig betennelse i RA, og iNKT2-undergruppen kan spille en viktig rolle i å hemme betennelsen. Sammenlignet med RA-modellgruppen reduserte iNKT1-undergruppen i celleterapigruppen betydelig i den inflammatoriske fasen, og iNKT2-undergruppen økte betydelig i det tidlige og remisjonsstadiet av betennelse. Disse resultatene indikerte at adoptivinfusjon av spesifikke fenotyper og funksjonelle iNKT-celler økte frekvensen av iNKT-celler i RA og endret andelen iNKT-celleundergrupper.
Vi brukte IVIS til å observere fordelingen av iNKT-celler hos mus etter adoptivinfusjon og fant den høyeste fluorescensintensiteten i lungene 10 min etter infusjon, som falmet gradvis. Leveren viste svak fluorescens, som økte gradvis og redusert gradvis etter 2 dager. Fluorescens ble påvist i milten ved 30 min, som økte gradvis og redusert etter 2 dager. Den gjennomsnittlige fluorescensintensiteten i leveren var sterkere enn milten. Det ble imidlertid ikke oppdaget fluorescens i thymus og inguinale lymfeknuter. Påvisning av fluorescens i lungene kan tilskrives infusjonen av iNKT-celler i halevenen. Disse cellene sirkuleres til lungene med blodet. Leveren fluoresces tidligere enn milten, og gjennomsnittlig fluorescens intensitet i leveren er sterkere enn milten. Denne fortrinnsrett akkumulering av iNKT-cellene kan skyldes de rike blodkarene i leveren, det viktigste metabolske organet. Fluorescens ble ikke oppdaget i thymus. Dette kan skyldes den hematologiske barrieren, noe som kan hindre oppføring av iNKT-celler. Fluorescens ble aldri oppdaget i inguinal lymfeknuter, kanskje fordi færre iNKT-celler kom inn i lymfeknuter og ikke nådde minimumsnivået for deteksjon. Det kan også spekuleres i at iNKT-cellene som er infundert i halevenen, kanskje ikke kommer inn i lymfeknutene. Derfor hypoteser vi at utvikling og differensiering av iNKT-celler i thymus kan reguleres gjennom cytokinveier etter adoptivinfusjon i musene. Dette må belyses videre.
GPI er tilstede i serum og synovial væske hos de fleste RA-pasienter og er en vanlig test for klinisk RA diagnose27. Bruns et al.28 brukte peptider av forskjellige lengder fra GPI-sekvensen og immuniserte DBA/1-musene for å identifisere seks immunodominante T-celleepitoper. Av disse var tre arthritogenic. Peptider med > 95% forekomst av leddgikt er hGPI 325-339 og hGPI469-483. Våre tidligere studier viste at bruk av en blanding av de to peptidene for å etablere en RA-modell er bedre enn et enkelt peptid. I de resulterende RA-modellene begynte musenes tær og ledd å virke røde på dag 6 og nådde en topp av betennelse på dag 14. Den inflammatoriske celleinfiltrasjonen ble ledsaget av vevhyperplasi i leddenes synovialvev, og den inflammatoriske celleinfiltrasjonen var mest alvorlig på dag 14. Antall iNKT-celler ble redusert betydelig i thymus på toppen av betennelse, noe som var i samsvar med trenden med iNKT-celler hos RA-pasienter29. Videre påvisning av iNKT celleundergrupper viste at frekvensen av iNKT1 og iNKT17 i thymus økte og frekvensen av iNKT2 redusert under progresjon av betennelse (dag 11). I tillegg økte nivåene av serumcytokiner IFN-γ og IL-17A under progresjonen (dag 11) og toppen av betennelse (dag 14), noe som tyder på en lignende polarisering av undergruppene Th1 og Th17 i RA-modellmus30. Derfor viste RA-musemodellen indusert av hGPI325-339 og hGPI469-483 blandede polypeptidfragmenter egenskapene til CD4+ T-cellehyperproliferasjon og iNKT-celledefekter, som lignet på RA-pasientene, og kunne brukes som en ideell dyremodell for å undersøke immuniteten til RA-cellene. Disse resultatene var i samsvar med de fra våre tidligere studier og viste stabiliteten til hGPIs-indusert RA modell31.
Generelt kan RA-musemodellen indusert av de blandede G6PI peptidene simulere endringene i CD4+ T-celler, iNKT-celler og relaterte cytokiner hos RA-pasienter. Dette gir en god modell for grundig undersøkelse av RA. Etter følgende ble iNKT (hovedsakelig iNKT2) indusert ved intraperitoneal injeksjon av α-GalCer og renset in vitro brukt til behandling av RA. Det kan korrigere immunubalansen forårsaket av unormal spredning av Th-undergrupper, lindre utviklingen av RA, og i fremtiden kan gi nye metoder for klinisk behandling av RA.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Forfatterne erklærer ingen finansiering eller interessekonflikter.
Acknowledgments
Vår studie ble støttet av National Natural Science Foundation of China (NSFC) (81771755), Høyskoler og universitetets vitenskaps- og teknologiviktige forskningsprosjekt i Hebei-provinsen (ZD2017009) og Animal Lab of Medical Experiment Center, Hebei University. Vi er takknemlige for deres støtte.
Materials
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 647 Mouse Anti-PLZF | BD | 563490 | America |
| Anti-PE MicroBeads | Miltenyi | 130-048-801 | Germany |
| Columns | Miltenyi | MS | Germany |
| Cryogenic Centrifuge | Beckman | Allegra® X-15R | America |
| DiR | Thermo Fisher Scientific | D12731 | America |
| Embedding Center | Tianjin Aviation Electromechanical Co., Ltd. | BMJ-1 | China |
| FITC Hamster Anti-Mouse TCR β Chain | BD | 553170 | America |
| Flow cytometer | BD | Accuri C6 | America |
| Freund's complete adjuvant | Sigma | F5881 | America |
| hGPI325-339 (IWYINCFGCETHAML) | Karebay Biochem | 18062202 | China |
| hGPI469-483 (EGNRPTNSIVFTKLT) | Karebay Biochem | 18062203 | China |
| In Vivo Imaging System | PerkinElmer | caliper IVIS lumina II | America |
| Ionomycin Calcium | Cayman | 10004974 | America |
| KRN7000 | AdipoGen | AG-CN2-0013 | America |
| Mouse CD1d Tetramer-PE | MBL | TS-MCD-1 | Japan |
| Mouse percoll | Solarbio | P8620 | China |
| Optical Microscope | Olympus | Olympus-II | Japan |
| PerCP-CyTM5.5 Mouse anti-ROR-ϒt | BD | 562683 | America |
| PerCP-CyTM5.5 Mouse anti-T-bet | BD | 561316 | America |
| Pertussis toxin | Sigma | P7208 | America |
| phorbol esters | Cayman | 10008014 | America |
| Red Blood Cell Lysis Buffer | BD | 555899 | America |
| RPMI-1640 | Biological Industries | 01-100-1ACS | Israel |
| Th1/Th2/Th17 cytokines kit | BD | 560485 | America |
| Ultramicrotome | Leica | Leica EM UC6 | Germany |
References
- Tobón, G. J., Youinou, P., Saraux, A. The environment, geo-epidemiology, and autoimmune disease: Rheumatoid arthritis. Autoimmunity Reviews. 35 (1), 0-14 (2010).
- Cross, M., et al. The global burden of rheumatoid arthritis: estimates from the Global Burden of Disease 2010 study. Annals of the Rheumatic Diseases. 73 (7), 1316-1322 (2014).
- Kanashiro, A., Bassi, G. S., Queiróz Cunha, F. D., Ulloa, L. From neuroimunomodulation to bioelectronic treatment of rheumatoid arthritis. Bioelectronics in Medicine. 1 (2), 151-165 (2018).
- Brennan, P. J., Brigl, M., Brenner, M. B. Invariant natural killer T cells: an innate activation scheme linked to diverse effector functions. Nature Reviews Immunology. 13 (2), 101-117 (2013).
- Bianca, B. S. Unraveling Natural Killer T-Cells Development. Frontiers in Immunology. 8, 1950 (2018).
- Mitsuo, A., et al. Decreased CD161+CD8+ T cells in the peripheral blood of patients suffering from rheumatic diseases. Rheumatology. 45 (12), 1477-1484 (2006).
- Miellot, A., et al. Activation of invariant NK T cells protects against experimental rheumatoid arthritis by an IL-10-dependent pathway. European Journal of Immunology. 35 (12), 3704-3713 (2005).
- Miellot-Gafsou, A., et al. Early activation of invariant natural killer T cells in a rheumatoid arthritis model and application to disease treatment. Immunology. 130 (2), 296-306 (2010).
- Tudhope, S. J., Delwig, A. V., Falconer, J., Pratt, A., Ng, W. F. Profound invariant natural killer t-cell deficiency in inflammatory arthritis. Annals of the Rheumatic Diseases. 69 (10), 1873-1879 (2010).
- Ming, M., et al. Effects on immunoregulation of iNKT cells in RA by novel synthetic immunostimulator CH1b. Chinese Journal of Immunology. 32 (02), 218-222 (2016).
- Ming, M., et al. Study of the correlation between the percentage of iNKT cells and the ratio of IFN-γ/IL-4 in patients with rheumatoid arthritis. Chinese Journal of Microbiology Immunology. 35 (3), 213-218 (2015).
- Sharif, S., et al. Activation of natural killer T cells by α-galactosylceramide treatment prevents the onset and recurrence of autoimmune Type 1 diabetes. Nature Medicine. 7, 1057-1062 (2010).
- Gapin, L. Development of invariant natural killer T cells. Current Opinion in Immunology. 39, 68-74 (2016).
- Kwon, D. I., Lee, Y. J. Lineage Differentiation Program of Invariant Natural Killer T Cells. Immune Network. 17 (6), (2017).
- Thapa, P., et al. The differentiation of ROR-γt expressing iNKT17 cells is orchestrated by Runx1. Scientific Reports. 7 (1), 7018 (2017).
- Schurgers, E., Billiau, A., Matthys, P. Collagen-induced arthritis as an animal model for rheumatoid arthritis: focuson interferon-γ. Interferon Cytokine Research. 31 (12), 917-926 (2011).
- Van Haalen, H. G. M., Severens, J. L., Tran-Duy, A., Boonen, A. How cost-effectiveness A systematic review and stepwise approach for selecting a transferable health economic evaluation rheumatoid arthritis. Pharmacoeconomics. 32 (5), 429-442 (2014).
- Schubert, D., Maier, B., Morawietz, L., Krenn, V., Kamradt, T. Immunization with glucose-6-phosphate isomerase induces T cell-dependent peripheral polyarthritis in genetically unaltered mice. Journal of Immunology. 172, 4503-4509 (2004).
- Bockermann, R., Schubert, D., Kamradt, T., Holmdahl, R. Induction of a B-cell-dependent chronic arthritis with glucose-6-phosphate isomerase. Arthritis Research, Therapy. 7, 131613-131624 (2005).
- Kamradt, T., Schubert, D. The role and clinical implications of G6PI in experimental models of rheumatoid arthritis. Arthritis Research, Therapy. 7, 20-28 (2005).
- Horikoshi, M., et al. Activation of Invariant NKT Cells with Glycolipid Ligand α-Galactosylceramide Ameliorates Glucose-6-Phosphate Isomerase Peptide-Induced Arthritis. PlosOne. 7 (12), 51215 (2012).
- Zhang, X. J., et al. Immunization with mixed peptides derived from glucose-6-phosphate isomerase induces rheumatoid arthritis in DBA /1 mice. Chinese Journal of Pathophysiology. 32 (3), 569-576 (2016).
- Motohashi, S., Nakayama, T. Invariant natural killer T cell-based immunotherapy for cancer. Immunotherapy. 1 (1), 73 (2017).
- Jung, S., et al. The requirement of natural killer T-cells in tolerogenic APCs-mediated suppression of collagen-induced arthritis. Experimental and Molecular Medicine. 42 (8), 547-554 (2010).
- Luc, V. K., Lan, W. Therapeutic Potential of Invariant Natural Killer T Cells in Autoimmunity. Frontiers in Immunology. 9, 519-526 (2018).
- Chiba, A., et al. Suppression of collagen-induced arthritis by natural killer T cell activation with OCH, a sphingosine-truncated analog of α-galactosylceramide. Arthritis, Rheumatism. 50 (1), 305-313 (2004).
- Tudhope, S. J., Delwig, A. V., Falconer, J., Pratt, A., Ng, W. F. Profound invariant natural killer t-cell deficiency in inflammatory arthritis. Annals of the Rheumatic Diseases. 69 (10), 1873-1879 (2010).
- Bruns, L., et al. Immunization with an immunodominant self-peptide derived from glucose-6-phosphate isomerase induces arthritis in DBA/1 mice. Arthritis Research, Therapy. 11 (4), (2009).
- Parietti, V., et al. Rituximab treatment overcomes reduction of regulatory iNKT cells in patients with rheumatoid arthritis. Clinical Immunology. 134 (3), 331-339 (2010).
- Yoshida, Y., et al. Functional mechanism(s) of the inhibition of disease progression by combination treatment with fingolimod plus pathogenic antigen in a glucose-6-phosphate isomerase peptide-induced arthritis mouse model. Biological, Pharmaceutical Bulletin. 38 (8), 1120-1125 (2015).
- Chen, D., et al. Study of the adoptive immunotherapy on rheumatoid arthritis with Thymus-derived invariant natural killer T cells. International Immunopharmacology. 67, 427-440 (2019).



