Summary
פרוטוקול זה מספק לחוקרים עם שיטה מהירה, עקיפה של מדידת tlr תלויי-NF-кb/AP-1 הפעילות שעתוק בשורה מקרופאג cell מורה בתגובה למגוון של משטחים פולימריים ושכבות חלבון נספחת כי המודל ביומיהמיקרוסביבה השתל ביומטריה.
Abstract
התגובה מארח דלקתי מתמשך ביוביוחומר מושתל, המכונה תגובת גוף זר, הוא אתגר משמעותי בפיתוח ויישום של מכשירים ביו ומבנים הנדסת רקמות. מקרופאגים, תא חיסונית מולדת, הם שחקני מפתח בתגובת הגוף הזר משום שהם נשארים באתר השתל למשך החיים של המכשיר, והוא למדו בדרך כלל כדי להשיג הבנה של תגובה זו מארח מזיקה. חוקרים רבים ביואטיליים הראו כי שכבות חלבון נספחת על חומרים מושתלים להשפיע על התנהגות מקרופאג, ולאחר מכן להשפיע על התגובה המארחת. השיטות במאמר זה מתארים מודל בלתי מתורבת באמצעות שכבות חלבון נספחת המכילים נזק תאי מולקולות על משטחי פולימר משטחים כדי להעריך תגובות מקרופאג. NF-кb/AP-1 עיתונאי מקרופאג קו התא ואת העיבוד המקושר באופן אלקליין פוספספטאז משמש כשיטה מהירה כדי לבחון בעקיפין NF-кb/AP-1 פעילות שעתוק בתגובה לשכבות חלבון מורכבות נספחת המכילים חלבונים בדם הקשורים לנזק דפוסי מולקולרי, כמודל של שכבות החלבון המורכבות הנוצרות על משטחי ביומטריה בvivo.
Introduction
תגובת הגוף הזר (FBR) היא תגובת מארח כרונית שיכולה להשפיע לרעה על הביצועים של חומר או מכשיר מושתל (למשל, התקני משלוחים לסמים, ביוחיישנים), באמצעות שחרור מתמשך של מגשרים דלקתיים ובאמצעות השתלבות בשילוב בין החומר המושתל לבין הרקמה הסובבת1. זה התגובה החיסונית מולדת היא ביוזמת הליך ההשתלה מאופיין על ידי נוכחות ארוכת טווח של תאים חיסוניים מולדים היווצרות קפסולה סיבי סביב השתל1. בהקשר של תגובות מארח חומרים, לאינטראקציות חומרים מקרופאג יש השפעה משמעותית על ההתקדמות של התגובה המארחת ופיתוח של FBR1. מקרופאגים הם האוכלוסייה החיסונית מגוונת מולדים המערכת, גויס לאתר השתל או מתוך רקמות תושב האוכלוסייה מקרופאג או מהדם כמו מקרוציט הנגזרים מונופאגים. הם מתחילים להצטבר באתר השתל זמן קצר לאחר השרשה, ובתוך ימים להפוך לאוכלוסיית התא השולט במיקרו הסביבה השתל. חומר-מקרופאגים, יחד עם הגוף הזר תאים ענקיים (fbgc) נוצר באמצעות מקרופאג fusion, יכול להתמיד במשטח החומר למשך החיים של השתל2,3. כתוצאה מכך, מקרופאגים נחשבים לשחקנים מרכזיים בתגובה לגוף הזר בשל תפקידם מנצח את השלבים האופייניים של FBR: תגובה דלקתית חריפה, שיפוץ רקמות, היווצרות של רקמת פיברוטיק1.
קולטני שיחת כמו (TLRs) הם משפחה של קולטני זיהוי תבנית אשר מבוטאים על ידי תאים חיסוניים רבים, כולל מקרופאגים, והוכחו לשחק תפקיד משמעותי דלקת וריפוי הפצע. בנוסף לליגני הפתוגן, TLRs מסוגלים לאגד מולקולות אנדודוגני, הידועות כתבניות מולקולריות הקשורות נזק (DAMPs), אשר פורסמו במהלך נמק בתא ולהפעיל מסלולים איתות דלקתיות וכתוצאה מכך ייצור ציטוקינים proinflammatory4. אנחנו ואחרים הציעו כי הנזק שנגרם במהלך בדיקת רקמה רכה השתלת שחרור damps, אשר לאחר מכן ספוח כדי ביומטריה בנוסף לחלבונים בדם ולווסת את האינטראקציות חומרים סלולריים הבאים5,6. כאשר מקרופאגים אינטראקציה עם שכבת החלבון נספחת על השתל, משטח שלהם tlrs עשוי לזהות נספחת damps ולהפעיל מפלי איתות proinflammatory, המוביל NF-κB ו AP-1 שעתוק גורם ההפעלה והייצור של ציטוקינים proinflammatory. בעבר הצגנו כי מקרופאגים murine הגדילו באופן משמעותי NF-κB/AP-1 פעילות נמק גורם הגידול α (tnf-α, הפרשת cy, ציטומין) בתגובה לח-המכיל שכבות חלבון נספחת על מגוון של משטחים פולימריים לעומת משטחים עם סרום נספחת או פלזמה בלבד (כלומר, אין damps נוכח), וכי תגובה זו מתווכת במידה רבה על ידי TLR2, בעוד TLR4 משחק תפקיד פחותה5.
הכתב NF-κB/AP-1 מקרופאג line (הטבלה של חומרים) המשמשים בפרוטוקול זה היא שיטה נוחה למדוד יחסי NF-κB ו-AP 1 פעילות ב מקרופאגים5,7,8. בשילוב עם מעכבי מסלול tlr, קו תא זה הוא כלי שימושי עבור חקירת ההפעלה tlr ואת תפקידה בדלקת בתגובה למגוון גירויים5,7,8. התאים עיתונאי הם העכבר שונה מקרופאג כמו קו תא זה יכול לייצר באופן בלתי נשכח פוספספטאז אלקליין עובריים (SEAP) על NF-κB ו-AP-1 הפעלת שעתוק מקדם9. לאחר מכן ניתן להשתמש במיטרי הצביעה האלקליין מסוג פוספספטאז (טבלת חומרים) כדי לכמת כמויות יחסיות של ביטוי seap כאמצעי עקיף של הפעילות NF-ΚB/AP-1. כמו NF-κB ו-AP-1 נמצאים במורד הזרם של מסלולים רבים של איתות תאים, נטרול נוגדנים ומעכבי המיקוד TLRs ספציפיים (למשל, TLR2) או מולקולות TLRS (g., MyD88) ניתן להשתמש כדי לאמת את התפקיד של מסלול מסוים. המתודולוגיה המתוארת במאמר זה מספקת גישה פשוטה ומהירה להערכת התרומה של ה-tlr איתות בתגובות מקרופאג murine למגוון של משטחים פולימריים עם שכבות חלבון נספחת המכילים הן חלבונים בדם ו-damps כמו מודל מבחנה של בדיקות מושתלים מושתל.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. הכנה לתקשורת ומגיב
- . הכן מדיה בפיברובלסט שילוב 450 mL של מדיום הנשר שונה של Dulbecco (DMEM), 50 mL של סרום של שור עוברי (FBS), ו-5 מ ל של פניצילין/סטרפטומיצין. החנות ב -4 ° c עד שלושה חודשים.
- הכינו כתבת מקרופאג מדיית גדילה ב50 mL. שילוב 45 mL של DMEM, 5 מ ל של FBS, 5 μg/mL mycoplasma אלימינציה מגיב (טבלת חומרים), ו 200 μg/Ml phleomycin D1 (טבלת חומרים). החנות ב -4 ° c עד שלושה חודשים.
- הכינו כתבת מקרופאג מדיה ב50 mL. שילוב 45 mL של DMEM, 5 מ ל של חום מופעל FBS (HI-FBS), 5 μg/mL mycoplasma אלימינציה מגיב, ו 200 μg/mL phleomycin D1. החנות ב -4 ° c עד שלושה חודשים.
2. ציפוי תאים משטחי תרבות עם פולי (מתיל מתיונין)
- התמוססות (PMMA) ב כלורופורם ב 20 מ"ג/mL (למשל, 100 מ"ג של PMMA ב 5 מ ל של כלורופורם) ב 20 mL זכוכית בקבוקון. מניחים פס מגנטי המהומה במבחנה ולאפשר לערבב לפחות 2 h, עד כל מוצקים מומס.
זהירות: הכלורופורם מזיק אם נשאף. הקפידו להשתמש בממיסים בתוך מכסה המנוע בזמן שלובשים כפפות PVA. - פיפטה 400 μL של פתרון PMMA למרכז של מיקרוסקופ זכוכית בורוסיליקט בתוך מרובע ספין, ו ספין ב 3000 rpm עבור 2 דקות. הכינו את מספר השקופיות הנדרשות לצורך שיטת החישוב, וכן 3-5 נוספים עבור מדידת זווית המגע של המים. אחסן שקופיות בתיבה נקייה (מרוסס ונמחקה עם 70% אתנול) לשימוש עתידי.
הערה: ציפוי ספין משמש לעתים קרובות כדי להפקיד ציפוי דק, אחיד על משטח שטוח. מסתובב מסובב מצע במהירויות גבוהות, תוך שימוש בכוח צנטריפוגלי כדי להפיץ את פתרון הציפוי על פני השטח.- מדידת המים זווית המגע בשתי תנוחות אקראיות על פני השטח של שקופיות מצופה נוספת (כלומר, לא את השקופיות בשימוש עבור תרבות התא) עם מד זווית כדי להבטיח משטח זכוכית היה מצופה לחלוטין עם פולימר.
הערה: יש להשתמש רק במים של הטוהר הגבוה ביותר (למשל, זכוכית מזוקקים משולשת) עבור מדידות זווית מגע המים.
- מדידת המים זווית המגע בשתי תנוחות אקראיות על פני השטח של שקופיות מצופה נוספת (כלומר, לא את השקופיות בשימוש עבור תרבות התא) עם מד זווית כדי להבטיח משטח זכוכית היה מצופה לחלוטין עם פולימר.
- ב הקבינט בטיחות ביולוגית (תואר ראשון) לצרף 8-בארות דביק בבית pmma מצופה שקופיות באמצעות מלקחיים סטרילי ובעקבות טכניקה אספטי. לחץ בחוזקה על החלק העליון של הבארות הדביקות כדי לוודא שהם מחוברים בחוזקה. מודיית את השקופיות עם בארות דביק מחוברים ב 37 ° c לילה כדי לאבטח את החותם.
- בדוק את החותם של הבארות דביק על ידי הוספת 200 μL של תרבות התא כיתה (אנדוטוקסין-ללא) מים לכל באר. דגירה בטמפרטורת החדר (RT) עבור 60 דקות ולהבטיח שאין דליפה לפני שתמשיך. היזהרו מהמים, להיזהר לא להפריע ציפוי PMMA.
- בצע שטיפת מים אנדוטוקסין בחינם על ידי הוספת 300 μL של מים אנדוטוקסין-חינם לכל טוב, המארג עבור 1 h (שלוש פעמים), 12 h, ו 24 שעות לפני השימוש כדי להסיר את כל הממס הנותר.
- מבחן ריכוז אנדוטוקסין של השקופיות כדי לשמש לתרבות התא. מודריטה 200 μL של מים לתגובה אנדוטוקסין ללא הפרעה (טבלת חומרים) בבאר אחת של כל שקופית במשך 1 h. מדידת ריכוז האנדוטוקסין בתמצית באמצעות שיטת האנדוטוקסין של נקודת הקצה (טבלת חומרים).
הערה: הפרוטוקול הבא הוא ספציפי לערכת שיטת המערכת האנדוטוקסין המופיעה בטבלת החומרים. - השתמש רק במים ומתכלים (כלומר, הפיפטה טיפים, צינורות מיקרוצנטריפוגה וצלחות באר) כי הם מוסמכים pyrogen-free (כלומר, אנדוטוקסין ללא תשלום) עבור עבודה זו. כמו כן, כל כלי זכוכית המשמשים להכנת משטחים מצופים פולימר צריך להיות depyrogenated באמצעות חום יבש עיקור (250 ° צ' צלזיוס עבור 30 דקות) לפני השימוש10. מדידה אנדוטוקסין בתמיסה לחלץ, כפי שמתואר כאן, יכול לגרום הערכה של אנדוטוקסין על פני השטח חומר11,12. כתוצאה מכך, מומלץ לפתח פרוטוקול לציפוי פולימרי, לבצע את תגובת השיטה האנדוטוקסין (כלומר, צעדים 2.5.4-2.5.6 לדגימות ניסוי [מגיב מים] או שולטת ספייק) ישירות בתוך בארות המכילות את המדגם המצופה כדי להבטיח שאין מקורות של אנדוטוקסין שהוכנסו למערכת בשוגג במהלך תהליך הציפוי.
- הביאו את כל דגימות הבדיקה (כלומר, תמציות) ושיטת האנדוטוקסין ריאגנטים ל-RT. מהווים מגיב כרומוגניים במאגר שיטות ובתקן אנדוטוקסין במים מגיב, מאפשרים התמוססות עבור 5 דקות ומערבולת בעדינות לפני השימוש. לכסות את כל הבקבוקים עם סרט פרפין כאשר לא בשימוש.
- צור 5-8 בנקודת הדילול של התקן של תקן אנדוטוקסין, החל מלמטה ועד הגבול העליון של היריעה על-ידי ביצוע דילול סדרתי של תקן האנדוטוקסין במים מגיב.
- כדי לשלוט על שיפור או עיכוב של שיטת האנדוטוקסין בדגימות הבדיקה, להכין שליטה חיובית (נקרא גם בקרת ספייק או מדגם מחודדים) על ידי דילול כמות ידועה של אנדוטוקסין בפתרון בדיקה שאינו בשימוש במדגם.
הערה: ריכוז השליטה החיובית צריך להיות אותו הריכוז של תקן באמצע העקומה הסטנדרטית. אם הכמות המשוחזרת של היתד האנדוטוקסין (כלומר, ריכוז השליטה החיובית מינוס הריכוז של דגימת הבדיקה הבלתי מחודדים) היא בטווח של 50-200% מהריכוז הנומינלי של היתד האנדוטוקסין, ניתן להתייחס לפתרון החילוץ באופן בלתי משמעותי לבעיה. - הוסף 50 μL של תקנים, דגימות, או שולטת ספייק לכל טוב של צלחת 96-באר בשכפול או בטרילקאט. השתמש במים מגיב כפקד שלילי.
- הוסף 50 μL של מגיב כרומוגניים לכל טוב. הוסף מגיב במהירות לכל הבארות. השתמש בשעון עצר כדי לתעד את משך הזמן הדרוש להוספת מגיב לכל הבארות. מכסים את הצלחת עם חותם דביק ו הדגירה ב 37 ° צ' (זמן הדגירה הוא הרבה תלוי ומצוין על תעודת הניתוח כלול בערכה הכימית כרומוגניים). לחילופין, לבדוק את הצלחת כל 15 דקות במהלך הדגירה עד שינוי הצבע הוא נצפתה בכל הבארות רגיל.
- לאחר הדגירה, להוסיף 25 μL של 50% חומצה אצטית לכל טוב (הריכוז הסופי של 10% חומצה אצטית לכל טוב) כדי לעצור את התגובה. הוסף חומצה אצטית באותו סדר כמו הוסיף הכימית הרומוגניים. לקרוא ספיגת הצלחת באמצעות קורא צלחת ב 405 ננומטר. מנושף נוזלים ולהשליך לוחית.
הערה: חומצה אצטית בתוספת צריך לקחת את אותו אורך הזמן כדי להוסיף כל טוב כמו מגיב כרומוגניים לקח (± 30 s).
- אולטרה סגול (UV) לעקר את השקופיות עבור 30 דקות לפני ניסויים בתרבות התא.
3. ציפוי תאים משטחי התרבות עם פולימתיתיל סילאוקטן
- מערבבים polydiמתיל siloxane (PDMS) אלסטומר ביחס 10:1 משקל (בסיס: ריפוי סוכן). בארון בטיחות ביולוגי, פיפטה כ -10 מ ל. בסיס פולידימתיל לצינור סטרילי שקול את השפופרת והוסף באיטיות את סוכן הריפוי עד להוספת 10%.
זהירות: השתמש ריאגנטים PDMS באזור מאוורר היטב ולהימנע קשר עין על ידי לבישת משקפי בטיחות. - מערבבים ביסודיות את האלסטומר על-ידי ערבוב עם טיפ-פיאוולוגי סטרילי ומלטף למעלה ולמטה. הוסף כ 200 μL של הפתרון לכל טוב של צלחת 48-באר. להטות את צלחת הבאר לאט כדי להבטיח כיסוי מלא של בארות עם פתרון אלסטורר.
- מניחים את צלחת הבאר עם אלסטומר לתוך תנור ואקום להגדיר ב 50 cmHg, 40 ° c. הסר את המכסה ולכסות עם מחיקה בודדת רובד כדי למנוע פסולת אחרים ליפול לתוך הבארות. אפשר להדגירה לפחות 48 h.
- לאשר את הבארות מצופה לחלוטין באמצעות בדיקה חזותית. ודא שהאלסטואר נרפא לחלוטין על-ידי לימודיו בעדינות עם טיפ של פיפטה סטרילי לפני הסרתו.
- הוסף 300 μL של 70% אתנול (עשוי אתנול מוחלט מים אנטוקסין נטול) ו-דגירה ב-RT עבור 1 h. הסר את אתנול ולבצע שטיפת מים אנדוטוקסין בחינם על ידי הוספת 300 μL של מים אנטוקסין-ללא שימוש לכל טוב והדגירה עבור 1 h (שלוש פעמים), 12 שעות ו-24 שעות לפני השימוש כדי להסיר את הממס הנותר.
- דגירה 200 μL של מים ללא הרעלן בשלוש בארות של כל צלחת עבור 1 h. מדידת ריכוז אנדוטוקסין של תמציות המים תוך שימוש בשיטת נקודת הקצה האנדוגנית (שלבים 2.5.1-2.5.6).
4. ציפוי תאים משטחי תרבות עם זכוכית אקרילית (טטרפלואורואתילן)
- הפוך את הפתרון 1 מ"ג/mL של פולי (הטטרפלואורואתילן) (למשל, להוסיף 10 מ ג של fPTFE 10 מ ל של ממיס fluorinated ומס [טבלה של חומרים]) בבקבוקון 20 מ ל זכוכית. מניחים פס מגנטי בבקבוקון ומאפשרים לערבב לפחות 24 שעות, עד שכל המוצקים מומס.
- הוסף כ 150 μL של הפתרון הפולימרי לכל טוב של פוליסטירן 48-צלחת הבאר (כלומר, לא התרבות רקמה מטופלת). להטות את צלחת הבאר לאט כדי להבטיח כיסוי מלא של כל הבארות עם פתרון פולימרי. החלפת מכסה.
- כדי להבטיח את הציפוי האפקטיבי ביותר של בארות, שמיכות זכוכית צריך להיות מצופה מצופה ומשמש למדידת זווית מגע המים (שלב 4.3.1). הציבו שמיכות בתוך הבארות של צלחת 24. הוסף כ 400 μL של פתרון פולימרי לכל היטב המכיל שמיכות. לדחוף את הכיסויים באמצעות מלקחיים סטרילי, להבטיח שהם מכוסים לחלוטין בפתרון פולימרי, ולכסות את צלחת הבאר עם מכסה.
- מניחים את צלחת הבאר עם פתרון פולימרי ו/או כיסוי לתוך תנור ואקום להגדיר ב 50 cmHg, 40 ° c. הסר את המכסה ולכסות עם מחיקה בודדת רובד כדי למנוע פסולת אחרים ליפול לתוך הבארות. אפשר להדגירה לפחות 48 h.
- מדידת המים זווית המגע של שמיכות מצופה ציפוי עם מד זווית כדי להבטיח ציפוי יעיל.
הערה: יש להשתמש רק במים של הטוהר הגבוה ביותר (למשל, זכוכית מזוקקים משולשת) עבור מדידות זווית מגע המים.
- מדידת המים זווית המגע של שמיכות מצופה ציפוי עם מד זווית כדי להבטיח ציפוי יעיל.
- הוסף 300 μL של 70% אתנול (עשוי אתנול מוחלט מים אנטוקסין נטול) ו-דגירה ב-RT עבור 1 h. הסר את אתנול ולבצע שטיפת מים אנדוטוקסין בחינם על ידי הוספת 300 μL של מים אנטוקסין-ללא שימוש לכל טוב והדגירה עבור 1 h (שלוש פעמים), 12 שעות ו-24 שעות לפני השימוש כדי להסיר את הממס הנותר.
- דגירה 200 μL של מים חינם אנדוטוקסין בשלוש בארות של כל צלחת עבור 1 h. מדידת ריכוז אנדוטוקסין של תמציות מים באמצעות שיטת נקודת הקצה כרומוגניים באמצעות הסדר (שלבים 2.5.1-2.5.6).
- UV לעקר את צלחות הבאר עבור 30 דקות לפני ניסויים בתרבות התא.
5. הפיכת ליפוסט מתאי 3T3
- לגדול 3T3 תאים T150 מרובים מבחנות כדי 70% המפגש. כדי לנתק את התאים, לנקות את התקשורת, לשטוף את המשטח עם 5 מ ל של PBS, ו לאכול PBS. הוסף 5 מ ל של בעלי חיים ללא מוצא, רקומביננטי תא האנזים הדיסוציאציה (לוח חומרים) ו הדגירה ב 37 ° c עבור 3-5 דקות.
- ניתוק תאים על-ידי הטיית הבקבוקון בעדינות הלוך ושוב. הוסף 5 מ ל PBS כדי לנטרל את האנזים רקומביננטי המשמש לדיסוציאציה תא. להעביר את התאים המנותקים מצלוחיות לתוך צינור צנטריפוגה ולערבב באמצעות ליטוף. לבצע ספירת תאים חיים באמצעות הומוציטוטומטר ותא הכדאיות של התא.
הערה: אנזים דיסוציאציה של תא שניתן לנטרל באמצעות דילול ב PBS נבחר כדי למנוע את המבוא של חלבונים מבוססי סרום בהכנה ליפוסט. אם משתמשים בטריפסין כדי לנתק תאים, יש לנטרל אותו בתמיסה המכילה סרום, ולבצע שטיפת PBS נוספת כדי להקטין את כמות החלבונים בסרום הנישא להכנה הליפוסט. - צנטריפוגה את התאים ב 200 x g עבור 5 דקות. ומריף את התאים המחדש בנפח המקורי (כלומר, 10 mL x מספר של מבחנות) של PBS לשטוף את כל המדיה הנותרים. חזור על.
- צנטריפוגה את התאים שוב ב 200 x עבור 5 דקות ומכה את הסופרנטאנט. הוסף את נפח ה-PBS הנדרש כדי להשיג ריכוז תא סופי של 1 x 106 תאים/mL. מניחים את התמיסה התאית למקפיא של 80 ° c עד שהדוגמא קפואה לחלוטין (לפחות 2 שעות).
- הפשרת פתרון התא באמבט מים ב37 ° c. פעם אחת לגמרי, מניחים את הפתרון בחזרה למקפיא-80 ° c עד קפוא לחלוטין. חזור על סך של 3 מחזורי הקפאת הפשרה.
- ביצוע של חומצה מיקרו-בינואית (BCA) בדיקה על התא לאחר במגוון של דילול (למשל, 1/100, 1/200, 1/500, 1/1000) כדי לקבוע את ריכוז החלבון. לדלל את התא לאחר לריכוז חלבון של 468.75 μg/mL, aliquot, ולאחסן ב-80 ° צ' לשימוש עתידי.
הערה: ריכוז החלבון הסופי בצלחת 48-באר הוא 125 μg/cm2 (מבוסס על פני שטח של אחד טוב, 0.75 ס"מ2). - לבצע כתם מערבי כדי להעריך את הנוכחות של damps בליפוסט (למשל, החום חלבון 60 [HSP60], הקבוצה הגבוהה ניידות תיבת 1 [HMGB1]) על-ידי טעינת 40-60 לערך של חלבון ליקיה במאגר טעינת אל 1.5 מ"מ עבה 10% אלקטרופורזה ג'ל ולעקוב רגיל מערבי כתם נהלים.
6. הערכת אפקט של שכבות חלבון Adsorbed ו שיחת כמו קולטנים על הפעילות NF-κB של מקרופאגים
הערה: עבור סכמטית של זרימת העבודה הניסיונית ואת לוח הצלחת, להתייחס לדמות 1a ו משלים איור 1, בהתאמה.
- לגדל מקרופאגים כתבת בבקבוקון בגודל כראוי 70% המפגש. . ומביסה את הערוץ הpbs הוסף את האנזים דיסוציאציה רקומביננטי cell ואת הדגירה ב 37 ° c עבור 8 דקות.
- ניתוק תאים על ידי הקשה בחוזקה על הצדדים של הבקבוקון. הפוך את האנזים רקומביננטי הדיסוציאציה של התא על-ידי הוספת נפח שווה של מדיית גדילה (המכילה 10% FBS). לבצע ספירת תאים חיים באמצעות הומוציטוטומטר ותא הכדאיות של התא.
הערה: הכדאיות הצפויה עבור מקרופאגים העיתונאי בעקבות דגירה של 8 דקות באנזים הדיסוציאציה של התא הוא 90%. - בתאי צנטריפוגה ב 200 x g עבור 5 דקות. האכלה על ידי הסופר ומשהה בנפח המקורי של PBS לשטוף תאים. צנטריפוגה שוב ולהשעות את התאים ב7.3 x 105 תאים/mL באמצעי האחסון (המכיל fbs חום המופעל).
- ההשעיה התא הנפרד 3 צינורות שונים: TLR4 מעכב, anti-TLR2, ולא מטופל. התאים דגירה עם 1 μg/mL TLR4 מעכב עבור 60 דקות ב RT או עם 50 μg/mL anti-TLR2 עבור 30 דקות ב RT.
- הוסף 200 μl של ליפוסט, 10% fbs, 10% פלזמה מסחרי העכבר (הטבלה של חומרים), או תערובת של פתרונות חלבון לצלחת 48-באר (או שווה ערך) ולאפשר חלבון ספוח ב 37 ° צ' למשך הזמן הרצוי (כלומר, 30 דקות, 60 דקות, או 24 h). מנושף פתרונות חלבונים מבארות, תוך שימוש בפיפטה טרי פסטר עבור כל פתרון חלבון, ולשטוף משטחים עם 250 μL של PBS במשך 5 דקות.. מרוב הערוץ חזור על הסכום בסך של 3 שוטף.
הערה: ייתכן שיהיה צורך להפעיל שלב זה מוקדם יותר בפרוטוקול בהתאם לזמן הרצוי של הספיחה. התאם את הפרוטוקול בהתאם. - לאחר תקופת דגירה עם מעכב TLR4 או anti-TLR2, תאים פיפטה להשעות מחדש. הוסף 200 μL של פתרון התא לכל באר.
- עבור מצב בקרה TLR2 חיובי, הוסף Pam3CSK4 לריכוז סופי של 150 ng/mL. עבור מצב בקרת TLR4 חיובי, הוסף ליפופוליסכריד (LPS) לריכוז סופי של 1.5 μg/mL. מודטה תאים ב 37 ° c עבור 20 h.
- לדוגמה 20 μL של סופרנטאנט מכל באר וצלחת בשכפול לתוך צלחת 96. כלול שלוש בארות של 20 מדיית שיטת μL כבקרת רקע. הוסף 200 μL של כתבת SEAP מגיב לכל באר. מכסים את הצלחת עם חותם דביק ו הדגירה עבור 2.5 h ב 37 ° c.
הערה: זמן הדגירה עשוי להשתנות בהתאם לתנאים הניסיוניים, וצריך להיות מותאם לשינוי חזק בספיגה בין בארות שליטה חיוביות ושליליות.- העבר את יתרת הסופרנטאנט לצינור 1.5 mL (לכל היותר). צנטריפוגה ב 1,000 x g עבור 10 דקות כדי גלולה כל פסולת. העברת סופרנטאנט לצינור 1.5 mL חדש ולחנות ב-80 ° c. ניתוח הסופרנטאנט לנוכחות ציטוקינים פרודלקתיים (לדוגמה, tnf-α, אינטרלויקין 6) באמצעות מבחן חיסוני מקושר אנזימים (אליסה).
- הסרת חותם לוחית דבק. לקרוא ספיגת הצלחת באמצעות קורא צלחת ב 635 ננומטר. מנושף נוזלים ולהשליך לוחית.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
שיטות ניקוי עבור משטחים מצופי פולימר נבדקו כדי להבטיח שלא היה הפרעה של ציפוי, אשר ניתן היה לראות כשינוי בזווית מגע המים לתוך שמיכות זכוכית ללא ציפוי (איור 2). הטבילה PMMA מצופה מיקרוסקופ שקופיות 70% אתנול עבור 1 h נמצא כדי להסיר את ציפוי PMMA (איור 2, שמאל פאנל), כנראה בשל מסיסות של pmma ב 80 wt x אתנול13, ולכן pmma מצופה משטחים נוקו באמצעות 30 דקות של העיקור של UV לבד. הריכוז של PMMA לציפוי היה אופטימיזציה בעבר5. A 1 h 70% אתנול להשרות השתמשו כדי לנקות PDMS, ו UV עיקור הוזנח מאז אור UV יכול לגרום המספריים שרשרת ולהשפיע על מאפייני הרטבה פני השטח של PDMS14. שניהם 70% אתנול להשרות ועיקור UV לא השפיעו על זווית מגע המים של שמיכות מצופה (איור 2, הלוח הימני), ולכן שתי השיטות, ברציפות, שימשו כדי לנקות את הציפוי. שיטת הציפוי המתואר בעבר על ידי קבוצת גריינגר15.
כתם מערבי בוצע על 3T3 ליפוסט כדי להבטיח כי מינים לח היו נוכח תערובת מולקולרית מורכבת. התוצאות הראו כי הן HMGB1 ו HSP60, שני בעלי מתועד היטב16,17, היו נוכחים בליפוסט (איור 1ב). הספיחה של tlr ליגנדס מן הליפוסט אל משטחי פולימר אושרה על ידי מקרופאגים כתבת culturing (מטופל, TLR2 לנטרל, או TLR4 עכבות) עבור 20 h על חלבון-ספיחה פולימר משטחים (כלומר, רקמות הרקמה מטופלים בפוליסטירן [tcps pmma], החברה לטיפול, pdms, מצופה, ולאחר מכן בעקיפין הערכה NF-кb/AP-1 פעילות המבוססת על הייצור seap באמצעותשיטה אנזימטית ( יתר על כן, מקרופאגים העיתונאי הגביר באופן משמעותי את NF-кb/AP-1 פעילות על הליספוסט לעומת fbs, או פלזמה, ללא טרום נספחת חלבון (מדיה) (איור 4). TLR-ליפוטים סינתטיים תלת-ממדי (Pam3CSK4, TLR2 ligands) וליפופוליסכד (LPS, TLR4 ligands) נכללו כפקדים חיוביים כדי לאשר את הנוגדן או המעכב והבדיקה עבדו כראוי. ניטרול TLR2 היה הפחתה חזקה באופן ניכר ב-NF-кb/AP-1 התגובה של מקרופאגים העיתונאי ליפוסט נספחת לעומת עיכוב TLR4. כמו גם, כמויות קטנות של ליפוסט מדולל בסרום (מבוסס על חלבון מוחלט) המושרה באופן משמעותי NF-кB/AP-1 תגובה בהשוואה סרום לבד, עם הדילול האפקטיבי הנמוך ביותר התלוי משטח פולימרי (איור 5). תוצאות אלה מציגות את העוצמה של מולקולות הנגזרות ליפוסט-שנגזרו על לגרימת TLR תלויי-NF-кB/AP-1 פעילות מקרופאגים העיתונאי על מגוון רחב של משטחים פולימריים.

איור 1: שיטות ותוצאות עבור שיטת פוספספטאז אלקליין של NF-кB/AP-1 כתבת מקרופאגים ב-tcps PMMA, PDMS, ו מצופה. (A) תרשים של זרימת העבודה עבור העיתונאי מקרופאגמהווהפוספספטאז אלקליין. (ב) כתם מערבי של ליפוסט המאשר נוכחות של מינים לח HMGB1 ו HSP60, עם β-actin כמו בקרת הטעינה. (ג) NF-кb/AP-1 פעילות (מיוצגת על ידי ספיגה) של מקרופאגים העיתונאי התרבותי בתקשורת (שליטה שלילית), 10% fbs, ליפוסט, ו PAM3CSK4 (TLR2 ligand, בקרה חיובית) עבור 20 h. הנתונים מראים את התוצאות של ניסוי אחד והוא מייצג תוצאות של לפחות 2 ניסויים נפרדים, המוצגת כממוצע ± סטנדרטי (SD). כל ניסוי השתמש ב-n = 3 בארות נפרדות לכל תנאי, וכל הבאר הייתה מצופה בשכפול לצורך התניה האנזימטית. מנותח באמצעות מבחן אחד בכיוון ANOVA ו-Tukey שלאחר-הוק. p < 0.001. הדמות הזו הותאמה באישור. ממקקיל ופיצפטריק5 זכויות יוצרים 2018 האגודה האמריקנית לכימיה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 2: אופטימיזציה של שיטות ניקוי למשטחים PMMA-מצופה מצופים, העריכו באמצעות המים זווית מגע (WCA). מדידות נלקחו על 2 נקודות נפרדות של לפחות 3 שמיכות. הנתונים מוצגים כממוצע ± SD. שנותחו באמצעות מבחן ANOVA ובדיקה לאחר-הוק של כיוון אחד. * p < 0.05. הדמות הזו הותאמה באישור. ממקקיל ופיצפטריק5 זכויות יוצרים 2018 האגודה האמריקנית לכימיה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 3: TLR-תיווך NF-кb/AP-1 פעילות (מיוצגת על ידי ספיגה) של מקרופאגים העיתונאי תרבותי על 10% FBS (שליטה), ליפוסט, ושליטה חיובית עבור 20 h. (א) השפעה של ניטרול TLR2 על הכתב המקרופאג תגובות כדי נספחת ליפוסט. שליטה חיובית היא פאם (Pam3CSK4, TLR2 ligand). (ב) השפעה של עיכוב TLR4 על העיתונאי מקרופאג תגובה לליפוסט לישין. שליטה חיובית היא LPS (TLR4 ligand). הנתונים מראים את התוצאות של ניסוי אחד והוא מייצג תוצאות של לפחות 2 ניסויים נפרדים, מוצג כממוצע ± SD. כל ניסוי השתמש ב-n = 3 בארות נפרדות לכל תנאי, וכל הבאר הייתה מצופה בשכפול לצורך התניה האנזימטית. מנותח באמצעות מבחן אחד בכיוון ANOVA ו-Tukey שלאחר-הוק. * * p < 0.01, * * * p < 0.001. הדמות הזו הותאמה באישור. ממקקיל ופיצפטריק5 זכויות יוצרים 2018 האגודה האמריקנית לכימיה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 4: NF-кb/AP-1 פעילות (מיוצגת על ידי ספיגה) של מקרופאגים העיתונאי תרבותי על מדיה (שליטה שלילית), 30 דקות ו 24 h נספחת שכבות חלבון, ו Pam3CSK4 (בקרה חיובית) על tcps עבור 20 h. נתונים משולבים 3 ניסויים נפרדים ומוצג כממוצע ± SD. כל ניסוי השתמש ב-n = 3 בארות נפרדות לכל תנאי, וכל הטוב היה מצופה בשכפול עבור העיבוד האנזימטי (כלומר, n = 9 בארות תרבות תאים בלתי תלויות ו-n = 18 שאינם עצמאיים ובין התניה אנזימטית). מנותח באמצעות מבחן אחד בכיוון ANOVA ו-Tukey שלאחר-הוק. p < 0.001. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
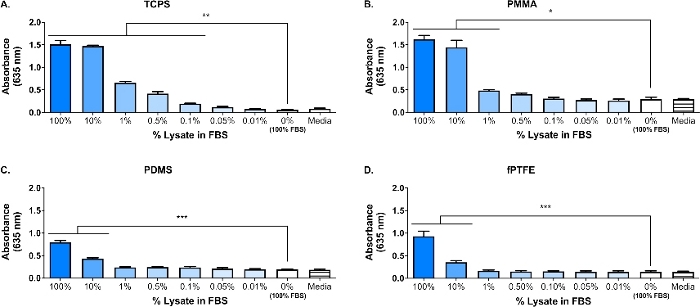
איור 5: העיתונאי מקרופאג NF-кb/AP-1 פעילות (מיוצגת על ידי ספיגת) לאחר 20 h בתגובה לדילול של ליפוסט ב fbs (סך החלבון = 280 μg/גם) נספחת כדי פולימר משטחים עבור 30 דקות. (א) טאלו. (ב) PMMA. (ג) PDMS. (ד) מצופה. הנתונים מראים את התוצאות של ניסוי אחד והוא מייצג תוצאות של לפחות 2 ניסויים נפרדים, מוצג כממוצע ± SD. כל ניסוי השתמש ב-n = 3 בארות נפרדות לכל תנאי, וכל הבאר הייתה מצופה בשכפול לצורך התניה האנזימטית. מנותח באמצעות מבחן אחד בכיוון ANOVA ו-Tukey שלאחר-הוק. * p < 0.05, * * p < 0.01, * * * p < 0.001. הדמות הזו הותאמה באישור. ממקקיל ופיצפטריק5 זכויות יוצרים 2018 האגודה האמריקנית לכימיה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור משלים 1: פריסות לדוגמה המשמשות לכתב NF-кB/AP-1 מקרופאג שיטת התרבות של התאים בתבנית של 8 חדרי ומ48-ובכן. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
המוקד העיקרי של המעבדה שלנו היא התגובה המארחת על שתלים מוצק רקמת רקמה רכה, ובמיוחד איך הנזק התאי שנגרמו במהלך השתלת הליך משפיע על התגובה המארחת. העבודה המוצגת כאן מתארת ניסויים ראשוניים באמצעות כתבת קו מקרופאג cell באמצעות מבחנה לחות הסלולר המכילים לחות, כדי לחקור את ההשפעה של מולקולות שפורסמו במהלך הנזק התאי (כלומר, מהניתוח השתל) על התגובות מקרופאג ביואטילים. תא פיברודפיצוץ ליפוסט השתמשו כדי לדגמן את הנזק התאי ושחרורו של DAMPs בשל מיקום ביומטריה. פיברותקיעות נבחרו כדי ליצור את הליפוסט בגלל שכיחות הפיברובליות ברקמה רכה, כמו גם היכולת שלהם להפריש מגוון רחב של מטריקס מטריצות (ECM) חלבונים, כולל fibronectin18. הקפאת ההפשרה האופניים נבחרה כשיטת הליזה כדי לייצר הן תאיים ו-ECM נגזרות DAMPs, בדומה למה שיהיה נוכח בסביבת השתל. מעכבי פרוטאז לא שימשו כדי להפוך את זה ליפוסט. בעוד לפירוק תאים בלתי מבוקרת כמו אופניים הקפאת הפשרה יכול לגרום לשחרור של הפרוטסים שעלולים לבזות DAMPs, אנזימים אלה עשויים גם להיות נוכחים בסביבת השתל ביומטריה כאשר התאים פגומים במהלך תהליך ההשתלה. הנוכחות של DAMPs בתערובת המולקולרית המורכבת של הליפוסט אושרה על ידי אבן החשופה (איור 1ב'; HMGB1 ו-HSP60) ושיטת העיתונאי SEAP (איור 1ג; NF-кb/AP-1 פעילות בתגובה ליפוסט נספחת). בוצעו גם בחני היכן ליפוסט היה מדולל ב fbs מבוסס על ריכוז חלבון מוחלט נספחת על משטחי תרבות התא (איור 5) כדי לשקף טוב יותר את המורכבות של סביבת השתל, שכן הוא יכיל שפע של חלבונים בדם, כמו גם damps6. העיתונאי מקרופאג NF-кb/AP-1 פעילות נותרה באופן משמעותי על שכבות נספחת מ ליפוסט מדולל fbs, ואת הדילול הנמוך ביותר כדי להשיג הפעלה משמעותית היה תלוי פני השטח, החל 0.1% (tcps) כדי 10% (pdms ו-fbs צופה).
Pmma פולימרים, pdms, ומצופה נבחרו עבור עבודה זו משום שהם nondegradable ושימשו בהרחבה בספרות כדי להעריך ספיחה חלבון ו מקרופאג התגובה ביואטילים19,20,21,22,23,24,25. Tcps שימש גם להשוואה מאחר שהיא מצע משותף המשמש בבית מיון מקרופאג ו tlr איתות עבודה21,26,27,28. החומרים המשמשים בעבודתנו הם דוגמאות מייצגות של לא-תכלה, ביואטילים מוצקים. עם זאת, חומרים רבים אחרים ניתן להשתמש עם המודל הזה, בתנאי החומר יכול להיות מצופה על לוחות תרבות התא או שקופיות מיקרוסקופ וכן decontaminated כראוי. הכתבת NF-κB/AP-1 מקרופאג הקו נבחר עבור זה במודל חוץ גופית משום שהוא מאפשר מדידה מהירה, עקיפה של הפעילות NF-κB/AP-1 באמצעות הביטוי NF-κB/AP-1 inducible של SEAP. NF-κB/AP-1 מקרופאגים העיתונאי דורשים את השימוש phleomycin D1 במדיית התרבות כאנטיביוטיקה סלקטיבית כדי להבטיח כי רק תאים עם הגנים NF-кB/AP-1 inducible SEAP הם נוכחים29. עבור שיטת פוספספטאז אלקליין, זה קריטי להשתמש ב-HI-FBS במדיה של תרבות התא כדי למנוע תוצאות אפשריות חיוביות שווא שנוצרו על ידי פוספאצטיות אלקליין בהווה סרום. המחקר שלנו עד התאריך עולה כי fbs-נספחת משטחים אינם מייצרים תוצאה חיובית שווא לזיהוי, סביר להניח כי מולקולות סרום הם מאוד נספחת לפני השטח התרבותי ולא שוחררו אל supernatant. נקודת זמן התרבות של העיתונאי מקרופאגים (20 h), שיטת הדגירה של זמן (2.5 h), וספיגת הקריאה באורך הגל (635 ננומטר) עבור שיטת פוספספטאז אלקליין היו ממוטבים עם מערכת זו כדי להבטיח מדידות איתנה ומיודלות עבור כל התנאים.
הראשון חלבון ספיחה זמן של 30 דקות נבחר עבור עבודה זו בשל השימוש הנפוץ שלה בספרות ספיחה חלבון (איור 1ג)30,31,32,33,34. עם זאת, יש לנו גם בחנו פעמים ספיחה ארוכה (כלומר, 60 דקות ו-24 שעות, איור 4) כדי לייצג טוב יותר את שכבת החלבון ספיחה כי מקרופאגים היה אינטראקציה עם vivo, אשר צפוי להתרחש 4 לאחר 24 שעות אחרי ההשתלה1. זה כבר היסוד כי רוב החלבון ספיחה ו-exchange מתרחשת הראשון 60 מינימום של חשיפה לפני שטח26,35,36, ולכן הזמן 60 מינימום ספיחה יכול להיות יותר מאשר בזמנים רלוונטיים. עברנו גם משימוש fbs כפקד שלילי לנוכחות של damps בשכבת החלבון נספחת כדי פלזמה העכבר המסחרי. הרציונל לשימוש בפלזמה במקום סרום הוא כי חלבונים פלזמה ידועים לשחק תפקידים משמעותיים ספיחה חלבון ו תגובה1, ו פלזמה מספק ייצוג טוב יותר של החלבונים בסביבה הפצע. פלזמה בשימוש בניסויים ספיחה חלבונים מוכן בדרך כלל כמו 1 על 10% דילול26,36,37, אשר מניע את השימוש שלנו 10% פלזמה. פלזמה האדם משמש בדרך כלל26,36, כפי שהוא קל יותר להשיג בכמויות גדולות יותר רלוונטי קלינית, לעומת פלזמה העכבר. עם זאת, בחרנו להשתמש פלזמה מסחרי העכבר עבור מודל זה כדי לשמור על מינים של פתרונות חלבון עקבי עם זה של התאים כתב.
השימוש העיתונאי מקרופאג קו התא הציג כמה מגבלות בתוך המחקר. ראשית, באמצעות קו מקרופאג לוקמיה מורמית יש מגבלות הטבועה, כמו פנוטיפים והתנהגות עשויים להשתנות מתרבויות מקרופאג העיקרי. בעוד מגבלה זו תטופל בעבודה בעתיד באמצעות מקרופאגים הראשי, קו התא מקרופאג הורי הוצגה הדוק לחקות את מח עצם העכבר הנגזר מקרופאגים הנגזרים במונחים של קולטני משטח התא שלהם ואת התגובה של חיידקים מיקרוביאלית עבור TLRs 2, 3 ו 438. יתר על כן, NF-κB/AP-1 העיתונאי מקרופאגים הניבו תוצאות דומות בתגובה HMGB1 ו-LPS גירוי בהשוואה הצפק מקרופאגים הראשי murine39. יש לציין כי NF-κB/AP-1 כתבת מקרופאגים, ואת זן הורים שלהם, לא לבטא TLR540. החוקרים הפגינו כי HMGB1 היה מסוגל להפעיל את הגורמים NF-κB שעתוק באמצעות TLR5 מסלולים איתות ב HEK-293 תאים באופן מאוד מנוכר עם האדם TLR541. לכן, התרומה של HMGB1-TLR5 איתות לפעילות הכללית NF-κB על משטחים מצופים ליפוסט הוזזו במודל זה. בנוסף, מקרופאגים העיתונאי והזן ההורה שלהם אינם מבטאים את חלבון המתאם עולה, וכתוצאה מכך אינם יוצרים את מרבית סוגי הדלקות, ולא ניתן לעבד את IL-1β או לא פעיל IL-18 לטפסים הבוגרים שלהם42. לכן, המודל שאנחנו משתמשים לא מסביר את התרומה של פעילות בעלת התלות התלויה והבאים autocrine IL-1β ו-IL-18 איתות בתגובות מקרופאג ליפוסט-adsorbed משטחים. כתוצאה מכך, שיטת הפעולה מיועדת כבדיקה ראשונית של הפעלת NF-κB התלויה ב-TLR, והמחקר הבא באמצעות מקרופאגים ראשיים מומלץ לספק הבנה מלאה ומייצגת יותר של הפעלת מקרופאג ופנוטיפים בנוגע למשטחים חומריים של עניין.
הבסיס פוספספטאז בעקיפין מודד את הפעילות NF-кB/AP-1 של מקרופאגים העיתונאי. עם זאת, יש הרבה מסלולים איתות אחרים מאשר TLRs המערבות NF-кB/AP-1 (g., האינטרלוקין-1 קולטן [IL-1R]43 וקולטן נמק גורם הגידול [tnfr]44). לכן, היה צורך להעריך את התרומה של TLR2 ו TLR4 איתות ב מוגברת NF-кb/AP-1 תגובה משטחי ליפוסט-adsorbed באמצעות עיכוב בחני (איור 3). הרציונל לבחירת משטח זה שני TLRs היה כי לפחות 23 DAMPs אשר הוכחו לאותת דרך TLR2 ו TLR445, כולל HMGB1 מאופיין, ושניהם קולטנים מבוטא על פני השטח התא והוא יכול לתקשר ישירות עם פני השטח6. TLR2 ו TLR4 עיכוב בחני פגינו כי כאשר TLR2 או TLR4 איתות נחסמו, NF-кb/AP-1 תגובה של מקרופאגים העיתונאי כדי נספחת ליפוסט היה מופחת, המציין כי שני מסלולים מעורבים. עם זאת, היתה ירידה גדולה באופן ניכר בפעילות NF-кb/AP-1 כאשר TLR2 איתות היה מנוטרל, הרומז כי TLR2 עשוי לשחק תפקיד ראשי בתגובה של מקרופאגים העיתונאי כדי נספחת ליפוסט. אנו מכירים כי ייתכן שיש כמה עיכוב מחוץ למטרה עם מסלול איתות TLR נטרול נוגדנים ומעכבי. נוגדן נטרול שימש לעכב את מסלול TLR2 מאז לא היו זמינים מסחרית TLR2 מולקולות מעכבי בזמן עבודה זו.
השיטות המוצגות כאן להשתמש lysate כמקור מורכב של damps, ו-NF-κB/AP-1 עיתונאי מקרופאגים כמו מודל מבחנה עבור התגובות מקרופאג damps וחלבונים אחרים נספחת ביופולימרים פולימריים (איור 1). אנו מצפים הפרוטוקול שלנו ניתן להשתמש כדי לנתח במהירות NF-κB/AP-1 תגובות ו-tlr איתות של מקרופאגים העיתונאי למגוון של חומרים (כולל חומרים תכלה, נקבובי מתקפל פיגומים או הידרוגים) ושכבות חלבון נספחת (איור 3). עם זאת, השימוש בחומרים נקבובי והידרוג'לים מציגים את המורכבות בתוך המערכת, כפי שהוא עשוי להיות מאתגר להבדיל בין מולקולות נספחת ומולקולות הגשם. אנו גם מצפים כי פרוטוקול זה ניתן להתאים בקלות כדי לחקור את התרומה של מסלול איתות אחר במעלה NF-кB/AP-1 (למשל, C-סוג לקטין קולטנים46 ו נוקלאוטיד-מחייב oligomerization התחום (נוד)-כמו קולטנים47) עם מעכבי המתאים. יתר על כן, NF-κB/AP-1 התגובה של מקרופאגים עיתונאי יכול להיות מושווה בין חומרים שונים, סיפק התגובות מנורמלים פעילות תא בסיסית (כלומר, תאים במדיה על כל משטח עם חלבון טרום adsorbed) ואת כל החומרים יש רמות אנדוטוקסין בלתי ניתן לגילוי.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
. למחברים אין מה לגלות
Acknowledgments
המחברים מכירים בהכרת תודה מבצעית מהמכונים הקנדיים של פרויקט מחקר הבריאות (PTJ 162251), הסנאט של אוניברסיטת המלכה ועדת המחקר המייעצת ותמיכת תשתית של הקרן הקנדית לחדשנות קרן ג'ון אוון (פרויקט 34137) ומשרד המחקר והחדשנות באונטריו קרן המחקר (פרויקט 34137). L.A.M. היה נתמך על ידי אוניברסיטת המלכה R. סמואל מקלפלין מלגת, מדעי הטבע והמועצה למחקר הנדסי של קנדה בוגרת מלגת בוגר הפרס של מאסטר בוגרת אונטריו מלגה. המחברים רוצים להודות לד ר מיירון סצ'ואן על מתנתו הנדיבה של הכתבת NF-κB/AP-1 מקרופאג line ו ד"ר. מיכאל בלנרסט וסנדרה לורנסו לשימוש מערכת הדמיה ג'ל שלהם וקורא צלחת.
Materials
| Name | Company | Catalog Number | Comments |
| Cell culture reagents | |||
| anti-mouse/human CD282 (TLR2) | Biolegend | 121802 | |
| CLI-095 (TLR4 inhibitor) | Invivogen | TLRL-CLI95 | |
| C57 complement plasma K2 EDTA 10ml, innovative grade US origin | InnovativeResearch | IGMSC57-K2 EDTA-Compl-10ml | Mouse plasma |
| Dulbecco's modified eagle medium (DMEM) | Sigma Aldrich | D6429-500ML | |
| Dulbecco's phosphate buffered saline (DPBS) | Fisher Scientific | 14190250 | No calcium, no magnesium |
| Fetal bovine serum (FBS), research grade | Wisent | 98150 | |
| LPS-EK | Invivogen | TLRL-EKLPS | Lipopolysaccharide from Escherichia coli K12 |
| NIH/3T3 fibroblasts | ATCC | CRL-1658 | |
| Pam3CSK4 | Invivogen | tlrl-pms | Synthetic triacylated lipopeptide - TLR1/2 ligand |
| Penicillin/streptomycin | Sigma Aldrich | P4333-100ML | |
| Plasmocin | Invivogen | ANT-MPP | Mycoplasma elimination reagent |
| RAW-Blue cells | Invivogen | raw-sp | NF-κB/AP-1 reporter macrophage cell line |
| Trypan blue solution, 0.4% | Fisher Scientific | 15250061 | |
| TrypLE express enzyme (1X) | Fisher Scientific | 12604021 | animal origin-free recombinant cell dissociation enzyme |
| Zeocin | Invivogen | ANT-ZN-1 | |
| Kits and assays | |||
| ELISA precoated plates, mouse IL-6 | Biolegend | B213022 | |
| ELISA precoated plates, mouse TNF-α | Biolegend | B220233 | |
| Endotoxin (Escherichia coli) - Control standard endotoxin (CSE) | Associates of Cape Cope Inc. | E0005-5 | Endotoxin for standard curve in chromogenic endotoxin assay |
| LAL water, 100 mL | Associates of Cape Cope Inc. | WP1001 | Used with chromogenic endotoxin assay |
| Micro BCA protein assay | Fisher Scientific | PI23235 | |
| Limulus amebocyte lysate (LAL) Pyrochrome endotoxin test kit | Associates of Cape Cope Inc. | C1500-5 | Chromogenic endotoxin assay reagent |
| QUANTI-Blue alkaline phosphatase detection medium | Invivogen | rep-qb2 | Alkaline phosphatase assay to indirectly measure NF-κB/AP-1 activity |
| Polymeric coating reagents | |||
| Chloroform, anhydrous | Sigma Aldrich | 288306-1L | |
| Ethyl alcohol anhydrous | Commercial Alcohols | P006EAAN | Sigma: Reagent alcohol, anhydrous, 676829-1L |
| Straight tapered fine tip forceps | Fisher Scientific | 16-100-113 | |
| Fluorinert FC-40 solvent | Sigma Aldrich | F9755-100ML | Fluorinated solvent for fPTFE |
| Cell culture grade water (endotoxin-free) | Fisher Scientific | SH30529LS | |
| Poly(methyl methacrylate) (PMMA) | Sigma Aldrich | 182230-25G | |
| Sylgard 184 elastomer kit | Fisher Scientific | 50822180 | |
| Teflon-AF (fPTFE) | Sigma Aldrich | 469610-1G | Poly[4,5-difluoro-2,2-bis(trifluoromethyl)-1,3-dioxole-co-tetrafluoroethylene] |
| Consumables | |||
| Adhesive plate seals | Fisher Scientific | AB-0580 | |
| Axygen microtubes, 1.5 mL | Fisher Scientific | 14-222-155 | |
| Borosilicate glass scintillation vials, with white polypropylene caps | Fisher Scientific | 03-337-4 | |
| Clear PS 48-well plate | Fisher Scientific | 08-772-52 | |
| Clear TCPS 96-well plate | Fisher Scientific | 08-772-2C | |
| Clear TCPS 48-well plate | Fisher Scientific | 08-772-1C | |
| Cover glasses, circles | Fisher Scientific | 12-545-81 | |
| Falcon tissue culture treated flasks, T25 | Fisher Scientific | 10-126-10 | |
| sticky-Slide 8 Well | Ibidi | 80828 | |
| Superfrost microscope slides | Fisher Scientific | 12-550-15 | |
| Tissue culture treated flasks, T150 | Fisher Scientific | 08-772-48 |
References
- Anderson, J. M., Rodriguez, A., Chang, D. T. Foreign body reaction to biomaterials. Seminars in Immunology. 20 (2), 86-100 (2008).
- Anderson, J. M., Miller, K. M. Biomaterial biocompatibility and the macrophage. Biomaterials. 5 (1), 5-10 (1984).
- Collier, T. O., Anderson, J. M. Protein and surface effects on monocyte and macrophage adhesion, maturation, and survival. Journal of Biomedical Materials Research. 60 (3), 487-496 (2002).
- Bianchi, M. E. DAMPs, PAMPs and alarmins: all we need to know about danger. Journal of Leukocyte Biology. 81 (1), 1-5 (2007).
- McKiel, L. A., Fitzpatrick, L. E. Toll-like Receptor 2-Dependent NF-κB/AP-1 Activation by Damage-Associated Molecular Patterns Adsorbed on Polymeric Surfaces. ACS Biomaterials Science & Engineering. 4 (11), 3792-3801 (2018).
- Babensee, J. E. Interaction of dendritic cells with biomaterials. Seminars in Immunology. 20 (2), 101-108 (2008).
- Sintes, J., Romero, X., de Salort, J., Terhorst, C., Engel, P. Mouse CD84 is a pan-leukocyte cell-surface molecule that modulates LPS-induced cytokine secretion by macrophages. Journal of Leukocyte Biology. 88 (4), 687-697 (2010).
- Tom, J. K., Mancini, R. J., Esser-Kahn, A. P. Covalent modification of cell surfaces with TLR agonists improves and directs immune stimulation. Chemical Communications. 49 (83), 9618-9620 (2013).
- Abdulkhalek, S., et al. Neu1 sialidase and matrix metalloproteinase-9 cross-talk is essential for toll-like receptor activation and cellular signaling. Journal of Biological Chemistry. 286 (42), 36532-36549 (2011).
- Gorbet, M. B., Sefton, M. V. Endotoxin: The uninvited guest. Biomaterials. 26 (34), 6811-6817 (2005).
- Xing, Z., Pabst, M. J., Hasty, K. A., Smith, R. A. Accumulation of LPS by polyethylene particles decreases bone attachment to implants. Journal of Orthopaedic Research. 24 (5), 959-966 (2006).
- Ding, H., et al. Comparison of the cytotoxic and inflammatory responses of titanium particles with different methods for endotoxin removal in RAW264.7 macrophages. Journal of Materials Science: Materials in Medicine. 23 (4), 1055-1062 (2012).
- Hoogenboom, R., Becer, C. R., Guerrero-Sanchez, C., Hoeppener, S., Schubert, U. S. Solubility and thermoresponsiveness of PMMA in alcohol-water solvent mixtures. Australian Journal of Chemistry. 63 (8), 1173-1178 (2010).
- Efimenko, K., Wallace, W. E., Genzer, J. Surface modification of Sylgard-184 poly(dimethyl siloxane) networks by ultraviolet and ultraviolet/ozone treatment. Journal of Colloid and Interface Science. 254 (2), 306-315 (2002).
- Godek, M. L., Sampson, J. A., Duchsherer, N. L., McElwee, Q., Grainger, D. W. Rho GTPase protein expression and activation in murine monocytes/macrophages is not modulated by model biomaterial surfaces in serum-containing in vitro cultures. Journal of Biomaterials Science. Polymer Edition. 17 (10), 1141-1158 (2006).
- Park, J. S., et al. Involvement of Toll-like Receptors 2 and 4 in Cellular Activation by High Mobility Group Box 1 Protein. Journal of Biological Chemistry. 279 (9), 7370-7377 (2004).
- Ohashi, K., Burkart, V., Flohé, S., Kolb, H. Cutting Edge: Heat Shock Protein 60 Is a Putative Endogenous Ligand of the Toll-Like Receptor-4 Complex. The Journal of Immunology. 164 (2), 558-561 (2000).
- Wong, T., McGrath, J. A., Navsaria, H. The role of fibroblasts in tissue engineering and regeneration. British Journal of Dermatology. 156 (6), 1149-1155 (2007).
- van Wachem, P. B., et al. The influence of protein adsorption on interactions of cultured human endothelial cells with polymers. Journal of Biomedical Materials Research. 21 (6), 701-718 (1987).
- Miller, K. M., Anderson, J. M. Human monocyte/macrophage activation and interleukin 1 generation by biomedical polymers. Journal of Biomedical Materials Research. 22 (8), 713-731 (1988).
- Bonfield, T. L., Colton, E., Anderson, J. M. Plasma protein adsorbed biomedical polymers: Activation of human monocytes and induction of interleukin 1. Journal of Biomedical Materials Research. 23 (6), 535-548 (1989).
- González, O., Smith, R. L., Goodman, S. B. Effect of size, concentration, surface area, and volume of polymethylmethacrylate particles on human macrophages in vitro. Journal of Biomedical Materials Research. 30 (4), 463-473 (1996).
- Anderson, J. M., et al. Protein adsorption and macrophage activation on polydimethylsiloxane and silicone rubber. Journal of Biomaterials Science. Polymer Edition. 7 (2), 159-169 (1995).
- Lord, M. S., Foss, M., Besenbacher, F. Influence of nanoscale surface topography on protein adsorption and cellular response. Nano Today. 5 (1), 66-78 (2010).
- Chen, S., et al. Characterization of topographical effects on macrophage behavior in a foreign body response model. Biomaterials. 31 (13), 3479-3491 (2010).
- Shen, M., Horbett, T. A. The effects of surface chemistry and adsorbed proteins on monocyte/macrophage adhesion to chemically modified polystyrene surfaces. Journal of Biomedical Materials Research. 57 (3), 336-345 (2001).
- Love, R. J., Jones, K. S. The recognition of biomaterials: Pattern recognition of medical polymers and their adsorbed biomolecules. Journal of Biomedical Materials Research Part A. 101 (9), 2740-2752 (2013).
- McNally, A. K., Anderson, J. M. Phenotypic expression in human monocyte-derived interleukin-4-induced foreign body giant cells and macrophages in vitro: Dependence on material surface properties. Journal of Biomedical Materials Research Part A. 103 (4), 1380-1390 (2015).
- Gambhir, V., et al. The TLR2 agonists lipoteichoic acid and Pam3CSK4 induce greater pro-inflammatory responses than inactivated Mycobacterium butyricum. Cellular Immunology. 280 (1), 101-107 (2012).
- Suzuki, O., Yagishita, H., Yamazaki, M., Aoba, T. Adsorption of Bovine Serum Albumin onto Octacalcium Phosphate and its Hydrolyzates. Cells and Materials. 5 (1), 45-54 (1995).
- Johnston, R. L., Spalton, D. J., Hussain, A., Marshall, J. In vitro protein adsorption to 2 intraocular lens materials. Journal of Cataract and Refractive Surgery. 25 (8), 1109-1115 (1999).
- Jin, J., Jiang, W., Yin, J., Ji, X., Stagnaro, P. Plasma proteins adsorption mechanism on polyethylene-grafted poly(ethylene glycol) surface by quartz crystal microbalance with dissipation. Langmuir. 29 (22), 6624-6633 (2013).
- Swartzlander, M. D., et al. Linking the foreign body response and protein adsorption to PEG-based hydrogels using proteomics. Biomaterials. 41, 26-36 (2015).
- Chamberlain, M. D., et al. Unbiased phosphoproteomic method identifies the initial effects of a methacrylic acid copolymer on macrophages. Proceedings of the National Academy of Sciences. 112 (34), 10673-10678 (2015).
- Dillman, W. J., Miller, I. F. On the adsorption of serum proteins on polymer membrane surfaces. Journal of Colloid And Interface Science. 44 (2), 221-241 (1973).
- Ishihara, K., Ziats, N. P., Tierney, B. P., Nakabayashi, N., Anderson, J. M. Protein adsorption from human plasma is reduced on phospholipid polymers. Journal of Biomedical Materials Research. 25 (11), 1397-1407 (1991).
- Warkentin, P., Wälivaara, B., Lundström, I., Tengvall, P. Differential surface binding of albumin, immunoglobulin G and fibrinogen. Biomaterials. 15 (10), 786-795 (1994).
- Berghaus, L. J., et al. Innate immune responses of primary murine macrophage-lineage cells and RAW 264.7 cells to ligands of Toll-like receptors 2, 3, and 4. Comparative Immunology, Microbiology and Infectious Diseases. 33 (5), 443-454 (2010).
- Zhang, Y., Karki, R., Igwe, O. J. Toll-like receptor 4 signaling: A common pathway for interactions between prooxidants and extracellular disulfide high mobility group box 1 (HMGB1) protein-coupled activation. Biochemical Pharmacology. 98 (1), 132-143 (2015).
- Mizel, S. B., Honko, A. N., Moors, M. A., Smith, P. S., West, A. P. Induction of macrophage nitric oxide production by Gram-negative flagellin involves signaling via heteromeric Toll-like receptor 5/Toll-like receptor 4 complexes. Journal of Immunology. 170 (12), 6217-6223 (2003).
- Das, N., et al. HMGB1 Activates Proinflammatory Signaling via TLR5 Leading to Allodynia. Cell Reports. 17 (4), 1128-1140 (2016).
- Pelegrin, P., Barroso-Gutierrez, C., Surprenant, A. P2X7 Receptor Differentially Couples to Distinct Release Pathways for IL-1β in Mouse Macrophage. The Journal of Immunology. 180 (11), 7147-7157 (2008).
- Tak, P. P., Firestein, G. S. NF-κB: A key role in inflammatory diseases. Journal of Clinical Investigation. 107 (1), 7-11 (2001).
- Ashkenazi, A., Dixit, V. M. Death receptors: signaling and modulation. Science. 281 (5381), 1305-1308 (1998).
- Erridge, C. Endogenous ligands of TLR2 and TLR4: agonists or assistants. Journal of Leukocyte Biology. 87 (6), 989-999 (2010).
- Feng, Y., et al. A macrophage-activating, injectable hydrogel to sequester endogenous growth factors for in situ angiogenesis. Biomaterials. 134, 128-142 (2017).
- Lonez, C., et al. Cationic lipid nanocarriers activate Toll-like receptor 2 and NLRP3 inflammasome pathways. Nanomedicine: Nanotechnology, Biology, and Medicine. 10 (4), 775-782 (2014).



