Overview
מקור: נטליה מרטין1, אנדרו ג'יי ואן אלסט1, ריאנון מ. לה-ווק1, וויקטור ג'יי דיריטה1
1 המחלקה למיקרוביולוגיה וגנטיקה מולקולרית, אוניברסיטת מדינת מישיגן
לחיידקים יש את היכולת להחליף חומר גנטי (חומצה דוקסירובונוקלאית, DNA) בתהליך המכונה העברת גנים אופקית. שילוב דנ"א אקסוגני מספק מנגנון שבאמצעותו חיידקים יכולים לרכוש תכונות גנטיות חדשות המאפשרות להם להסתגל לתנאי הסביבה המשתנים, כגון נוכחות של אנטיביוטיקה או נוגדנים (1) או מולקולות שנמצאות בבתי גידול טבעיים (2). ישנם שלושה מנגנונים של העברת גנים אופקית: טרנספורמציה, טרנסדוקציה והטיה (3). כאן נתמקד בטרנספורמציה, ביכולתם של חיידקים לקחת דנ"א חופשי מהסביבה. במעבדה, תהליך הטרנספורמציה כולל ארבעה שלבים כלליים: 1) הכנת תאים מוסמכים, 2) דגירה של תאים מוסמכים עם DNA, 3) שחזור התאים, ו -4) ציפוי התאים לצמיחה של הטרנספורמטים (איור 1).
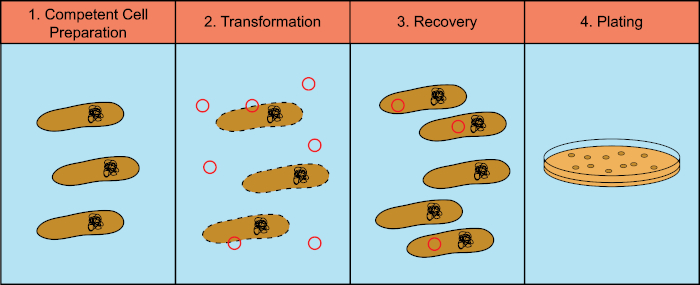
איור 1: שלבים כלליים של תהליך הטרנספורמציה. תהליך הטרנספורמציה כולל ארבעה שלבים כלליים: 1) הכנת תאים מוסמכים, 2) דגירה עם DNA, 3) שחזור התאים ו -4) תאי ציפוי לצמיחת הטרנספורמציה.
כדי שהשינוי יתרחש, חיידק הנמען חייב להיות במצב המכונה כשירות. חיידקים מסוימים יש את היכולת להיות מוכשר באופן טבעי בתגובה לתנאים סביבתיים מסוימים. עם זאת, חיידקים רבים אחרים אינם הופכים כשירים באופן טבעי, או התנאים לתהליך זה עדיין לא ידועים. היכולת להכניס DNA לחיידקים יש מגוון של יישומי מחקר: ליצור עותקים מרובים של מולקולת DNA של עניין, להביע כמות גדולה של חלבונים, כמרכיב בהליכי שיבוט, ואחרים. בגלל הערך של טרנספורמציה לביולוגיה מולקולרית, ישנם מספר פרוטוקולים שמטרתם להפוך תאים כשירים באופן מלאכותי כאשר התנאים לכשירות טבעית אינם ידועים. שתי שיטות עיקריות משמשות להכנת תאים מוסמכים באופן מלאכותי: 1) באמצעות טיפול כימי בתאים ו -2) חשיפת התאים לפולסים חשמליים (אלקטרופורציה). הראשון משתמש בכימיקלים שונים בהתאם להליך כדי ליצור משיכה בין ה- DNA לבין פני התא, בעוד האחרון משתמש בשדות חשמליים כדי ליצור נקבוביות בקרום התא החיידקי שדרכו מולקולות DNA יכולות להיכנס. הגישה היעילה ביותר לכשירות כימית היא דגירה עם סיעות דיווה, בעיקר סידן (Ca2+) (4,5) יכולת הנגרמת על ידי סידן היא ההליך שיתואר כאן (6). שיטה זו משמשת בעיקר להפיכת חיידקים גרם שלילי, וזה יהיה המוקד של פרוטוקול זה.
הליך הטרנספורמציה הכימית כרוך בסדרה של שלבים שבהם תאים נחשפים לתשואות כדי לגרום לכשירות כימית. צעדים אלה מלווה לאחר מכן בשינוי טמפרטורה - הלם חום - המעדיף את ספיגת ה- DNA הזר על ידי התא המוסמך (7). מעטפות תאי החיידקים טעונות לרעה. בחיידקים גרם שליליים כמו Escherichia coli, הממברנה החיצונית טעונה לרעה בשל נוכחות של ליפופוליסכריד (LPS) (8). התוצאה היא דחייה של מולקולות הדנ"א הטעונות באופן שלילי דומה. באינדוקציה של כשירות כימית, יוני סידן טעונים חיובית מנטרלים את דחיית המטען ומאפשרים ספיגת DNA על פני התא (9). טיפול בסידן ודגורה עם DNA נעשים על קרח. לאחר מכן, דגירה בטמפרטורות גבוהות יותר (42 מעלות צלזיוס), הלם החום, מבוצעת. חוסר איזון טמפרטורה זה מעדיף עוד יותר את ספיגת ה- DNA. תאים חיידקיים צריכים להיות בשלב הצמיחה הבינוני כדי לעמוד בטיפול בהלם חום; בשלבי גדילה אחרים תאי החיידק רגישים מדי לחום וכתוצאה מכך אובדן הכדאיות אשר מקטין באופן משמעותי את יעילות הטרנספורמציה.
מקורות DNA שונים יכולים לשמש לטרנספורמציה. בדרך כלל, פלסמידים, מולקולות דנ"א מעגליות קטנות, כפולות גדילים, משמשות לטרנספורמציה ברוב הליכי המעבדה ב- E. coli. כדי שפלסמידים יישמרו בתא החיידקי לאחר הטרנספורמציה, הם צריכים להכיל מקור של שכפול. זה מאפשר להם להיות משוכפל בתא החיידקי באופן עצמאי מן כרומוזום חיידקי. לא כל תאי החיידקים משתנים במהלך הליך הטרנספורמציה. לכן, טרנספורמציה מניבה תערובת של תאים שעברו טרנספורמציה ותאים שאינם שעברו טרנספורמציה. כדי להבחין בין שתי אוכלוסיות אלה, נעשה שימוש בשיטת בחירה לזיהוי התאים שרכשו את הפלסמיד. Plasmids מכילים בדרך כלל סמנים ניתנים לבחירה, שהם גנים קידוד תכונה המעניקה יתרון לצמיחה (כלומר עמידות לאנטיביוטיקה או כימית או הצלה מ auxotrophy צמיחה). לאחר הטרנספורמציה, תאים חיידקיים מצופים במדיה סלקטיבית, המאפשרת רק צמיחה של התאים שהשתנו. במקרה של תאים שהשתנו עם פלסמיד המעניק עמידות לאנטיביוטיקה נתונה, התקשורת הסלקטיבית תהיה מדיה צמיחה המכילה את האנטיביוטיקה. ניתן להשתמש במספר שיטות שונות כדי לאשר כי המושבות הגדלות במדיה הסלקטיבית הן טרנספורמטים (כלומר שילבו את הפלסמיד). לדוגמה, plasmids ניתן לשחזר תאים אלה באמצעות שיטות הכנה plasmid (10) מתעכל כדי לאשר את גודל plasmid. לחלופין, ניתן להשתמש ב- PCR המושבה כדי לאשר את נוכחותו של plasmid של עניין (11).
מטרת הניסוי היא להכין תאים בעלי יכולת כימית E. coli DH5α, תוך שימוש בהסתגלות של הליך הסידן כלוריד (12), ולהפוך אותם עם pUC19 פלסמיד כדי לקבוע את יעילות הטרנספורמציה. זן E. coli DH5α הוא זן נפוץ ביישומי ביולוגיה מולקולרית. בגלל הגנוטיפ שלה, במיוחד recA1 ו endA1, זן זה מאפשר יציבות הכנס מוגברת ולשפר את איכות ה- DNA plasmid בהכנות הבאות. מאז יעילות הטרנספורמציה פוחתת עם הגדלת גודל ה- DNA, pUC19 plasmid שימש בפרוטוקול זה בגלל גודלו הקטן (2686 bp) (ראה https://www.mobitec.com/cms/products/bio/04_vector_sys/standard_cloning_vectors.html עבור מפה וקטורית). pUC19 מעניק עמידות אמפיצ'ילין ולכן, זה היה האנטיביוטיקה המשמשת לבחירה.
Procedure
פרוטוקול זה מתאר את ההכנה וההפיכה של E. coli DH5α מוסמך באמצעות הסתגלות של הליך סידן כלורי (12).
1. הגדרת
-
ציוד
- ספקטרופוטומטר
- צנטריפוגה סורבה (או שווה ערך)
- צנטריפוגה על הספסל
- בלוק חום או אמבט מים
- שייקר מסלולית
- חממה נייחת
- מגש יציקת ג'ל
- ובכן מסרקים
- מקור מתח
- קופסת ג'ל
- מקור אור UV
- מיקרוגל
-
פתרונות ותגמולים
- ציר לוריא-ברטאני (LB) (10 גר' קזאין אנזימי הידרוליזאט, 5 גר' תמצית שמרים ו-5 גר' נתרן כלורי ב-1,000 מ"ל של H2O)
- מרק סופר אופטימלי עם דיכוי קטבוליט (SOC): (2% (w/v) טריפטון, 0.5% (w/v) תמצית שמרים, 10 mM NaCl, 2.5 mM KCl, 10 mM MgCl2, 10 מ"מ MgSO4,ו 20 mM גלוקוז)
- פתרון CaCl2-MgCl2 (80 מ"מ MgCl2, 20 מ"מ CaCl2).
- פתרון M CaCl2 (אם תאים ישתנו באופן מיידי) או פתרון 0.1M CaCl2 המכיל 10% (v/v) גליסול (אם תאים יוקפאו לשימוש עתידי).
- לוחות אגר LB
- לוחות סלקטיביים אגר LB (לניסוי זה, מאז plasmid בשימוש מעניק עמידות אמפיצלין, לוחות אגר LB המכיל אמפיצלין 100 מיקרוגרם / mL שימשו)
- אי קולי זן DH5α
- פלסמיד pUC19 DNA (100 pg / μl)
- ערכת מיני-הכנה ספין QIAprep (קיאגן)
- הינדי אנזים הגבלת III
- 1 kb בתוספת סולם DNA
- אגרוז נקודת התכה נמוכה
- 1X TAE buffer (בסיס טריס 40 מ"מ, 20 מ"מ חומצה אצטית ו-1mM EDTA)
- אתידיום ברומיד (10 מ"ג/מ"ל)
-
הערות בטיחות כלליות
אי קולי DH5α מסווג כ-Biosafety רמה 1 (BSL1). חיידקים בקטגוריה זו מהווים איום קטן עד לא קטן של זיהום אצל מבוגרים בריאים. עם זאת, נדרשת מניפולציה זהירה של המיקרואורגניזם.
חשוב כל השלבים בפרוטוקול זה צריך להתבצע באמצעות טכניקות אספטיות ועל קרח או 4 מעלות צלזיוס, אלא אם צוין.
2. פרוטוקול
- מתוך מלאי קפוא של E. coli DH5α (קפוא ב 20% גלילסול מתרבות לילה גדל LB) פס החוצה חיידקים לבידוד על צלחת אגר LB. דגירה ב 37°C לילה (16-20 שעות).
- לחסן מושבה אחת לתוך 3 מ"ל של מרק LB בצינור. תגדלו רועדים ב-210 סל"ד ב-37°C בלילה (16-20 שעות).
- מדוד את OD600 של תרבות הלילה. השתמש בתרבות הלילה כדי לחסן 100 מ"ל של מרק LB בבקבוקון 1 ליטר ל- OD600 = 0.01. לדגור על התרבות רועדת במרץ (210 סל"ד) ב 37 מעלות צלזיוס ניטור OD600 בספקטרופוטומטר כל 15-20 דקות, עד התרבות מגיעה OD600 = 0.35 (כ 3 שעות).
הערה: כדי שהטרנספורמציה תהיה יעילה, תאים חיידקיים צריכים להיות בשלב צמיחה בינוני מעריכי. המספר המרבי של תאים צריך להיות 108 תאים / מ"ל, אשר עבור רוב הזנים של E. coli מתאים OD600 = 0.4. השימוש בספקטרופוטומטר מאפשר למדוד את OD600, המאפשר לקבוע כי התאים נמצאים בשלב הצמיחה המתאים. אם פרוטוקול זה ישמש לזנים אחרים של חיידקים, כיול כדי לקבוע את מספר המושבות היוצרות יחידות בערכי OD600 ספציפיים יהיה צורך לקבוע מתאם זה. - העבר את 50 מ"ל של התרבות לכל אחד מ -2 בקבוקי צנטריפוגה פוליפרופילן קר כקרח. מניחים את הבקבוקים על קרח במשך 20 דקות כדי להתקרר.
- לשחזר את התאים על ידי צנטריפוגה ב 2700g (4100 סל"ד ברוטור GSA סורבאלי) במשך 10 דקות ב 4°C.
- הסר את סופר-טבעי. לנקז את עקבות האחרונים של מדיה על ידי הנחת הבקבוק הפוך על כרית או מגבת נייר.
- resuspend כל גלולה חיידקית לתוך 30 מ"ל של CaCl2-MgCl2 (80 mM MgCl2,20 mM CaCl2) פתרון קר כקרח. ראשית להוסיף 5 מ"ל של הפתרון, מערבולת בזהירות עד הכדור נמס לחלוטין ולאחר מכן להוסיף את 25 מ"ל הנותרים של פתרון.
- חזור על שלב 2.4.
- חזור על שלב 2.5.
- אם תאים מוסמכים הולכים להשתנות ישירות, resuspend כל גלולה חיידקית לתוך 2 מ"ל של CaCl2 (0.1 M) פתרון קר כקרח על ידי מערבולת הצינורות בזהירות. אם הכדור אינו מקבל resuspended עם שיטה זו, resuspend על ידי צנרת בעדינות למעלה ולמטה (הימנעות היווצרות בועה).
לחלופין, ניתן להקפיא ולאחסן את התאים המוסמכים לשימוש מאוחר יותר. כדי להכין מלאי קפוא של תאים מוסמכים, resuspend הכדור ב 2 מ"ל של פתרון 0.1M CaCl2 המכיל 10% (v/ v) גליסrol. פתרון זה צריך להיות קר כקרח. השעיית תאי Aliquot לתוך צינורות פוליפרופילן 1.5 מ"ל קרים כקרח (160 μl לכל צינור). להקפיא תאים מוסמכים מיד באמבט קרח / אתנול יבש. מעבירים צינורות למקפיא בטמפרטורה של -70 מעלות צלזיוס. - כדי להפוך את CaCl2תאים שטופלו, להעביר 50 μl של תאים מוסמכים לכל אחד 2 צינורות פוליפרופילן 1.5 מ"ל. הוסף את 1 μl (100 pg) של PUC19 plasmid DNA לאחד הצינורות ולהשאיר את הצינור השני ללא DNA (שליטה שלילית). מערבבים בעדינות (הימנעו מהיווצרות בועה). דגירה במשך 30 דקות על קרח.
הערה: לא יותר מ 50 ננוגרם של DNA בנפח של 10 μL או פחות צריך לשמש טרנספורמציה. - מעבירים את הצינורות לבלוק החום ודגר ב-42 מעלות צלזיוס למשך 45 מעלות בדיוק.
הערה: הלם חום הוא צעד קריטי. אין לחרוג מהטמפרטורה או זמן הדגירה. - בקלות להעביר צינורות לקרח. דגירה במשך 2 דקות.
- הוסף 950 μL של מדיה SOC ודגור את הצינורות במשך שעה אחת ב 37 מעלות צלזיוס כדי לאפשר לחיידקים להתאושש ולהביע את הסמן עמיד לאנטיביוטיקה מקודד plasmid.
- לדלל 10 μL של השעיית התא ב 1000 μL ב SOC (1/100 דילול) ו 100 μL של השעיית התא ב 1000 μL ב SOC (1/10 דילול). צלחת 100 μl של דילול, כמו גם את השליטה, על לוחות סלקטיביים, ולהפיץ באמצעות מרית. בדרך כלל, ציפוי 100 μL של דילול 1/100 ו 1/10 יניב מספיק מספר של מושבה להרכיב יחידות (cfu) לכל צלחת. באופן אידיאלי, מספר זה צריך לנוע בין 30-300 cfu, כך שיש מספיק מושבות אבל מופרדים אחד מהשני. עם זאת, מספר cfu יהיה תלוי ביעילות ההמרה (ראה ניתוח נתונים ותוצאות סעיף).
- לדגור על הצלחות ב 37°C. מושבות שעברו טרנספורמציה אמורות להופיע בעוד 12-16 שעות (טווח זה יהיה תלוי במתח התא ובשיטת הבחירה). אף מושבה לא צריכה לגדול בשליטה השלילית.
- ספר את cfu / צלחת המתקבל עבור ההמרה(טבלה 1).
- כדי לאמת את טרנספורמטורים מחסה pUC19 plasmid, הכנה plasmid ועיכול לאחר מכן יבוצע. כדי לשים קץ, לחסן מושבה אחת לתוך 3 מ"ל של מרק LB בצינור. תגדלו רועדים ב-210 סל"ד ב-37°C בלילה (16-20 שעות).
- הכן הכנת פלסמיד באמצעות ערכת מיני-הכנה ספין QIAprep, בהתאם להוראות היצרן.
- לעכל את 1 מיקרוגרם של pUC19 מטוהר עם אנזים ההגבלה HindIII ב 37°C במשך 1 שעה.
הערה: כל אנזים שחותך באתר שיבוט מרובים pUC19 יכול לשמש עבור שלב זה.
| רכיב | כמות |
| מאגר תקציר הגבלות של 10X | 2.5 מיקרול |
| פלסמיד pUC19 | 1 מיקרוגרם |
| הינדי השלישי | 1 מיקרול |
| ח2O | 20.5 μl (ל 25 μl) |
- הפעל סולם משקל מולקולרי, DNA pUC19 מעוכל ואותה כמות של DNA pUC19 לא מעוכל בג'ל אגרוז 1% המכיל 1 מיקרוגרם / מ"ל אתידיום ברומיד במשך שעה אחת ב 95 V.
הערה: הזמן והמתח ישתנו בהתאם לציוד המשמש. - דמיינו ג'ל תחת אור UV. השווה את גודל הדנ"א pUC19 המעוכל והבלתי מעוכל(איור 2)(ראה סעיף ניתוח נתונים ותוצאות).
המשך בצעדים הדרושים כדי לאמת את השינוי בהתאם למטרה של כל ניסוי טרנספורמציה מסוים.

איור 2: עיכול של DNA פלסמיד שהתאושש מתאי DH5α שעברו טרנספורמציה. DNA Plasmid התאושש מתאי DH5α שעברו טרנספורמציה, מתעכלים עם HindIII, לרוץ בג'ל אגרוז 1% ודמיינו עם מקור UV (שלבים 2.19 עד 2.22).
3. ניתוח נתונים ותוצאות
כדי לחשב את יעילות הטרנספורמציה, אינדיקטור עד כמה התאים לקחו את ה- DNA החוץ-תאי, המושבות שהושגו בטרנספורמציה צריכות להיספר:
| דילול | Cfu |
| 1/100 | 34 |
| 1/10 | 246 |
טבלה 1: יחידות יוצרות מושבה (cfu) שנספרו מניסוי טרנספורמציה.
יעילות טרנספורמציה (TE) היא מדד של מספר cfu הנובע מהפיכת 1 מיקרוגרם של plasmid לאמצעי אחסון נתון של תאים מוסמכים. פרמטרים רבים משפיעים על יעילות הטרנספורמציה: גודל plasmid, גנוטיפ התא, שלב הצמיחה במהלך הכנת יכולת, שיטות של טרנספורמציה, וכו '). בעת חישוב TE חשוב לשקול איזה דילול (אם בכלל) בוצע לפני ה ציפוי ולשלב אותו בחישוב המספר הכולל של cfu. יעילות ההמרה (TE) מחושבת באמצעות המשוואה הבאה:

ראשית לחלק את cfu על ידי מיקרוגרם של DNA, בדוגמה זו 0.0001μg. לאחר מכן לחלק את התוצאה על ידי גורם הדילול. בדוגמה זו, נעשה שימוש בדילול של 1/10 ו- 100μL של פתרון 1 מ"ל היה מצופה (דילול: 1/10 × 100 μL / 1000 μL = 0.01).

חיידקים ניתנים להסתגלות להפליא ומנגנון אחד המאפשר הסתגלות זו הוא יכולתם לקלוט מולקולות DNA חיצוניות. סוג אחד של דנ"א שחיידקים יכולים ספיגה נקרא פלסמיד, פיסת דנ"א מעגלית המכילה לעתים קרובות מידע שימושי, כגון גנים עמידים לאנטיביוטיקה. תהליך ההנדסה של חיידקים על ידי מידע גנטי חדש המשולב ממקור חיצוני מכונה טרנספורמציה. טרנספורמציה יכולה להתבצע בקלות במעבדה באמצעות Escherichia coli, או E. coli.
על מנת להשתנות, תאי אי קולי חייבים תחילה להיות כשירים, כלומר מסוגלים לקחת מולקולות DNA מהסביבה שלהם. הפרוטוקול לביצוע זה הוא פשוט באופן מפתיע, דגירה קצרה של התאים בתמיסת סידן כלורי. דגירה זו גורמת לתאים להיות חדירים למולקולות DNA. לאחר שהתאים מגולפים על ידי צנטריפוגה, הסופר-נט מוסר. הדנ"א הפלסמיד מתווסף כעת לתאים המוסמכים. לאחר דגירה של התאים עם DNA, התערובת מחוממת לזמן קצר ל 42 מעלות צלזיוס, ואחריו קירור מהיר על קרח. הלם חום זה גורם לדנ"א להיות מועבר על פני דופן התא והממברנות. לאחר מכן התאים דוגרים במדיה טרייה. לאחר מכן, החיידקים ממוקמים ב 37 מעלות כדי לאפשר להם לאתם מחדש את הממברנות שלהם ולהביע חלבונים עמידים.
אותם תאים שנטלו את הפלסמידים יעתיקו בנאמנות את הדנ"א ויעבירו אותו לצדדים שלהם ויבטאו את כל החלבונים שעשויים להיות מקודדים על ידיו, כולל מתווכים עמידים לאנטיביוטיקה. גנים התנגדות אלה יכולים לשמש סמנים לבחירה כדי לזהות חיידקים אשר השתנו בהצלחה כי תאים שלא לקחו את plasmid לא יבטא את המוצר גן ההתנגדות. משמעות הדבר היא כי כאשר התאים מצופים על מדיום מוצק המכיל את האנטיביוטיקה המתאימה, רק תאים שלקחו את plasmid יגדל. טרנספורמציה של התאים במושבה גדלה ניתן לאשר עוד יותר על ידי culturing תאים אלה בתקשורת נוזלית בן לילה כדי להגדיל את התשואה לפני חילוץ ה- DNA מן המדגם. ברגע שהדנ"א מבודד, ניתן לבצע תקציר אנזים להגבלת אבחון. מכיוון שאנזימי הגבלה חותכים דנ"א במקומות צפויים, הפעלת תקצירים אלה על ג'ל אמורה להראות דפוס צפוי אם הפלסמיד הרצוי השתנה בהצלחה. לדוגמה, אם pUC19 מוכן וחתוך עם אנזים ההגבלה HindIII, להקה אחת של 2686 נוקלאוטידים צריך להיראות על הג'ל.
במעבדה זו, תוכלו להפוך E. coli זן DH-5 אלפא עם pUC19, ולאחר מכן לאשר את השינוי המוצלח על ידי אלקטרופורזה ג'ל DNA.
לפני תחילת ההליך, לבשו את ציוד המגן האישי המתאים, כולל חלוק מעבדה וכפפות. לאחר מכן, לעקר את סביבת העבודה עם 70% אתנול.
עכשיו, להכין תאים מוכשרים כימית על ידי הפקדת לולאה של חיידקים על צלחת אגר LB סטרילית פסים החיידקים עם לולאה חדשה. לאחר מכן, לדגור על הצלחת ב 37 מעלות צלזיוס בן לילה. למחרת, לחטא את הספסל העליון עם 70% אתנול שוב, ולהסיר את הצלחת מן האינקובטור.
לחסן מושבה אחת, מבודדת היטב לתוך 3 מיליליטר של מרק LB בצינור עם לולאה סטרילית. לאחר מכן, להגדיל את התרבות ב 37 מעלות צלזיוס בן לילה, עם רועד ב 210 סל"ד. למחרת, למדוד את הצפיפות האופטית של תרבות הלילה עם ספקטרופוטומטר. לאחר מכן, להוסיף 100 מיליליטר של מרק LB לבקבוק ליטר אחד, ולחסן אותו עם תרבות הלילה בצפיפות אופטית של 0. 01. עכשיו, לדגור על התרבות ב 37 מעלות צלזיוס עם רועד, ולבדוק את OD600 כל 15 עד 20 דקות עד התרבות מגיעה לשלב הצמיחה באמצע מעריכי.
לאחר כשלוש שעות, להעביר 50 מיליליטר של התרבות לשני בקבוקי פוליפרופילן קר כקרח. לאחר מכן, מניחים את הבקבוקים בחזרה על קרח במשך 20 דקות כדי להתקרר. לאחר מכן, לשחזר את התאים באמצעות צנטריפוגה. משליכים את אנטנטי העל ומניחים את הבקבוקים הפוכים על מגבת נייר. לאחר מכן, resuspend הכדור החיידקי בחמישה מיליליטר של סידן כלורי קר כקרח תמיסת מגנזיום כלורי ולהסתובב בזהירות עד הכדור נמס לחלוטין. לאחר מכן, להוסיף עוד 25 מיליליטר של הפתרון לכדור חיידקי מומס. resuspend גלולה חיידקית אחרת כפי שהוכח בעבר. לאחר מכן, חזור על הצנטריפוגה, ולהסיר את supernatants.
אם התאים המוסמכים הולכים להשתנות ישירות, resuspend כל גלולה חיידקית בשני מיליליטר של קר כף המבתנת 0.1 תמיסת סידן כלורי טוחנת על ידי מערבולת הצינורות בזהירות. כדי להתחיל את הליך הטרנספורמציה, העבר 50 מיקרוליטרים של תאים מוסמכים לשני צינורות פוליפרופילן 1.5 מיליליטר. לאחר מכן, הוסף מיקרוליטר אחד של PUC19 PLASMID DNA לאחד הצינורות. מערבבים בעדינות, נמנעים היווצרות בועה, ודגרה את שני הצינורות במשך 30 דקות על קרח. לאחר הדגירה, להעביר את הצינורות לבלוק חום ודגור ב 42 מעלות צלזיוס במשך 45 שניות. מיד להעביר את הצינורות לקרח, ודגרה במשך שתי דקות. עכשיו, להוסיף 950 microliters של מדיה SOC לכל צינור ולדגירה אותם במשך שעה אחת ב 37 מעלות צלזיוס כדי לאפשר לחיידקים להתאושש, ולהביע את הסמן עמיד לאנטיביוטיקה מקודד plasmid.
כדי ליצור דילול של 1 עד 100, הוסף 990 מיקרוליטרים של מדיה SOC ו -10 מיקרוליטרים של השעיית תאים לצינור 1.5 מיליליטר. לאחר מכן, לעשות דילול 1 עד 10 על ידי הוספת 900 microliters של מדיה SOC ו 100 microliters של השעיית תאים לצינור 1.5 מיליליטר. לאחר מכן, צלחת 100 microliters של מתלים תאים מדוללים 100 microliters של השליטה השלילית, על לוחות סלקטיביים נפרדים המכילים אמפיצילין באמצעות מפזר ודגורת הלוחות ב 37 מעלות צלזיוס במשך 12 עד 16 שעות. לאחר הדגירה, לספור את יחידות יוצרי המושבה, או יחידות יוצרות מושבה, לכל צלחת, שהושגו באמצעות טרנספורמציה, ולתעד נתונים אלה. כדי לוודא כי טרנספורמטורים יש pUC19 plasmid, לבחור מושבה אחת, מבודד היטב מצלחת עם לולאה סטרילית, ולהציג אותו צינור המכיל 3 מיליליטר של מרק LB. לאחר מכן, לדגור על התרבות ב 37 מעלות צלזיוס עם רועד, בן לילה. למחרת, להשתמש בערכת מיני DNA כדי לבודד DNA מ 3 מיליליטר של התרבות, על פי הוראות היצרן. לאחר השלמת הכנת מיני DNA, לעכל את 1 מיקרוגרם של pUC19 מטוהר עם אנזים הגבלה ב 37 מעלות צלזיוס במשך שעה אחת. עכשיו, לטעון 20 microliters של סולם משקל מולקולרי, 1 מיקרוגרם של DNA plasmid מעוכל, ו 1 מיקרוגרם של DNA plasmid מעוכל לתוך בארות רצופות של ג'ל אגרוז 1% המכיל 1 מיקרוגרם למיליליטר אתידיום ברומיד. לאחר מכן, להפעיל את הג'ל במשך 1 שעה ב 95 וולט. לבסוף, דמיינו את הג'ל עם מאיר UV.
בניסוי זה, E. coli DH5 אלפא תאים מוסמכים כימית הוכנו באמצעות הסתגלות של הליך סידן כלורי, ולאחר מכן השתנה עם pUC19 plasmid כדי לקבוע את יעילות הטרנספורמציה. כדי לחשב את יעילות הטרנספורמציה, השתמש בספירות CFU המתועדים עבור 1 ל- 100 ו- 1 ב- 10 דילולים, ובכל דילול אחר עם ספירת CFU בין 30 ל- 300. ראשית, ספירת יחידות הסביבה המתועדת, 246 בדוגמה זו, מחולקת בכמות הדנ"א, 0.0001 מיקרוגרם כאן, שהייתה מצופה. לאחר מכן, מספר זה מחולק על ידי גורם הדילול המשמש כדי לתת את יעילות הטרנספורמציה ב- CFUs למיקרוגרם. בדוגמה זו, נעשה שימוש בדילול של 1 עד 10 ו-100 מיקרוליטרים של תמיסת מיליליטר 1 היו מצופים, מה שנותן גורם דילול סופי של 0.01. בנתיב הפלסמיד הלא מעוכל, הדנ"א המעגלי עשוי להופיע כשתיים או שלוש רצועות שונות של בהירות משתנה. הסיבה לכך היא שהדנ"א המעגלי והלא חתוך עשוי להתקיים במספר מצבי קונפורמציה שונים, כגון עיגול פתוח או ליניארי יותר, וכל אחד מהם נע דרך הג'ל בקצבים שונים. ניתוח של עיכול DNA plasmid התאושש הצביע על כך plasmid בשימוש יש גודל צפוי של DNA pUC19, 2,686 זוגות בסיס.
Subscription Required. Please recommend JoVE to your librarian.
Results
למרות ש- TE תלוי בגורמים רבים, תכשירי תאים שאינם מסחריים, כמו זה, מניבים בדרך כלל 106 עד10 7 טרנספורמטים למיקרוגרם של פלסמיד. לכן, הכנה זו, עם TE = 2.46 x 108 cfu/μg, הניבה TE הרבה מעבר לטווח הצפוי. פרוטוקולים נוספים זמינים ליצירת תאים בעלי יכולת-על כאשר נדרשות יעילות המרה גבוהה יותר עבור יישום נתון (13).
ניתוח העיכול של ה- DNA plasmid התאושש מן התאים שהשתנו עולה כי plasmid זה יש את הגודל הצפוי של DNA pUC19 (2686 bp).
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
טרנספורמציה היא שיטה רבת עוצמה להכנסת דנ"א אקסוגני לתאי חיידקים שהיא המפתח ליישומי ביולוגיה מולקולרית רבים במעבדה. בנוסף, הוא ממלא תפקיד מרכזי בטבע על ידי מתן אפשרות לתאי חיידקים להחליף חומר גנטי שעלול לגרום לשינוי גנטי מוגבר ולאפשר רכישת תכונות מועילות שונות להישרדות תחת מגוון רחב של תנאים. זני חיידקים רבים מקודדים את הגנים הנדרשים לכשירות טבעית. עם זאת, התנאים שבהם גנים אלה מושרים עדיין אינם ידועים. דרוש מחקר נוסף כדי לקבוע תנאים אלה.
Subscription Required. Please recommend JoVE to your librarian.
References
- Croucher, N. J. et al. Rapid pneumococcal evolution in response to clinical interventions. Science. 331 (6016):430-434. (2011)
- Borgeaud, S. et al. The type VI secretion system of Vibrio cholerae fosters horizontal gene transfer. Science. 347(6217):63-67. (2015)
- Burmeister, A. R. Horizontal Gene Transfer. Evol Med Public Health. 2015 (1):193-194. (2015)
- Weston A, Brown MG, Perkins HR, Saunders JR, Humphreys GO. Transformation of Escherichia coli with plasmid deoxyribonucleic acid: calcium-induced binding of deoxyribonucleic acid to whole cells and to isolated membrane fractions. J Bacteriol. 145 (2):780-7. (1981)
- Dagert M, Ehrlich SD. Prolonged incubation in calcium chloride improves the competence of Escherichia coli cells. Gene. 6 (1):23-8. (1979)
- Asif A, Mohsin H, Tanvir R, and Rehman Y. Revisiting the Mechanisms Involved in Calcium Chloride Induced Bacterial Transformation. Front Microbiol. 8:2169. (2017)
- Panja S, Aich P, Jana B, Basu T. How does plasmid DNA penetrate cell membranes in artificial transformation process of Escherichia coli? Mol Membr Biol. 25 (5):411-22. (2008)
- Silhavy, TJ, Kahne D, Walker S. The Bacterial Cell Envelope. Cold Spring Harb Perspect Biol. 2 (5): a000414. (2010)
- Panja S, Aich P, Jana B, Basu T. (2008) Plasmid DNA binds to the core oligosaccharide domain of LPS molecules of E. coli cell surface in the CaCl2-mediated transformation process. Biomacromolecules. 9 (9):2501-9.
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. Plasmid Purification. JoVE, Cambridge, MA. (2018)
- Bergkessel M and Guthrie C. Colony PCR. Methods in Enzymology. 529: 299-309. (2013)
- Sambrook J and Russell DW. Molecular Cloning A Laboratory Manual. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY.Protocol 25 (1.116-118). (2001)
- Wirth R, Friesenegger A, Fiedler S. Transformation of various species of gram-negative bacteria belonging to 11 different genera by electroporation. Molecular & General Genetics. 216 (1): 175-7. (1989)




