12.10:
La loi de l'ébulliométrie et la loi de la cryométrie
12.10:
La loi de l'ébulliométrie et la loi de la cryométrie
Élévation du point d’ébullition
Le point d’ébullition d’un liquide est la température à laquelle sa pression de vapeur est égale à la pression atmosphérique ambiante. Puisque la pression de vapeur d’une solution est abaissée en raison de la présence de solutés non volatiles, il est évident que le point d’ébullition de la solution va par la suite augmenter. La pression de vapeur augmente avec la température, et une solution a donc besoin d’une température plus élevée que ne le fait le solvant pur pour atteindre une pression de vapeur donnée, y compris une pression équivalente à celle de l’atmosphère environnante. L’augmentation du point d’ébullition qui est observée lorsqu’un soluté non volatile est dissous dans un solvant, ΔTé, est appelée l’élévation du point d’ébullition et elle est directement proportionnelle à la molalité des espèces de soluté :
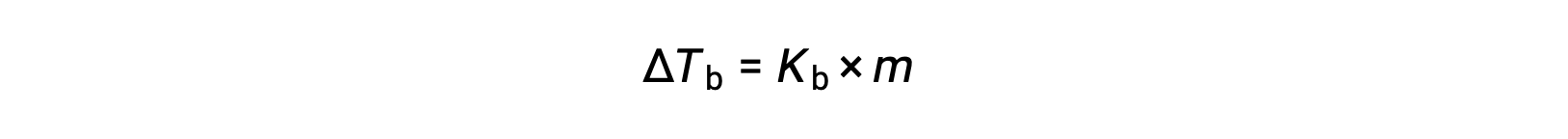
où Ké est la constante d’élévation du point d’ébullition, ou la constante ébullioscopique, et m est la molalité de toutes les espèces de soluté. Les constantes d’élévation du point d’ébullition sont des propriétés caractéristiques qui dépendent de l’identité du solvant.
Dépression du point de congélation
Les solutions gèlent à des températures inférieures à celles des liquides purs. Ce phénomène est mis à profit dans les systèmes de “ dégivrage ” qui utilisent du sel, du chlorure de calcium ou de l’urée pour faire fondre la glace sur les routes et les trottoirs, et dans l’utilisation de l’éthylène glycol comme “ antigel ” dans les radiateurs d’automobiles. L’eau de mer gèle à une température inférieure à celle de l’eau douce, de sorte que les océans Arctique et Antarctique restent sans geler même à des températures inférieures à 0 °C (tout comme les fluides corporels des poissons et autres animaux marins à sang froid qui vivent dans ces océans).
La diminution du point de congélation d’une solution diluée par rapport à celle du solvant pur, ΔTc, est appelée la dépression du point de congélation et elle est directement proportionnelle à la molalité du soluté
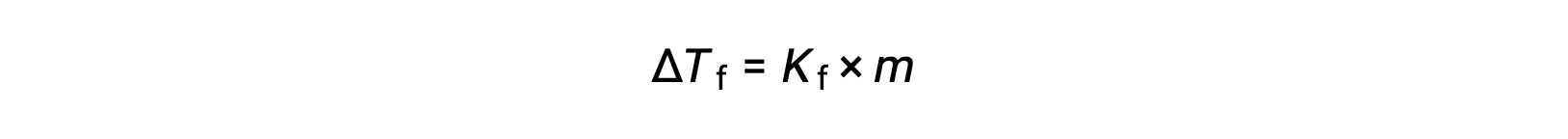
où m est la molalité du soluté et Kc est appelée la constante de dépression du point de congélation (ou constante cryoscopique). Tout comme pour les constantes d’élévation du point d’ébullition, ce sont des propriétés caractéristiques dont les valeurs dépendent de l’identité chimique du solvant.
Détermination des masses molaires
La pression osmotique et les variations du point de congélation, du point d’ébullition et de la pression de vapeur sont directement proportionnels au nombre d’espèces de soluté présentes dans une quantité donnée de solution. Par conséquent, la mesure de l’une de ces propriétés pour une solution préparée en utilisant une masse de soluté connue permet de déterminer la masse molaire du soluté.
Par exemple, une solution de 4,00 g d’un non-électrolyte dissous dans 55,0 g de benzène gèle à 2,32 °C. En supposant un comportement de solution idéale, quelle est la masse molaire de ce composé ?
Pour résoudre ce problème, on calcule d’abord la variation du point de congélation entre le point de congélation qui est observé et le point de congélation du benzène pur :
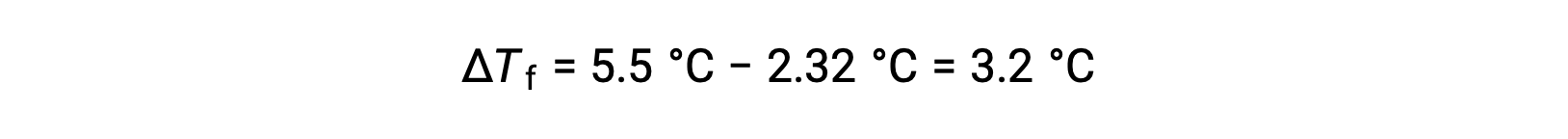
Ensuite, la molité est déterminée à partir de Kc, la constante de dépression du point de congélation pour le benzène, et ΔTc :
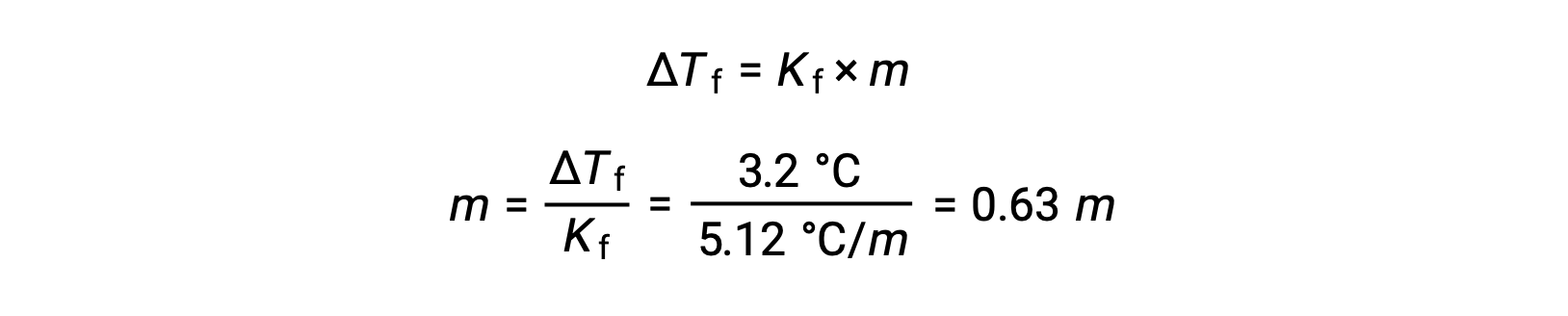
Ensuite, on trouve le nombre de moles du composé dans la solution à partir de la molalité et de la masse de solvant utilisée pour faire la solution.
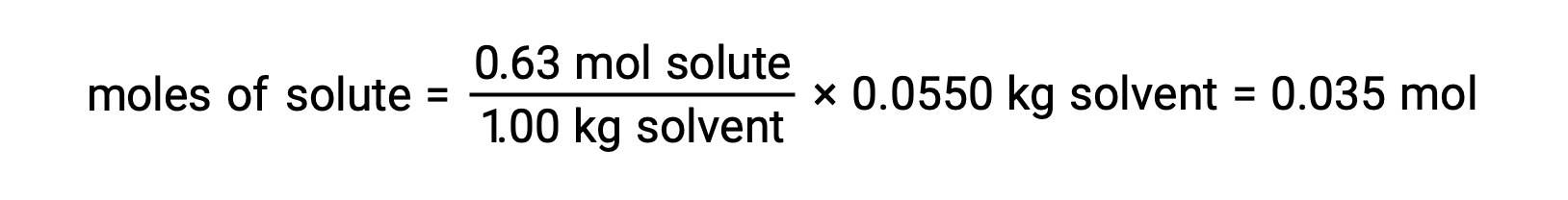
Enfin, on détermine la masse molaire à partir de la masse du soluté et du nombre de moles dans cette masse.
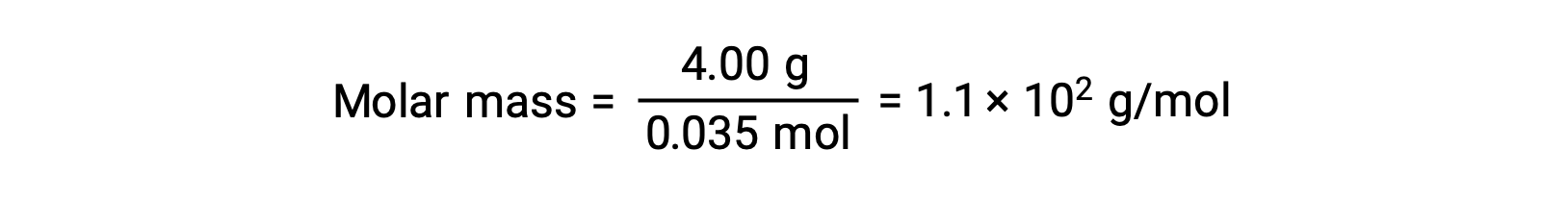
Ce texte est adapté de Openstax, Chimie 2e, Section 11.4 : Propriétés colligatives.
Suggested Reading
- Steffel, Margaret J. "Raoult's law: A general chemistry experiment." Journal of Chemical Education 60, no. 6 (1983): 500.
- Berka, Ladislav H., and Nicholas Kildahl. "Experiments for Modern Introductory Chemistry: Intermolecular Forces and Raoult's Law." Journal of chemical education 71, no. 7 (1994): 613.
