12.10:
Depressão do Ponto de Solidificação e Elevação do Ponto de Ebulição
12.10:
Depressão do Ponto de Solidificação e Elevação do Ponto de Ebulição
Elevação do Ponto de Ebulição
O ponto de ebulição de um líquido é a temperatura à qual a sua pressão de vapor é igual à pressão atmosférica ambiente. Uma vez que a pressão de vapor de uma solução é reduzida devido à presença de solutos não voláteis, é de esperar que o ponto de ebulição da solução seja subsequentemente aumentado. A pressão de vapor aumenta com a temperatura e, por isso, uma solução requer uma temperatura superior à do solvente puro para atingir uma determinada pressão de vapor, incluindo uma equivalente à da atmosfera circundante. O aumento do ponto de ebulição observado quando um soluto não volátil é dissolvido em um solvente, ΔTb, é chamado de elevação do ponto de ebulição e é diretamente proporcional à concentração molal de espécies de soluto:
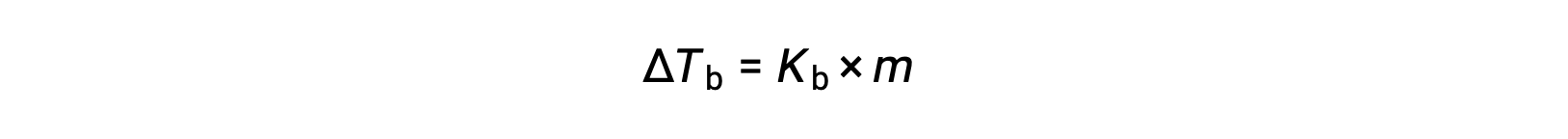
onde Kb é a constante de elevação do ponto de ebulição, ou a constante ebulioscópica e m é a concentração molal (molalidade) de todas as espécies de soluto. As constantes de elevação do ponto de ebulição são propriedades características que dependem da identidade do solvente.
Depressão do Ponto de Solidificação
As soluções congelam a temperaturas mais baixas do que os líquidos puros. Este fenómeno é explorado em esquemas de “descongelamento” que utilizam sal, cloreto de cálcio, ou ureia para derreter gelo em estradas e passeios, e na utilização de etilenoglicol como “anticongelante” em radiadores de automóveis. A água do mar congela a uma temperatura mais baixa do que a água doce e, por isso, os oceanos Árctico e Antárctico permanecem descongelados mesmo a temperaturas inferiores a 0 °C (tal como os fluidos corporais dos peixes e outros animais marinhos de sangue frio que vivem nestes oceanos).
A diminuição do ponto de solidifcação de uma solução diluída em relação ao solvente puro, ΔTf, é denominada depressão do ponto de solidifcação e é diretamente proporcional à concentração molal do soluto
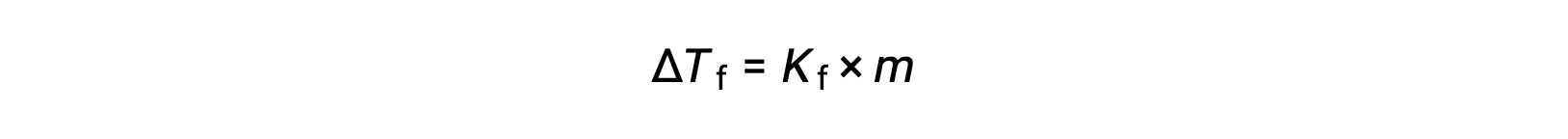
onde m é a concentração molal do soluto e Kf é chamada de constante de depressão do ponto de solidifcação (ou constante crioscópica). Tal como para as constantes de elevação do ponto de ebulição, estas são propriedades características cujos valores dependem da identidade química do solvente.
Determinação das Massas Molares
A pressão osmótica e as alterações no ponto de solidificação, no ponto de ebulição, e na pressão de vapor são diretamente proporcionais ao número de espécies de solutos presentes em uma determinada quantidade de solução. Por conseguinte, a medição de uma destas propriedades para uma solução preparada com uma massa conhecida de soluto permite a determinação da massa molar do soluto.
Por exemplo, uma solução de 4,00 g de um não eletrólito dissolvido em 55,0 g de benzeno pode congelar a 2,32 °C. Assumindo o comportamento ideal da solução, qual é a massa molar deste composto?
Para resolver este problema, calcula-se, em primeiro lugar, a alteração do ponto de solidificação entre o ponto de solidificação observado e o ponto de solidificação do benzeno puro:
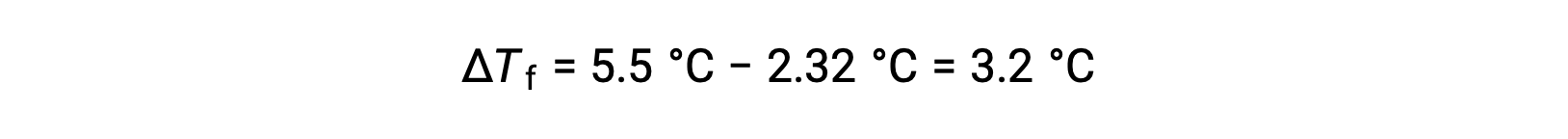
Em seguida, a concentração molal é determinada a partir de Kf, a constante de depressão do ponto de solidificação para o benzeno, e ΔTf:
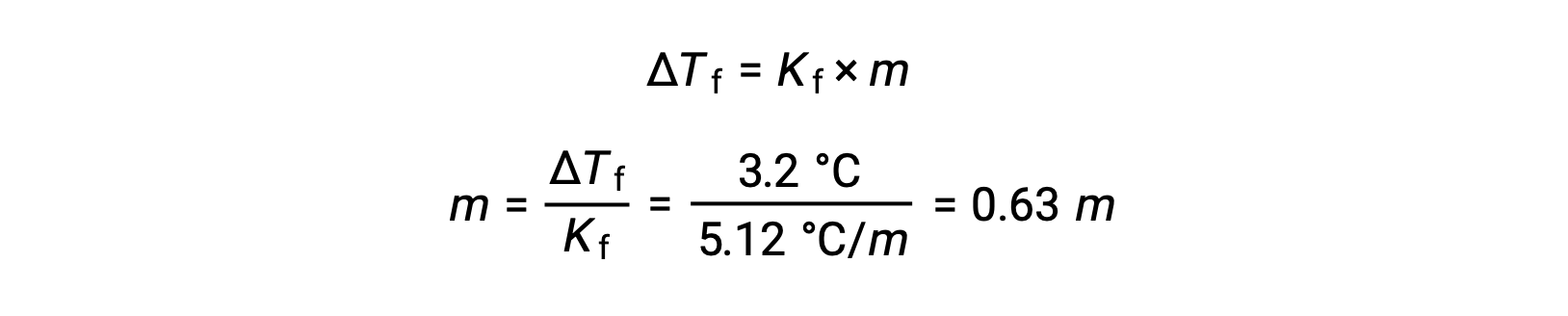
Em seguida, o número de moles do composto na solução é encontrado a partir da concentração molal e da massa de solvente que foi utilizada para a solução.
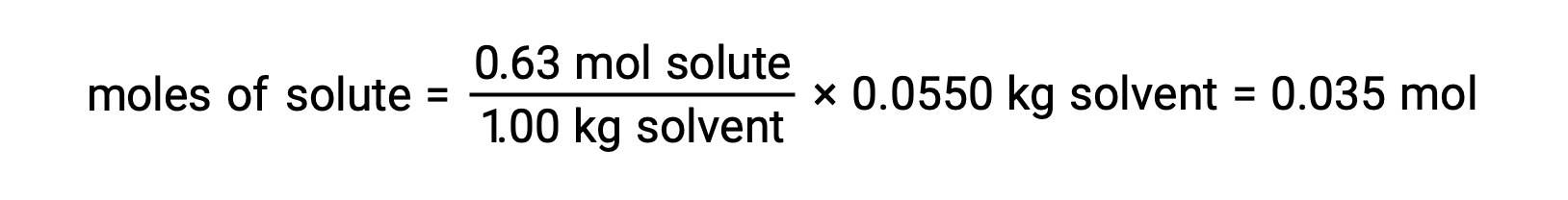
E, por fim, determina-se a massa molar a partir da massa do soluto e do número de moles dessa massa.
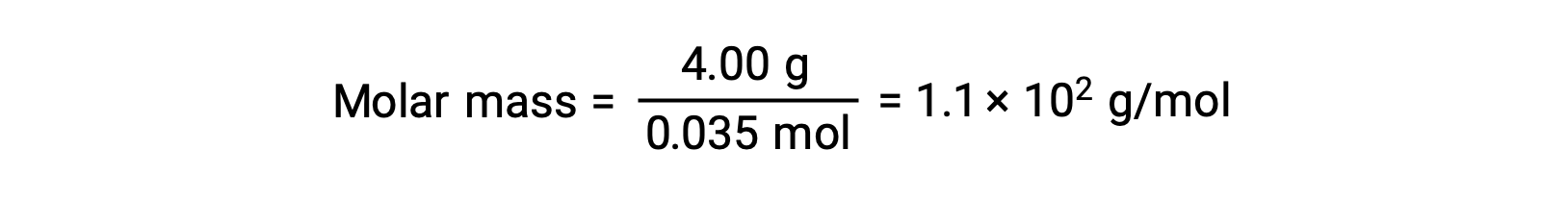
Este texto é adaptado de Openstax, Chemistry 2e, Section 11.4: Colligative Properties.
Suggested Reading
- Steffel, Margaret J. "Raoult's law: A general chemistry experiment." Journal of Chemical Education 60, no. 6 (1983): 500.
- Berka, Ladislav H., and Nicholas Kildahl. "Experiments for Modern Introductory Chemistry: Intermolecular Forces and Raoult's Law." Journal of chemical education 71, no. 7 (1994): 613.
