12.10:
어는점 내림과 끓는점 오름
12.10:
어는점 내림과 끓는점 오름
끓는 점 고도
액체의 비등점은 증기 압력이 주변 대기압과 동일한 온도입니다. 비휘발성 솔루트의 존재로 인해 용액의 증기 압력이 낮아지므로 용액의 비등점이 이후에 증가할 것이라는 추론이 있습니다. 증기 압력은 온도에 따라 증가하므로 용액은 주변 대기와 동등한 것을 포함하여 주어진 증기 압력을 달성하기 위해 순수한 용매보다 더 높은 온도를 필요로합니다. 비휘발성 솔루트가 용매, ΔTb에용해될 때 관찰된 비등점의 증가는 비등점 고도라고 하며, solute 종의 용액 농도에 직접적으로 비례합니다.
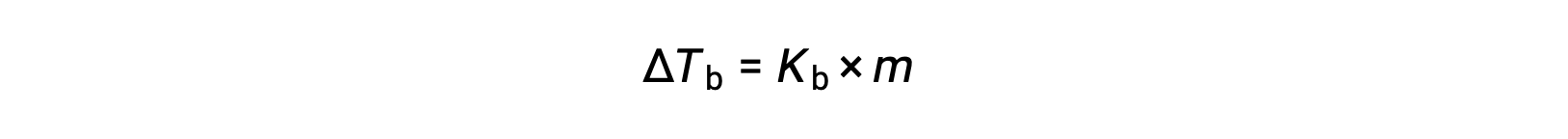
여기서Kb는 비등점 고도상수, 또는 에불리오스스코픽 상수 및 m은 모든 solute 종의 당밀 농도(molality)이다. 비등점 입점 상수는 용매의 ID에 의존하는 특성특성입니다.
동결 포인트 우울증
용액은 순수 액체보다 낮은 온도에서 동결됩니다. 이 현상은 소금, 염화칼슘 또는 우레아를 사용하여 도로와 보도에 얼음을 녹이고, 에틸렌 글리콜을 자동차 라디에이터에서 “부동액”으로 사용하는 “탈 착빙” 계획에서 악용됩니다. 해수는 담수보다 낮은 온도에서 동결되므로 북극과 남극 바다는 0 °C 이하의 온도에서도 얼어 붙지 않고 있습니다 (물고기와 이 바다에 사는 다른 냉혈한 바다 동물의 체액은 마찬가지입니다).
순수 용매인 ΔTf에비해 희석액의 동결점 감소는 동결점 우울증이라고 하며 솔직함의 용액 농도에 직접적으로 비례합니다.
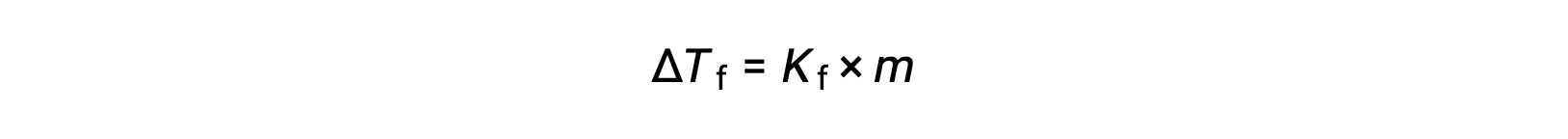
여기서 m은 솔루트와 Kf의 용액 농도가 동결점 우울증 상수(또는 극저온 상수)라고 불린다. 비등점 상승 상수와 마찬가지로, 이러한 값은 용매의 화학적 정체성에 의존하는 특성 특성입니다.
몰라 미사의 결정
삼투압및 동결점, 비등점 및 증기 압력의 변화는 주어진 양의 용액에 존재하는 솔ute 종의 수에 직접적으로 비례한다. 따라서, 알려진 솔루트 질량을 사용하여 준비된 용액에 대한 이러한 특성 중 하나를 측정하면 솔직의 어금니 질량을 측정할 수 있습니다.
예를 들어, 벤젠 55.0 g에 용해된 비전기분해의 4.00 g의 용액은 2.32°C에서 동결되는 것으로 나타났다. 이상적인 솔루션 동작을 가정하면이 화합물의 어금니 질량은 무엇입니까?
이 문제를 해결하기 위해 먼저 관찰된 동결점과 순수 벤젠의 동결점으로부터의 동결점 의 변화가 계산됩니다.
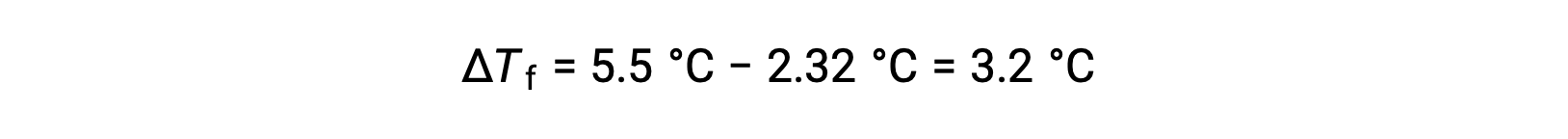
이어서, 몰 농도는Kf로부터결정되며, 벤젠에 대한 동결점 우울증상수, Δ Tf로부터결정된다:
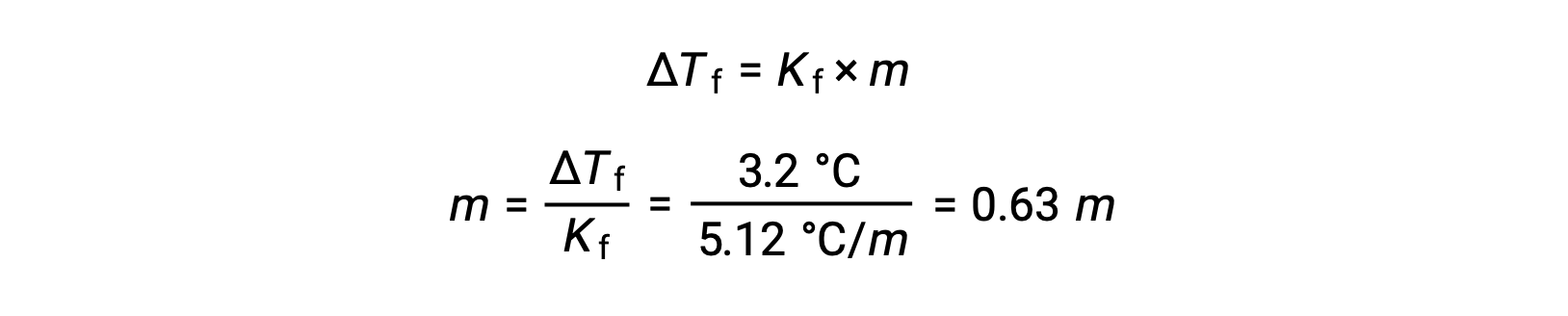
다음으로, 용액내 화합물의 두더지 의 수는 용액을 만들기 위해 사용된 용매의 몰 농도 및 질량에서 발견된다.
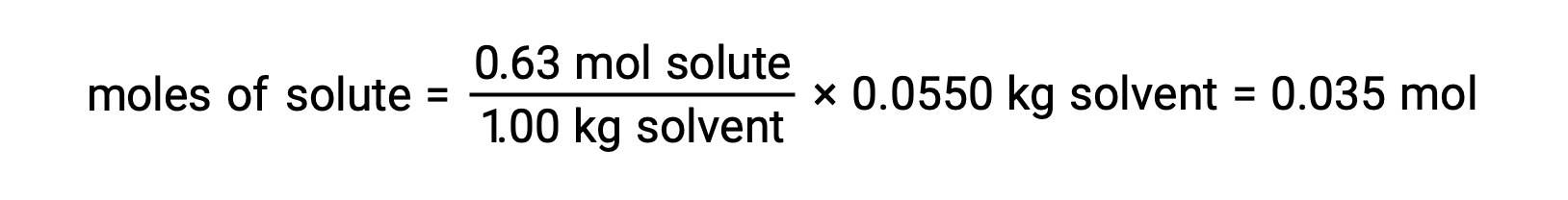
그리고, 마지막으로, 솔트의 질량과 그 질량에 두더지의 수에서 어금니 질량이 결정된다.
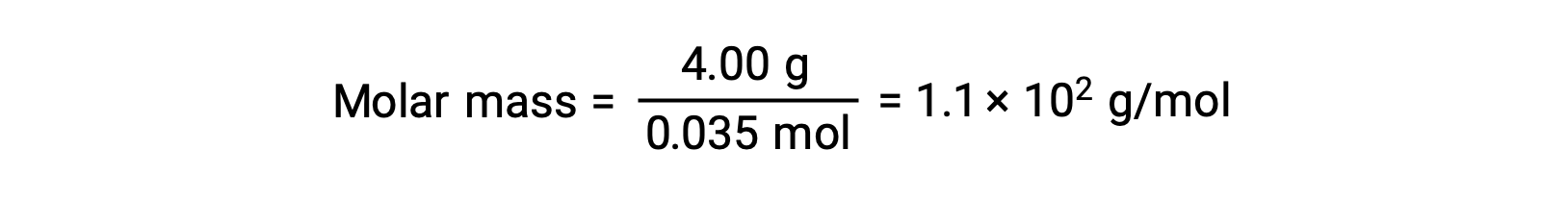
Suggested Reading
- Steffel, Margaret J. "Raoult's law: A general chemistry experiment." Journal of Chemical Education 60, no. 6 (1983): 500.
- Berka, Ladislav H., and Nicholas Kildahl. "Experiments for Modern Introductory Chemistry: Intermolecular Forces and Raoult's Law." Journal of chemical education 71, no. 7 (1994): 613.
