12.10:
Donma Noktası Alçalması ve Kaynama Noktası Yükselmesi
12.10:
Donma Noktası Alçalması ve Kaynama Noktası Yükselmesi
Kaynama Noktası Yükselmesi
Bir sıvının kaynama noktası, buhar basıncının ortam atmosfer basıncına eşit olduğu sıcaklıktır. Bir çözeltinin buhar basıncı, uçucu olmayan çözünen maddelerin varlığından dolayı düşürüldüğünden, çözeltinin kaynama noktasının daha sonra artacağı mantıklıdır. Buhar basıncı sıcaklıkla artar ve bu nedenle bir çözelti, çevreleyen atmosferinkine eşdeğer olan herhangi bir buhar basıncını elde etmek için saf çözücüden daha yüksek bir sıcaklık gerektirecektir. Uçucu olmayan bir çözünen bir çözücü içinde çözüldüğünde gözlemlenen kaynama noktasındaki artışa kaynama noktası yükselmesi denir ve çözünen türlerin (ΔTb) molal konsantrasyonu ile doğru orantılıdır:
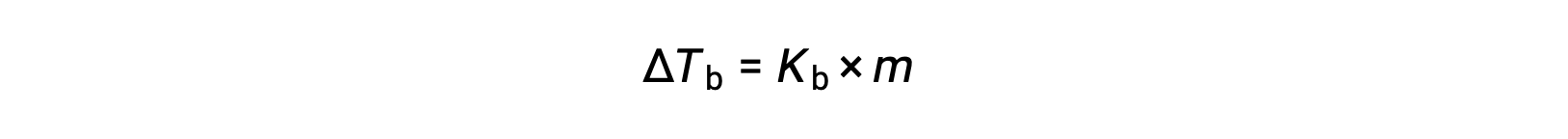
Burada Kb, kaynama noktası yükselme sabiti veya ebullioskopik sabittir ve m, tüm çözünen türlerin molal konsantrasyonu (molalite) ‘dir. Kaynama noktası yükselme sabitleri, çözücünün kimliğine bağlı karakteristik özelliklerdir.
Donma noktasının alçalması
Çözeltiler, saf sıvılara göre daha düşük sıcaklıklarda donar. Bu fenomenden, yollarda ve kaldırımlarda buzu eritmek için tuz, kalsiyum klorür veya üre kullanan “buz çözme” şemalarında ve otomobil radyatörlerinde “antifriz” olarak etilen glikol kullanımında yararlanılır. Deniz suyu tatlı sudan daha düşük bir sıcaklıkta donar ve bu nedenle Kuzey Kutbu ve Antarktika okyanusları 0 °C’nin altındaki sıcaklıklarda bile donmadan kalır (bu okyanuslarda yaşayan balıkların ve diğer soğukkanlı deniz hayvanlarının vücut sıvıları gibi).
Seyreltik bir çözeltinin donma noktasındaki düşüş, saf çözücününkine (ΔTf) kıyasla donma noktası düşüşü olarak adlandırılır ve çözünen maddenin molal konsantrasyonu ile doğru orantılıdır.
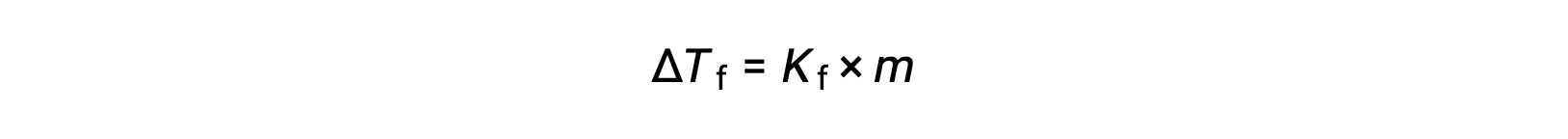
burada m, çözünen maddenin molal konsantrasyonu ve Kf‘ye donma noktası depresyon sabiti (veya kriyoskopik sabit) denir. Kaynama noktası yükselme sabitleri için olduğu gibi, bunlar, değerleri çözücünün kimyasal kimliğine bağlı olan karakteristik özelliklerdir.
Molar kütlenin belirlenmesi
Ozmotik basınç ve donma noktası, kaynama noktası ve buhar basıncındaki değişiklikler, belirli bir çözelti miktarında bulunan çözünen türlerin sayısı ile doğru orantılıdır. Sonuç olarak, çözünen maddenin bilinen bir kütlesi kullanılarak hazırlanan bir çözelti için bu özelliklerden birinin ölçülmesi, çözünen maddenin molar kütlesinin belirlenmesine izin verir.
Örneğin, 55,0 g benzen içinde çözülmüş 4,00 g elektrolit olmayan bir çözeltinin 2,32 °C’de donduğu bulunmuştur. İdeal çözelti davranışını varsayarsak, bu bileşiğin molar kütlesi nedir?
Bu sorunu çözmek için önce, gözlenen donma noktasından donma noktasındaki değişim ve saf benzenin donma noktası hesaplanır:
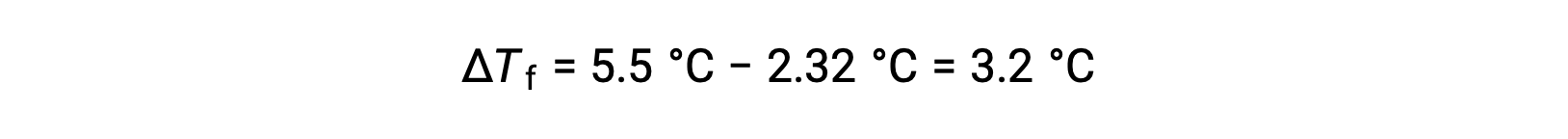
Daha sonra, molal konsantrasyonu, benzen için donma noktası düşüş sabiti olan Kf ‘den belirlenir, ve ΔTf:
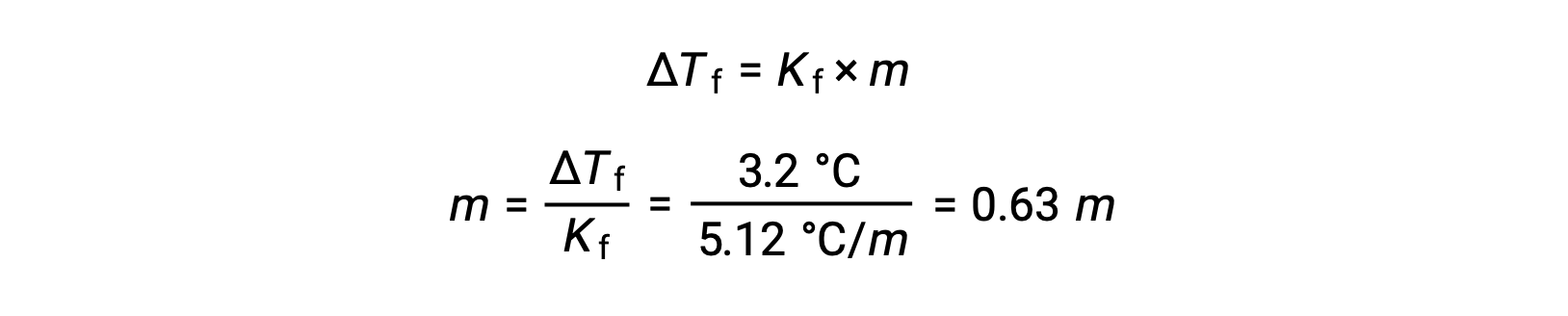
Daha sonra, çözeltideki bileşiğin mol sayısı, molal konsantrasyonundan ve çözeltiyi yapmak için kullanılan çözücü kütlesinden bulunur.
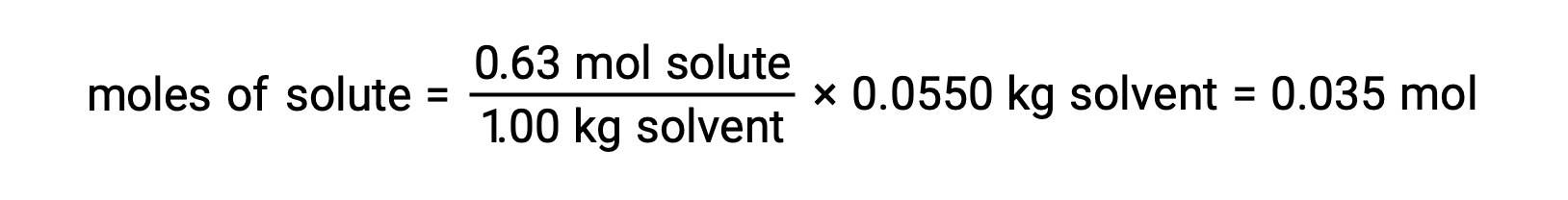
Ve son olarak, çözünen maddenin kütlesinden molar kütle ve bu kütledeki mol sayısı belirlenir.
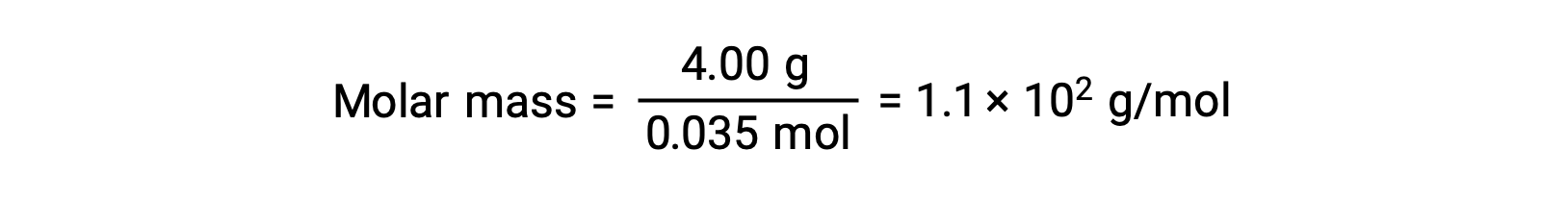
Bu metin bu kaynaktan uyarlanmıştır Openstax, Chemistry 2e, Section 11.4: Colligative Properties.
Suggested Reading
- Steffel, Margaret J. "Raoult's law: A general chemistry experiment." Journal of Chemical Education 60, no. 6 (1983): 500.
- Berka, Ladislav H., and Nicholas Kildahl. "Experiments for Modern Introductory Chemistry: Intermolecular Forces and Raoult's Law." Journal of chemical education 71, no. 7 (1994): 613.
