18.5:
Différence de potentiel et enthalpie libre
18.5:
Différence de potentiel et enthalpie libre
Thermodynamique d’une réaction Redox
La thermodynamique est la branche de la physique qui traite de la relation entre la chaleur et d’autres formes d’énergie. Dans une cellule électrochimique, l’énergie chimique est convertie en énergie électrique.
Ainsi, on peut prévoir un lien entre le potentiel de cellule, la variation d’énergie libre et la constante d’équilibre de la réaction. Le potentiel de cellule peut également être mesuré comme la force oxydante ou réductrice, et des mesures similaires de la force acido-basique se reflètent dans les constantes d’équilibre.
L’énergie libre de Gibbs et la relation entre E°cellule et ΔG°
L’énergie libre de Gibbs est une quantité utilisée pour calculer la quantité maximale de travail réversible effectué par un système thermodynamique maintenu à température et pression constantes. Elle est indiquée par le symbole G, et sa variation est représenté par ∆G. La variation d’énergie libre standard d’un système, ΔG°, est définie comme le travail maximum effectué par un système, wmax. Dans le cas d’une réaction d’oxydoréduction se produisant dans une cellule galvanique dans des conditions standard, tout le travail effectué est associé au transfert d’électrons de l’agent réducteur à l’agent oxydant,wélec. Ainsi,
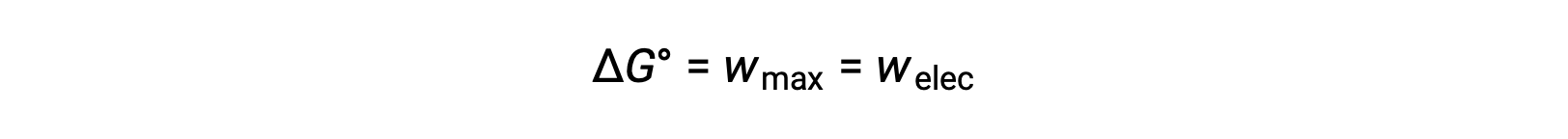
Cependant, tout travail associé au transfert d’électrons dépend de la charge transférée en Coulombs ainsi que du potentiel de cellule :
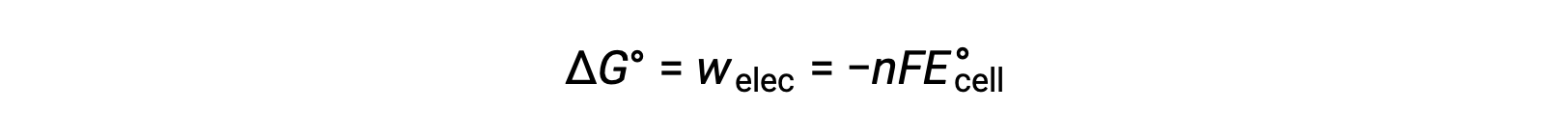
où n = le nombre de moles d’électrons transférés, F est la constante de Faraday, qui représente la charge coulombique de 1 mole d’électrons, et E°cellule est le potentiel standard de cellule. La relation entre ΔG° et ΔE°cellule confirme les conventions de signes et les critères de spontanéité de la réaction. Les réactions redox spontanées ont un potentiel positif et des valeurs négatives d’énergie libre.
Relation entre E°cellule et K
La variation d’énergie libre standard ΔG° est liée à la constante d’équilibre K d’une réaction redox comme suit :
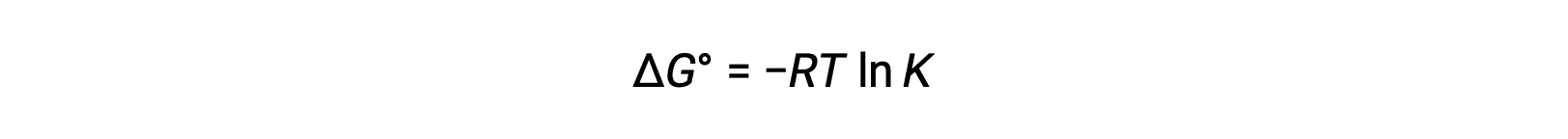
La combinaison d’une relation déduite précédemment entre ΔG° et K et de l’équation relative à ΔG° et E° celluledonne le résultat suivant :
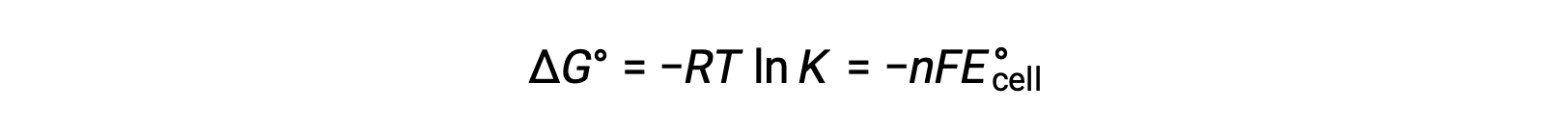
Par conséquent,
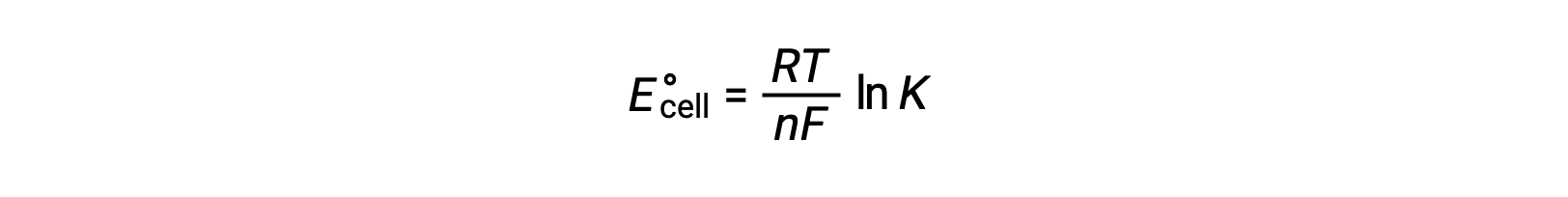
Cette équation indique que les réactions d’oxydoréduction ayant des potentiels cellulaires standard importants ou positifs se poursuivent afin d’être totale, atteignant l’équilibre lorsque la plupart des réactifs ont été transformés en produit.
Les réactions non spontanées ou les réactions qui se produisent en sens inverse présentent des potentiels de cellule négatifs, des valeurs d’énergie libre positives et une constante d’équilibre inférieure à un. Une constante d’équilibre de un et des valeurs du potentiel de cellule et d’énergie libre égales à zéro sont associées à une réaction en équilibre dans des conditions standard.
La relation entre le potentiel de cellule dans des conditions standard et les constantes thermodynamiques ΔG° et K peut être expliquée grâce à la figure ci-dessous :
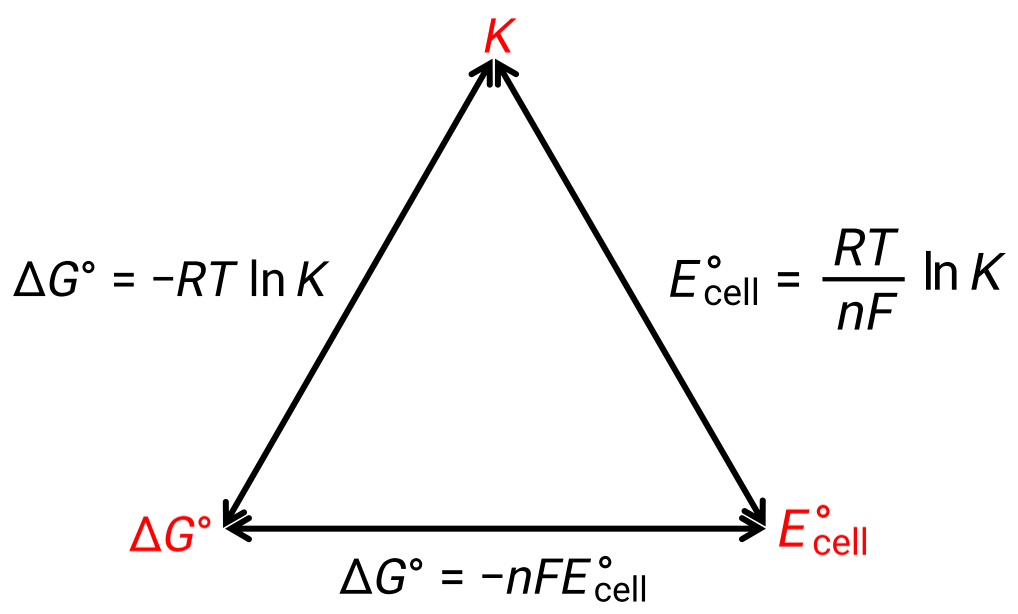
Figure 1 : graphique illustrant la relation entre trois propriétés thermodynamiques importantes.
Ce texte est adapté de Openstax,Chimie 2e, Section 17.4 : Potentiel, énergie libre et équilibre.
