18.5:
전지 전위와 자유에너지
18.5:
전지 전위와 자유에너지
레독스 반응의 열역학
열역학은 열과 다른 형태의 에너지 사이의 관계를 다루는 물리학의 분기입니다. 전기 화학 전지에서 화학 에너지는 전기 에너지로 변환됩니다.
따라서, 반응은 세포 전위, 자유로운 에너지 변화, 및 평형 상수 사이에서 링크를 예측할 수 있다. 세포 전위는 또한 산화제 또는 감소 강도로 측정될 수 있으며, 유사한 산염-염기 강도 측정은 평형 상수에 반영된다.
깁스의 자유 에너지와 E°셀과 ΔG°의관계
깁스 프리 에너지는 일정한 온도 및 압력 조건에서 유지되는 열역학 시스템에 의해 수행되는 가역 작업의 최대 양을 계산하는 데 사용되는 양입니다. 기호 G에의해 표시되며 그 변경 사항은g∆로표시됩니다. 시스템의 표준 자유 에너지 변화인 ΔG°는시스템에 의해 수행되는 최대 작업, wmax로정의된다. 표준 조건하에서 갈바닉 세포 내에서 발생하는 레독스 반응의 경우, 모든 작업은 감소제에서 산화제로 전자 전달과 연관되어, welec. 따라서
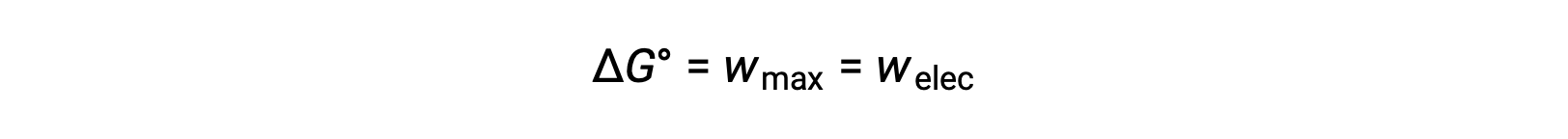
그러나 전자 전달과 관련된 모든 작업은 Coulombs에서 전송되는 전하뿐만 아니라 세포 전위에도 따라 달라집니다.
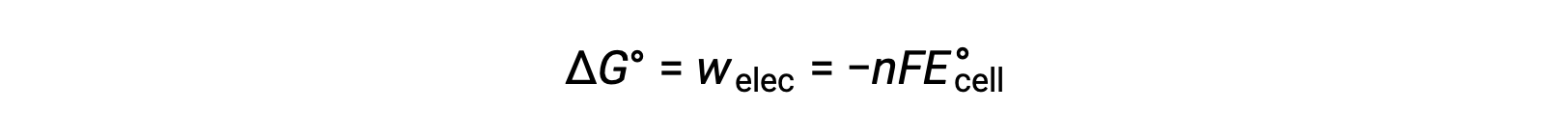
여기서 n = 전송된 전자의 두더지 의 수, F는 패라데이의 상수이며, 이는 전자의 1 두더지의 혼수전전을 나타내고,E°셀은 표준 세포 전위이다. ΔG°와 ΔE°셀 간의 관계는 반응 자발성에 대한 기호 규칙 및 기준을 확인합니다. 자발적인 레독스 반응은 자유 에너지의 긍정적 인 잠재력과 부정적인 값을 가지고 있습니다.
E°셀과 K 사이의 관계
표준 자유 에너지 변화 ΔG°는 다음과 같이 레독스 반응의 평형 상수 K와 관련이 있습니다.
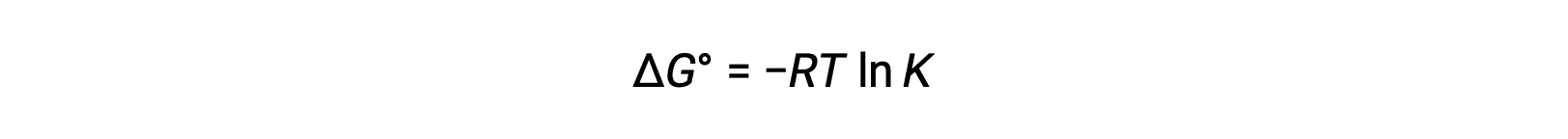
Δ G°와 K 사이의 이전에 파생된 관계와 ΔG°및 E°셀과 관련된 방정식을 결합하면 다음을 산출합니다.
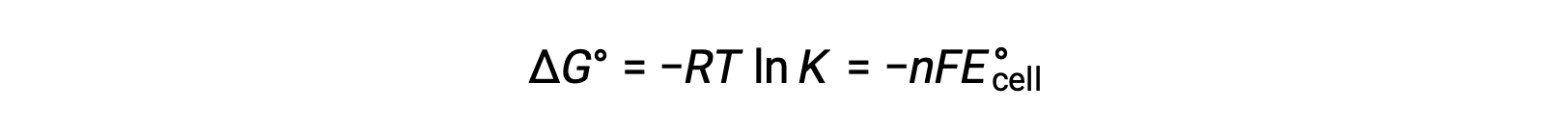
따라서
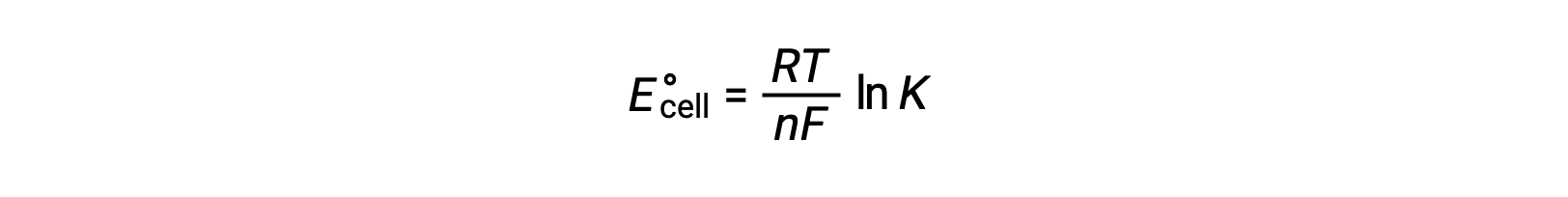
이 방정식은 크거나 양성 표준 세포 잠재력을 가진 redox 반응이 완료쪽으로 진행되어 대부분의 반응제가 제품으로 변환될 때 평형에 도달한다는 것을 나타냅니다.
역방향으로 진행되는 비자발적 반응 또는 반응은 부정적인 세포 전위, 긍정적 인 자유 에너지 값 및 하나 미만의 평형 상수를 나타낸다. 1개의 평형 상수 및 세포 전위 및 제로와 동일한 자유 에너지 값은 표준 조건에서 평형하에서의 반응과 연관된다.
표준 조건하에서 세포 전위와 열역학 상수 ΔG°및 K 사이의 관계는 아래에 주어진 그림에 의해 설명될 수 있습니다.
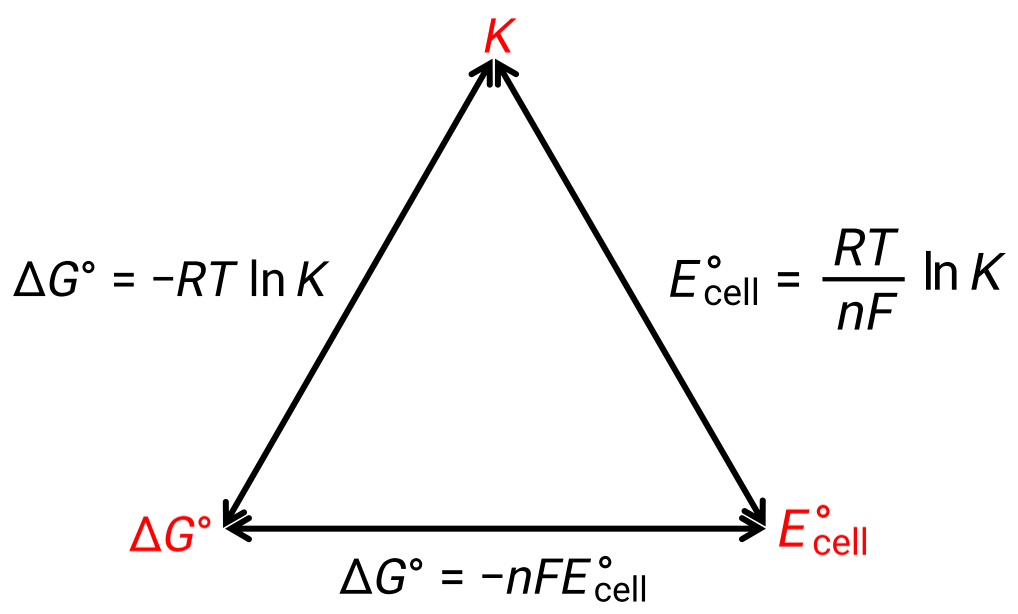
그림 1: 세 가지 중요한 열역학 적 특성 사이의 관계를 묘사하는 그래픽.
