18.5: 电池电势和自由能
氧化还原反应的热力学
热力学是物理的分支,它处理热量和其他形式的能量之间的关系。 在一个电化学单元中,化学能量被转换为电气能量。
因此,可以预测电池电势,自由能变化和反应的平衡常数之间的关系。 电池电势也可以测量为氧化物或还原强度,类似的 酸-碱 强度度量值会反映在平衡常量中。
Gibbs ’自由能以及 E°细胞 和 ΔG° 细胞之间的关系
吉布斯自由能是一种用于计算热动力系统在恒定温度和压力条件下执行的可逆工作的最大数量的数量。 它以符号 G 表示,其变化以 ∆G 表示 系统的标准自由能更改 (ΔG°) 定义为系统执行的最大工作 (wmax)。 对于在标准条件下在原电池(伽凡尼电池)内发生的氧化还原反应,所做的所有工作都与从还原剂到氧化剂 (电子) 的电子转移有关。 因此,
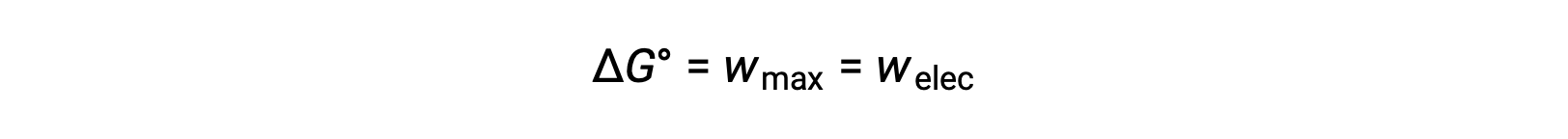
但是,与电子传输相关的任何工作都取决于库伦和电池电势中传输的电荷:
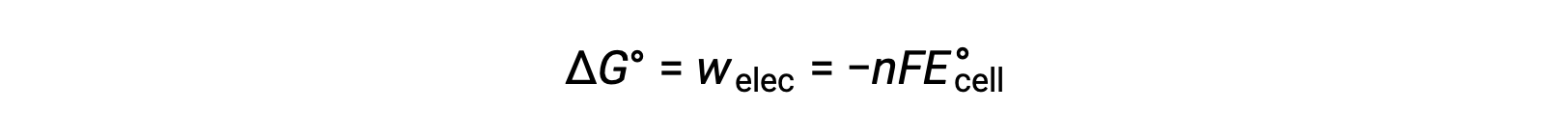
其中 n = 传输电子的摩尔数, F 是法拉迪的常数,表示 1 摩尔电子的库仑电荷, E°细胞是标准电池电势。 ΔG° 和 ΔE°之间的关系确认了反应自发性的标志约定和标准。 自发氧化还原反应具有自由能的正电位和负值。
E°单元格和 K 之间的关系
标准自由能变化 ΔG° 与氧化还原反应的平衡常数 K 相关,如下所示:
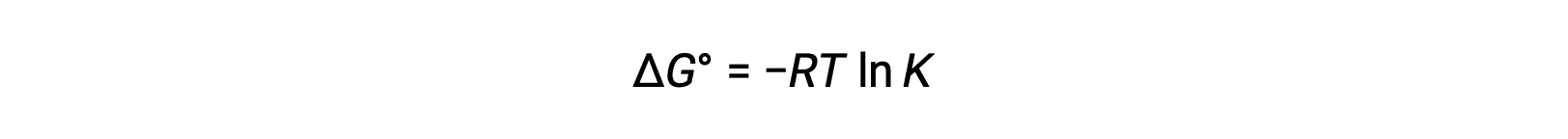
将 ΔG° 和 K 以及与 ΔG° 和 E°单元格相关的方程之间先前导出的关系组合在一起,可以得出以下结果:
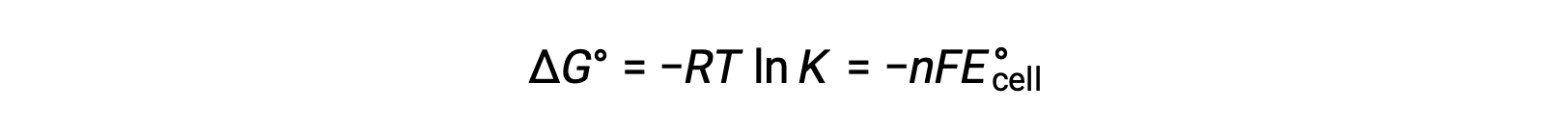
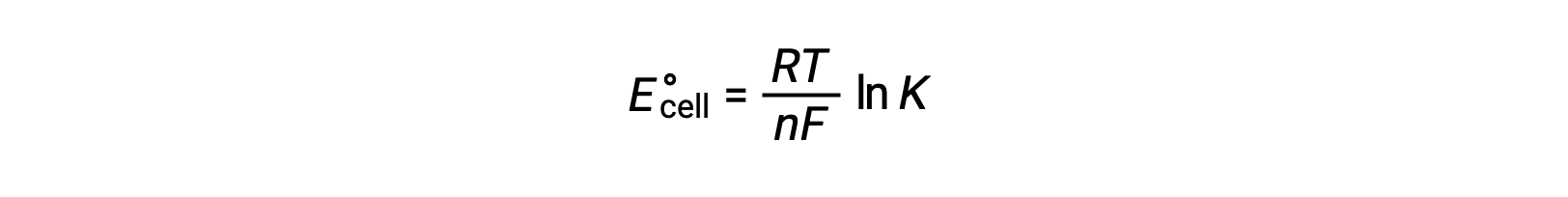
该方程指示,使用大或正标准电池电势的氧化还原反应将接近完成,当大多数反应物转换为生成物时,将达到平衡。
反向进行的非自发反应或反应表现为负电池电势,正自由能值和小于 One 的平衡常数。 一个平衡常数以及等于零的电池电势和自由能值与标准条件下的平衡反应相关联。
标准条件下的电池电势与热力学常量 ΔG° 和 K 之间的关系可以通过下图来解释:
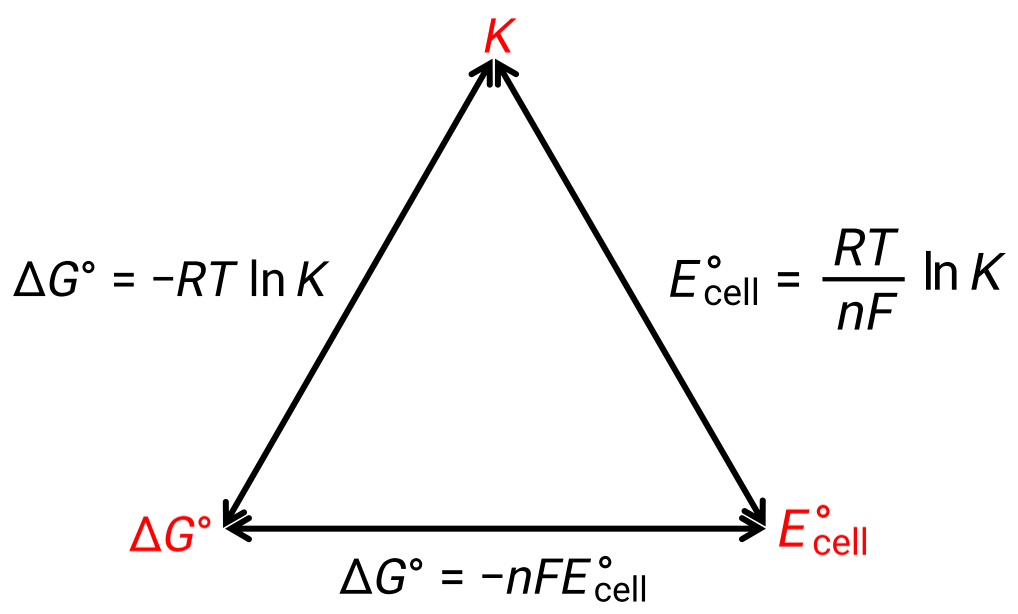
图 1 :描绘三个重要热力学性质之间关系的图形。
本文改编自 Openstax, 化学 2e, 第17.4节: 势能、自由能,与平衡。


