18.5:
Potencial Celular e Energia Livre
18.5:
Potencial Celular e Energia Livre
Termodinâmica de uma Reação Redox
Termodinâmica é o ramo da física que lida com a relação entre calor e outras formas de energia. Em uma célula eletroquímica, a energia química é convertida em energia elétrica.
Assim, pode ser prevista uma ligação entre o potencial celular, a alteração da energia livre, e a constante de equilíbrio para a reação. O potencial celular pode também ser medido como a força de oxidação ou redução, e medições semelhantes da força ácido-base são refletidas em constantes de equilíbrio.
A Energia Livre de Gibbs e a Relação Entre E°cell e ΔG°
A energia livre de Gibbs é uma quantidade utilizada para calcular a quantidade máxima de trabalho reversível realizado por um sistema termodinâmico mantido em condições de temperatura e pressão constantes. É denotada pelo símbolo G, e sua alteração é representada como ∆G.A alteração de energia livre padrão de um sistema, ΔG°, é definida como o trabalho máximo realizado por um sistema, wmax. Para uma reação redox que ocorra dentro de uma célula galvânica em condições normais, todo o trabalho realizado está associado à transferência de eletrões do agente redutor para o agente oxidante, welec. Assim,
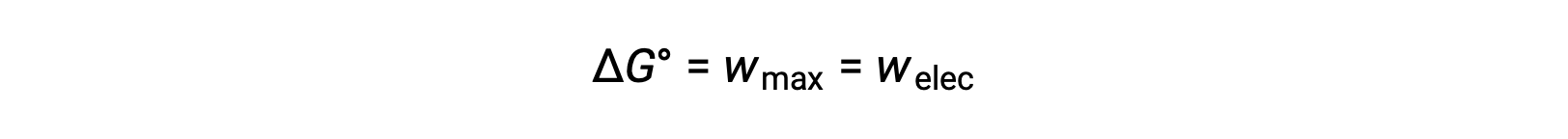
No entanto, qualquer trabalho associado à transferência de eletrões depende da carga transferida em Coulombs, bem como do potencial celular:
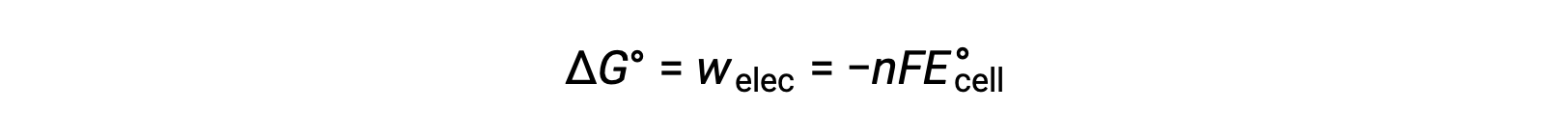
onde n = o número de moles de eletrões transferidos, F é a constante de Faraday, que representa a carga coulombica de 1 mole de eletrões, e E°cell é o potencial celular padrão. A relação entre ΔG° e ΔE°cell confirma as convenções de sinais e os critérios de espontaneidade da reação. Reações redox espontâneas têm potencial positivo e valores negativos de energia livre.
Relação entre E°cell e K
A Δalteração de energia livre padrão ΔG° está relacionada com a constante de equilíbrio K de uma reação redox como se segue:
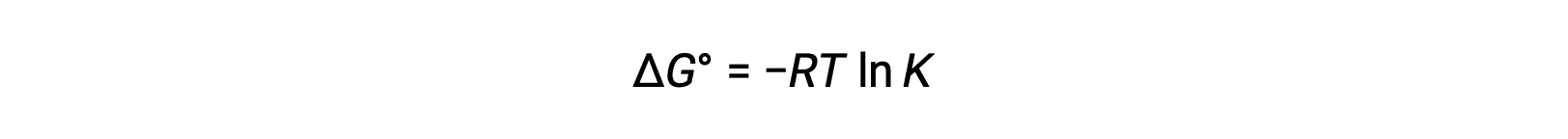
A combinação de uma relação previamente derivada entre ΔG° e K e a equação relativa a ΔG° e E°cell produz o seguinte:
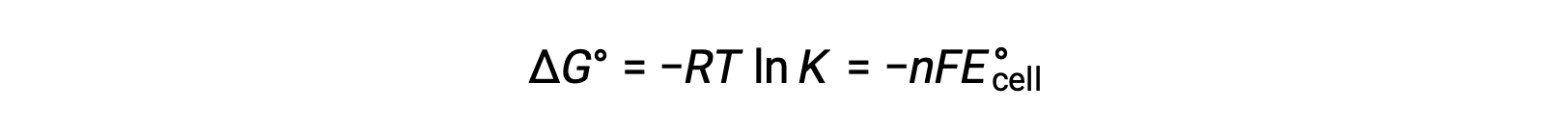
Por conseguinte,
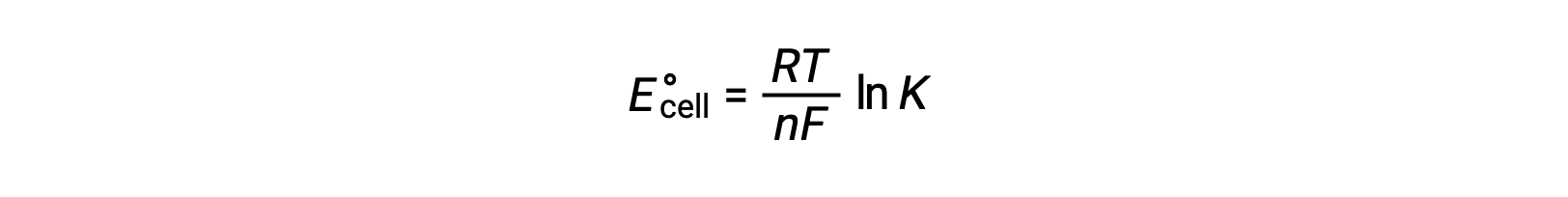
Esta equação indica que reações redox com potenciais celulares padrão grandes ou positivos irão prosseguir até ao fim, alcançando o equilíbrio quando a maioria dos reagentes tiver sido convertida em produto.
Reações não espontâneas ou reações que seguem em direções inversas apresentam potenciais celulares negativos, valores positivos de energia livre, e uma constante de equilíbrio inferior a um. Uma constante de equilíbrio de um e valores de potencial celular e energia livre iguais a zero estão associados a uma reação em equilíbrio em condições padrão.
A relação entre o potencial celular em condições padrão e as constantes termodinâmicas ΔG° e K pode ser explicada pela figura abaixo:
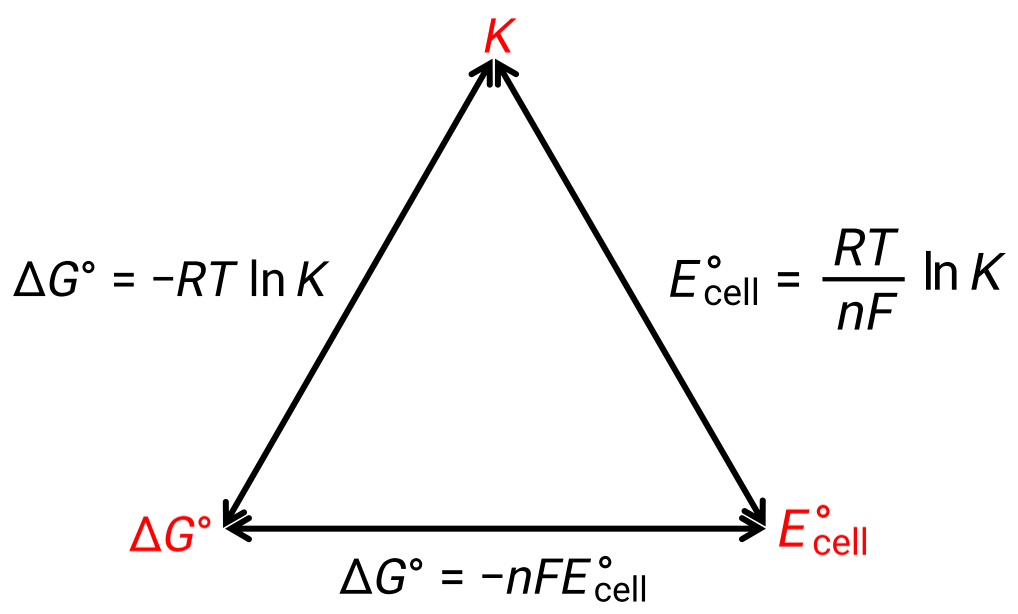
Figura 1: Gráfico que mostra a relação entre três propriedades termodinâmicas importantes.
Este texto é adaptado de Openstax,Chemistry 2e, Section 17.4: Potential, Free Energy, and Equilibrium.
