18.5:
Hücre Potansiyeli ve Serbest Enerji
18.5:
Hücre Potansiyeli ve Serbest Enerji
Bir Redoks Reaksiyonunun Termodinamiği
Termodinamik, ısı ve diğer enerji biçimleri arasındaki ilişkiyi ele alan fiziğin dalıdır. Bir elektrokimyasal hücrede, kimyasal enerji elektrik enerjisine dönüştürülür.
Böylece, hücre potansiyeli, serbest enerji değişimi ve reaksiyon için denge sabiti arasında bir bağlantı tahmin edilebilir. Hücre potansiyeli ayrıca oksidan veya indirgeyici kuvvet olarak da ölçülebilir ve benzer asit-baz kuvvet ölçümleri denge sabitlerine yansıtılır.
Gibbs Serbest Enerjisi ve E°hücre ile ΔG° Arasındaki İlişki
Gibbs serbest enerjisi, sabit sıcaklık ve basınç koşullarında tutulan bir termodinamik sistem tarafından gerçekleştirilen maksimum geri dönüşümlü iş miktarını hesaplamak için kullanılan bir miktardır. G sembolü ile gösterilir ve değişimi ∆G olarak temsil edilir. Bir sistemin standart serbest enerji değişimi, ΔG°, bir sistem tarafından gerçekleştirilen maksimum iş olarak tanımlanır, wmax. Standart koşullar altında bir galvanik hücre içinde meydana gelen bir redoks reaksiyonu için, yapılan tüm çalışmalar, indirgeyici maddeden oksitleyici maddeye, welec‘e elektron transferi ile ilişkilidir. Böylelikle,
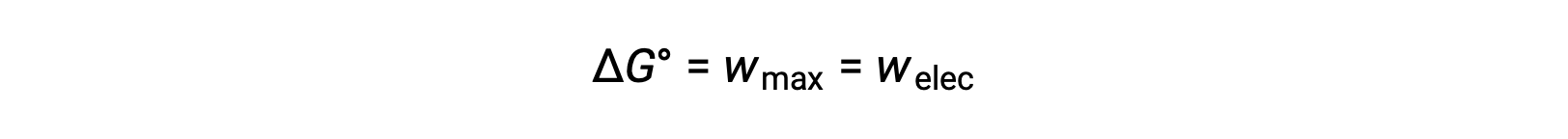
Bununla birlikte, elektron transferi ile ilgili herhangi bir çalışma, Coulomb olarak aktarılan yüke ve hücre potansiyeline bağlıdır:
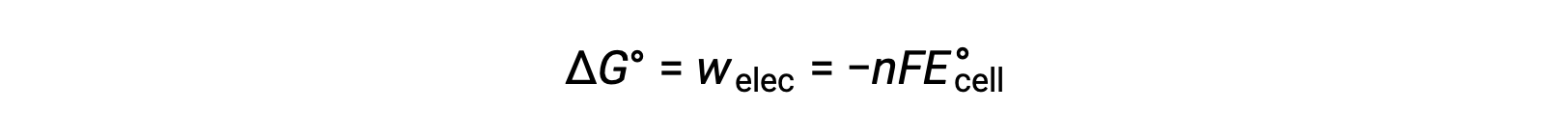
burada n = transfer edilen elektronların mol sayısı, F, 1 mol elektronların coulombic yükünü temsil eden Faraday sabitidir ve E°hücre standart hücre potansiyelidir. ΔG° ve ΔE°hücre arasındaki ilişki, işaret düzeninin ve reaksiyon spontanlığının kriterlerini doğrular. Spontan redoks reaksiyonları, pozitif potansiyele ve negatif serbest enerji değerlerine sahiptir.
E°hücre hücre ve K arasındaki ilişki
Standart serbest enerji değişimi ΔG°, aşağıdaki gibi bir redoks reaksiyonunun denge sabiti K ile ilgilidir:
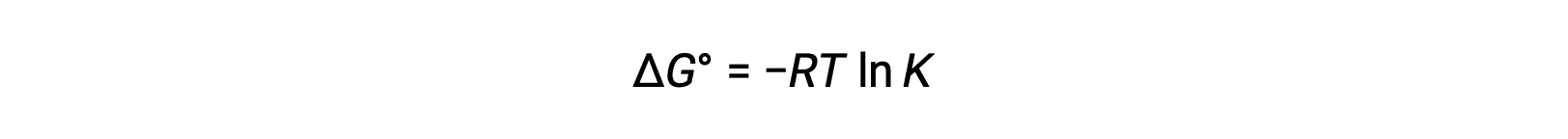
ΔG° ve K arasındaki daha önce türetilmiş ilişkiyi ve ΔG° veE°hücre ile ilgili denklemi birleştirmek aşağıdakileri verir:
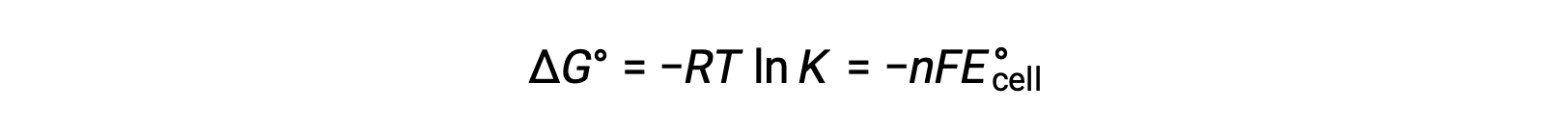
Bu nedenle,
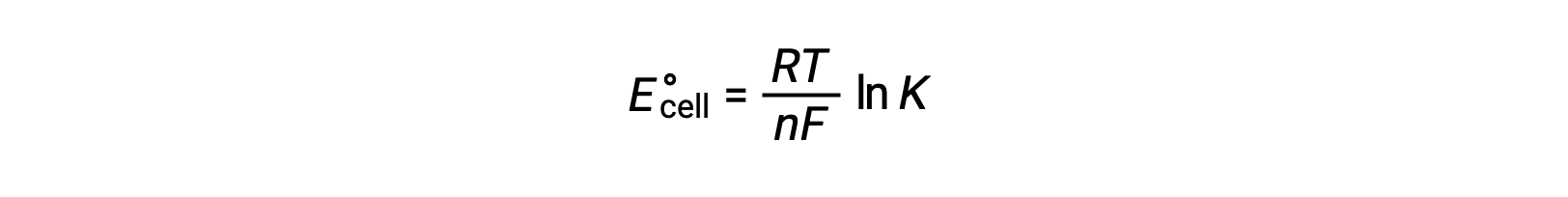
Bu denklem, büyük veya pozitif standart hücre potansiyellerine sahip redoks reaksiyonlarının, çoğu reaktan ürüne dönüştürüldüğünde dengeye ulaşarak tamamlanmaya doğru ilerleyeceğini gösterir.
Ters yönde ilerleyen reaksiyonlar veya spontan olmayan reaksiyonlar, negatif hücre potansiyelleri, pozitif serbest enerji değerleri ve birden küçük denge sabiti sergiler. Denge sabiti bir ve hücre potansiyeli ve sıfıra eşit serbest enerji değerleri, standart koşullarda denge altında bir reaksiyon ile ilişkilidir.
Standart koşullar altında hücre potansiyeli ile ΔG° ve K termodinamik sabitleri arasındaki ilişki aşağıda verilen şekil ile açıklanabilir:
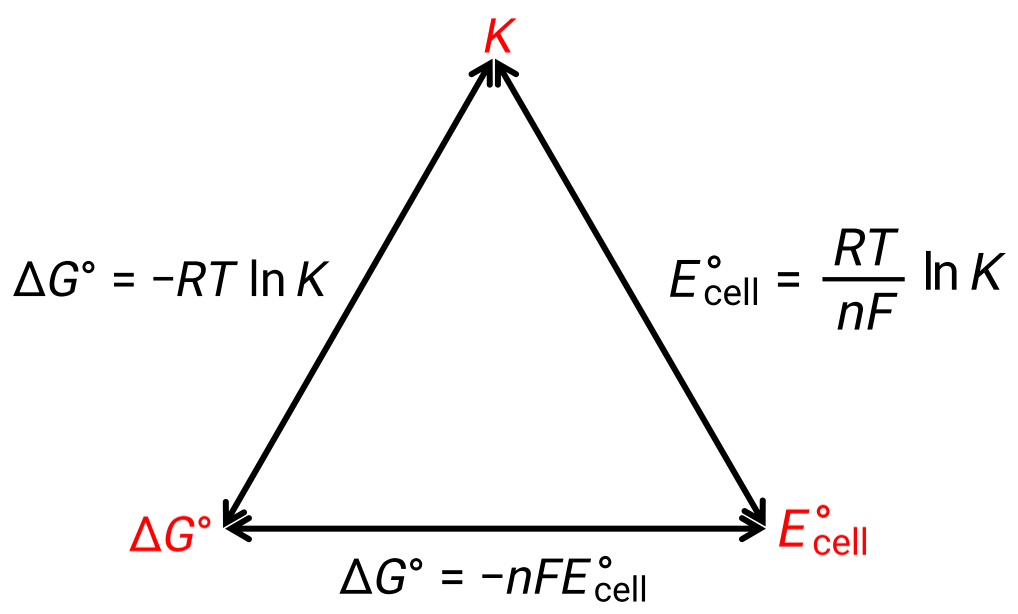
Şekil 1: Üç önemli termodinamik özellik arasındaki ilişkiyi gösteren grafik.
Bu metin bu kaynaktan uyarlanmıştır: Openstax,Chemistry 2e, Section 17.4: Potential, Free Energy, and Equilibrium.
