18.5: Потенциал клеток и свободная энергия
Термодинамика окислительно-восстановительных реакций
Термодинамика — это отрасль физики, занимающейся взаимосвязью между теплом и другими формами энергии. В электрохимической ячейке химическая энергия преобразуется в электрическую.
Таким образом, можно спрогнозировать связь между потенциалом клетки, изменение свободной энергии и постоянной равновесия для реакции. Потенциал клеток также можно измерить как оксидант или уменьшающий уровень, и аналогичные показатели кислотно-основная Strength отражаются в константах равновесия.
Свободная энергия Гиббса и отношение между E°cell и ΔG°
Свободная энергия Гиббса — это количество, используемое для расчета максимального объема работы обратимая, выполняемой термодинамической системой, которая поддерживается при постоянных температурах и давлении. Он обозначается символом G, а его изменение представлено как ∆G. Стандартный изменение свободной энергии системы, ΔG°, определяется как максимальная работа, выполняемая системой, wmax. При окислительной реакции, протекающей в гальванической ячейке в стандартных условиях, вся проделанная работа связана с передачей электрона от восстанавливающего средства к окислителям, Welec. Таким образом,
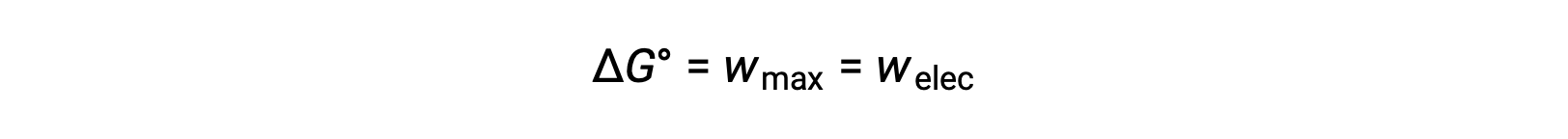
Однако любая работа, связанная с переносом электронов, зависит от заряда, передаваемого в кулонах, а также от клеточного потенциала:
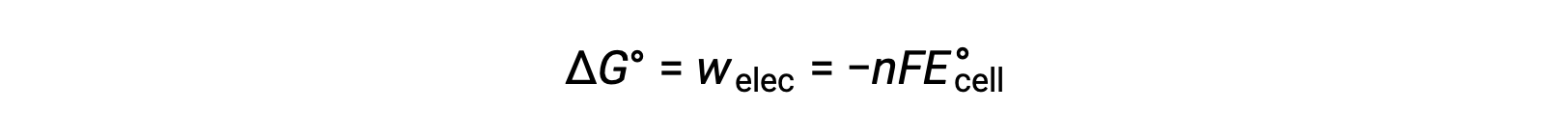
Где n = количество молей переданных электронов, F является константой Фарадея, которая представляет предлобковый заряд 1 моль электронов, а E°cell - стандартный клеточный потенциал. Связь между ΔG° и ΔE°CELL подтверждает условные обозначения и критерии спонтанности реакции. Спонтанные окислительно-восстановительные реакции обладают положительным потенциалом и отрицательными значениями свободной энергии.
Отношение между E°cell и K
Стандарт изменение свободной энергии ΔG° связан с равновесной константой K окислительно-восстановительного действия следующим образом:
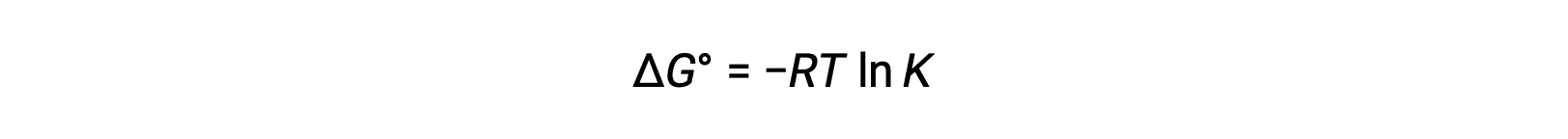
Сочетание ранее полученного соотношения между ΔG° и K и уравнения, относящегося к ΔG° и E°, дает следующее:
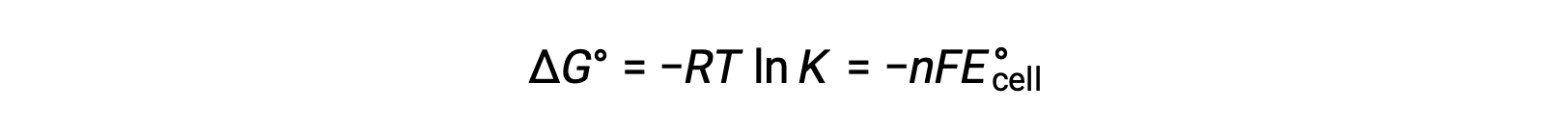
Поэтому
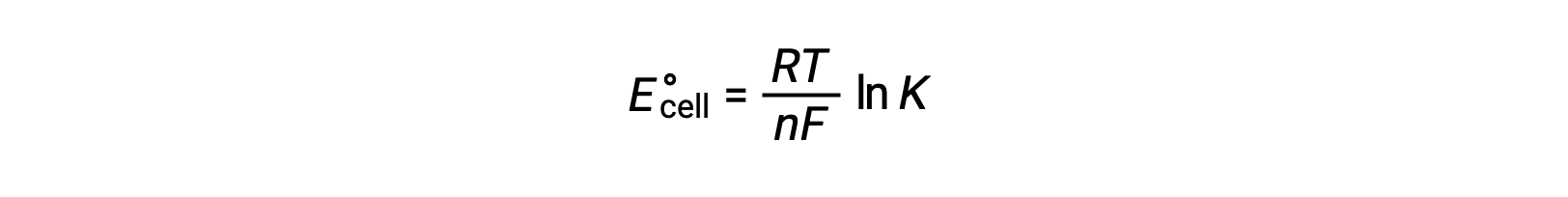
Это уравнение указывает на то, что окислительно-восстановительные реакции с большими или положительными стандартными клетительными потенциалами будут двигаться к завершению, достигая равновесия, когда большинство реагенты были преобразованы в продукт.
Неспонтанные реакции или реакции, протекающие в обратном направлении, имеют отрицательные клеточные потенциалы, положительные значения свободной энергии и равновесную константу менее одной. Равновесная константа одного и клеточного потенциала и свободные значения энергии, равные нулю, связаны с реакцией в равновесии при стандартных условиях.
Связь между потенциалом ячейки в стандартных условиях и термодинамическими константами ΔG° и K может быть объяснена на рисунке ниже:
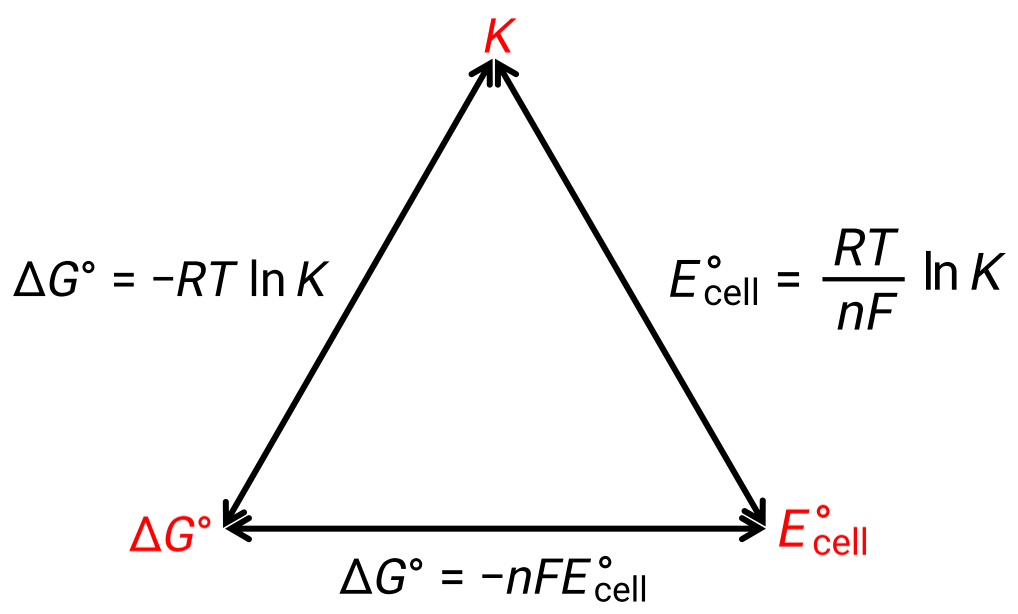
Рисунок 1: График, изображающий взаимосвязь между тремя важными термодинамическими свойствами.
Этот текст адаптирован из Openstax,Химия 2е изд., раздел 17.4: Потенциал, свободная энергия и равновесие.


