18.5:
Potencial de Celda y Energía Libre
18.5:
Potencial de Celda y Energía Libre
Termodinámica de una reacción redox
La termodinámica es la rama de la física que se ocupa de la relación entre el calor y las otras formas de energía. En una celda electroquímica, la energía química se convierte en energía eléctrica.
Por lo tanto, se puede predecir un vínculo entre el potencial de celda, el cambio de energía libre y la constante de equilibrio para la reacción. El potencial de celda también se puede medir como la fuerza oxidante o reductora, y medidas similares de la fuerza ácido-base se reflejan en las constantes de equilibrio.
La Energía Libre de Gibbs y la relación entre la E°celda y ΔG°
La energía libre de Gibbs es un valor utilizado para calcular la cantidad máxima de trabajo reversible realizado por un sistema termodinámico mantenido a temperatura y presión constantes. Se indica mediante el símbolo G y su cambio se representa como ΔG. El cambio de energía libre estándar de un sistema, ΔG°, se define como el trabajo máximo realizado por el sistema, wmax. Para una reacción redox que se produce dentro de una celda galvánica en condiciones estándar, todo el trabajo realizado se asocia con la transferencia de electrones del agente reductor al agente oxidante,welec. Así,
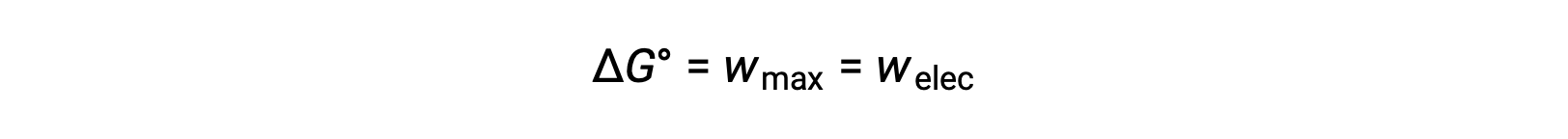
Sin embargo, cualquier trabajo asociado con la transferencia de electrones depende de la carga transferida en Coulombs, así como del potencial de celda:
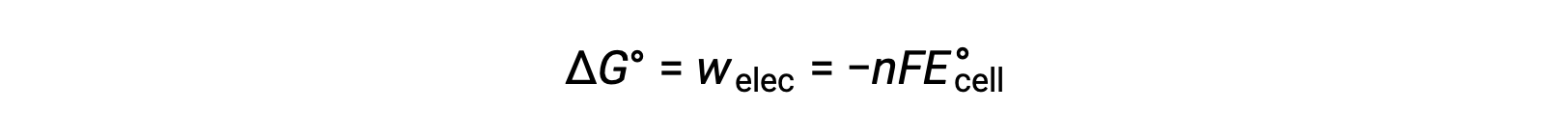
Donde n = el número de moles de electrones transferidos, F es la constante de Faraday, que representa la carga coulombica de 1 mol de electrones, y E°celda es el potencial celda estándar. La relación entre ΔEˌ y ΔGˌcelda confirma las convenciones de signos y los criterios para la espontaneidad de la reacción. Las reacciones redox espontáneas tienen potencial positivo y valores negativos de energía libre.
Relación entre Ecelda y K
El cambio de energía libre estándar ΔGˌ está relacionado con la constante de equilibrio K de una reacción redox de la siguiente manera:
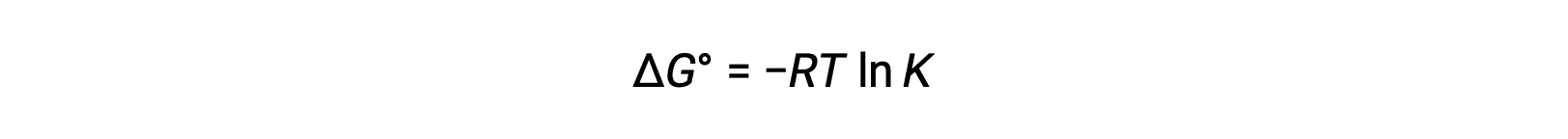
La combinación de una relación derivada previamente entre ΔG° y K y la ecuación relacionada con ΔG° y E°celda produce lo siguiente:
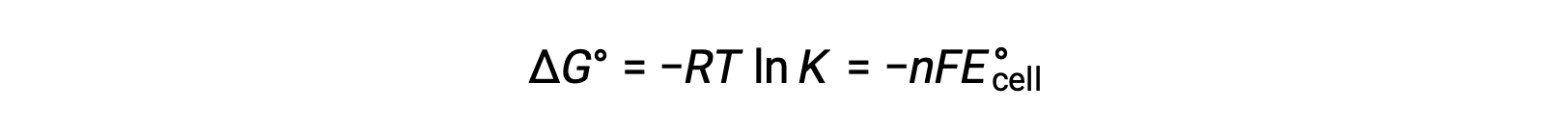
Por lo tanto,
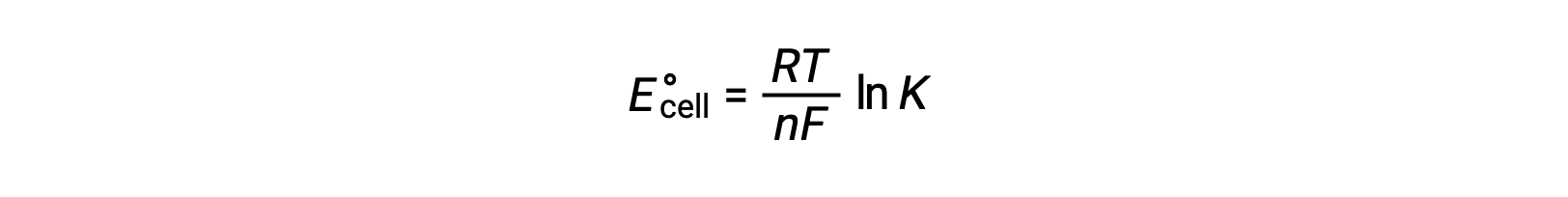
Esta ecuación indica que las reacciones redox con potenciales celda estándar grandes o positivos procederán hacia la finalización, alcanzando el equilibrio cuando la mayoría de los reactivos se hayan convertido en producto.
Las reacciones no espontáneas o las reacciones que se producen en dirección inversa muestran potenciales de celda negativos, valores positivos de energía libre y una constante de equilibrio inferior a uno. Una constante de equilibrio de uno y los valores de potencial de celda y energía libre iguales a cero se asocian con una reacción en equilibrio en condiciones estándar.
La relación entre el potencial de celda bajo condiciones estándar y las constantes termodinámicas ΔG° y K puede explicarse mediante la siguiente figura:
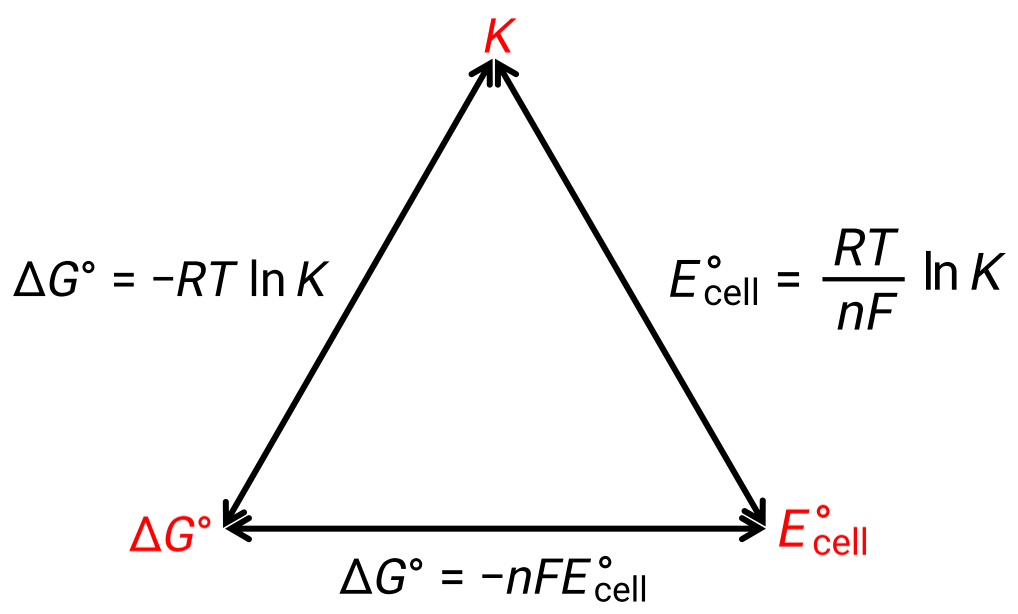
Figura 1: Gráfico que representa la relación entre tres importantes propiedades termodinámicas.
Este texto está adaptado de Openstax, Química 2e, Sección 17.4: Potencial, Energía Libre y Equilibrio.
