18.7:
浓差电池
A subscription to JoVE is required to view this content. Sign in or start your free trial.
JoVE Core
Chemistry
Concentration Cells
氧化还原反应的电池电位 很大程度上取决于 反应物和生成物的浓度。请考虑标准条件下的镍银原电池,电池电位为 1.03 伏。然而,浓度的变化可以 增加或降低电池电位。如果浓度梯度影响 两个不同半电池的电池电位,它可以用来构建一个 具有相同半反应的电化学电池吗?请考虑有两个相同银电极的 原电池,每个电极放在 含有不同浓度银离子的溶液中。这种装置称为浓差电池。根据勒夏特列原理,浓度梯度自发地驱动电子 从离子浓度较低的半电池 流向离子浓度较高的 半电池。因此,氧化反应发生在浓度较低的电池中,那里的银电极被氧化,形成银离子,而在浓度较高的电池中,银离子被还原为固态银。因此,浓差电池的电池电位 完全由所选氧化还原试剂的浓度差 决定,可以使用能斯特方程 进行计算。当两个半电池中的离子浓度相等时,浓差电池达到平衡,其电势变为零。此时,电池被宣布”死亡”pH 计的工作原理与浓差电池相同,用于测定溶液的酸度或碱度。pH 计的玻璃电极 充满了已知浓度的氢离子 溶液。当浸入不同氢离子浓度的溶液中时,玻璃两侧 会形成可测量的电位差,用于确定样品的 pH 值。如果外部氢离子浓度 高于电极内部,则测得的电位差高。这意味着溶液呈酸性,pH 值 低于 7。如果两侧氢离子浓度相等,会导致电位差为零。因此,测得的溶液是中性的。如果外部氢离子浓度较低,则会产生较低的电位差,这意味着溶液呈碱性,pH 值高于 7。
18.7:
浓差电池
浓差电池是 一种伏打电池类型,通过连接两个几乎相同的半电池 (均基于相同的半反应) 和使用相同电极 (仅在一种氧化还原物质的浓度中有所不同) 来构建。 因此,浓度细胞的潜能仅由特定氧化还原物种的浓度差异决定。
考虑以下伏打电池:
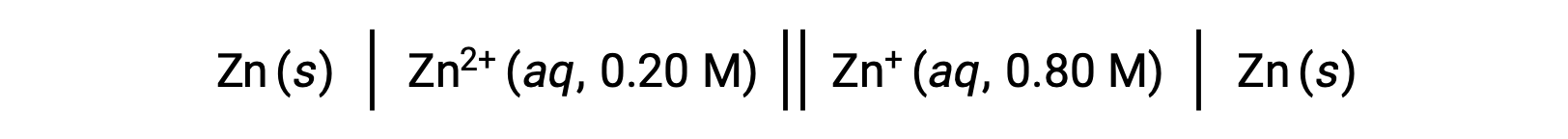
根据给定的信息,可以使用 能斯特方程(Nernst equation) 计算此浓差电池的电池电势:

以 能斯特方程(Nernst equation) 代替,
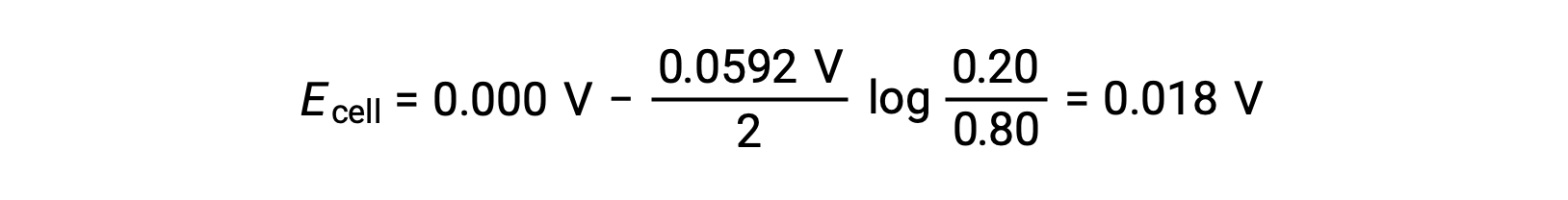
电池电势的正值表示整个细胞反应是自发的。 当阴极中的锌离子浓度下降 (通过降低元素锌) ,而阳极则上升 (通过将锌阳极氧化为锌离子) 时,就会发生这种自发反应。 阴极中存在用于减少锌的更大驱动力,其中 Zn2+ 离子浓度更大 (阴极 > 阳极)。
实验室中的 pH 计,神经细胞膜中的离子通道以及人体中的心脏肌肉细胞都是基于浓差电池原理工作的。
Tags
Concentration CellsCell PotentialRedox ReactionReactantsProductsNickel-silver Galvanic CellStandard ConditionsConcentration GradientElectrochemical CellHalf-reactionsSilver ElectrodesSilver IonsOxidationReductionLe Châtelier’s PrincipleElectron FlowDilute CellConcentrated CellNernst EquationEquilibriumPH Meters
