18.7:
농도차 전지
A subscription to JoVE is required to view this content. Sign in or start your free trial.
JoVE Core
Chemistry
Concentration Cells
산화 환원 반응의 전지 전위는 반응물의 농도와 생성물의 농도에 크게 좌우됩니다. 표준 조건에서 전지 전위가 1.03 볼트인 니켈-은 갈바닉 전지를 생각해 보십시오. 그러나 농도의 변화에 따라 전지 전위가 증가되거나 감소될 수 있습니다.만약 농도 구배가 두 개의 다른 반전지의 전지 전위에 영향을 준다면 그것을 동일한 반 반응을 가진 전기 화학 전지를 만드는 데 사용할 수 있을까요? 두 개의 동일한 은 전극을 가진 갈바닉 전지를 생각해 보십시오. 이 때 각 전극은 서로 다른 농도의 은 이온을 포함하는 용액에 잠겨 있습니다.이런 설정을 농도 전지라고 합니다. 르 샤틀리에의 원리에 따라 농도 구배는 이온 농도가 낮은 반전지에서 이온 농도가 높은 반전지로 전자의 흐름을 자발적으로 유도합니다. 따라서 산화는 은 전극이 산화되어 은이온을 형성하는 농도가 낮은 전지에서 발생하며 농도가 더 높은 전지에서는 은 이온이 고체 은으로 환원되는 환원이 일어납니다.따라서 농도 전지의 전지 전위는 선택된 산화환원 시약의 농도 차이에 의해서만 결정되며 네른스트 방정식을 사용하여 계산할 수 있습니다. 두 반전지의 이온 농도가 같아지면 농축 전지는 평형에 도달하고 그것의 전위는 0이 됩니다. 이 시점에서 전지는 수명이 다 한 것으로 선언됩니다.pH 미터는 농도 전지와 동일한 원리를 사용하여 작동하면서 용액의 산성 또는 염기성을 결정합니다. pH 미터의 유리 전극에 농도를 알고 있는 수소 이온 용액을 채웁니다. 농도가 다른 수소 이 용액에 담그면 측정 가능한 전위차가 유리의 양쪽에서 형성되며 이를 사용하여 샘플의 pH를 결정합니다.외부 수소 이온 농도가 전극 내부보다 높으면 측정된 전위차가 큽니다. 이것은 용액이 pH 값이 7보다 낮은 산성 용액임을 의미합니다. 양쪽의 수소 이온 농도가 동일하면 전위차는 0이 됩니다.따라서 측정된 용액은 중성입니다. 외부의 수소 이온 농도가 낮을수록 낮은 전위차가 발생하는데 이는 용액이 pH 값이 7을 넘는 염기성임을 의미합니다.
18.7:
농도차 전지
농도 세포는 동일한 반반응에 기초하여 동일한 전극을 사용하여 두 개의 거의 동일한 반세포를 연결하고 동일한 전극을 사용하여 생성된 볼타이크 세포의 유형으로, 하나의 레독스 종의 농도에서만 다릅니다. 농도 세포의 잠재력, 따라서, 특정 레독스 종의 농도 차이에 의해서만 결정된다.
다음 광능 셀을 고려하십시오.
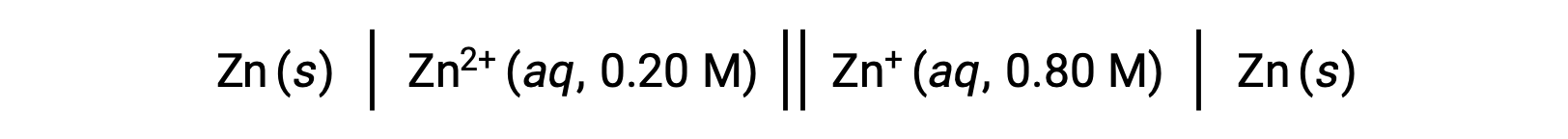
주어진 정보에서, 이 농도 세포의 세포 전위는 Nernst 방정식을 사용하여 계산될 수 있습니다:

Nernst 방정식으로 대체,
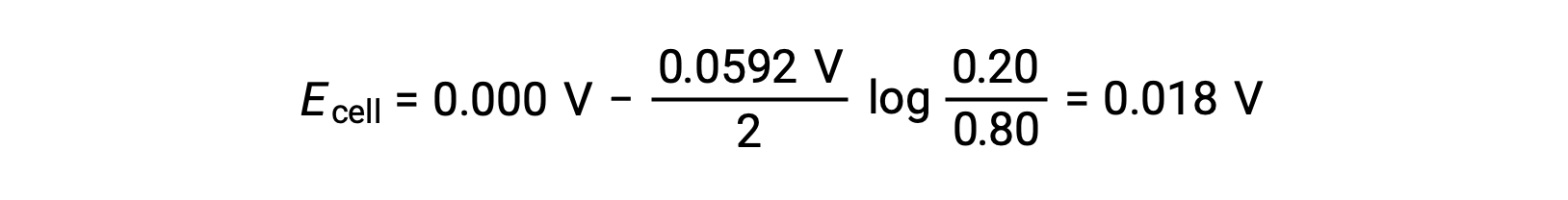
세포 전위력의 양수 값은 전반적인 세포 반응이 자발적임을 나타냅니다. 이러한 자발적반응은 양극에서 아연 이온 농도가 떨어질 때 발생하며(정소 아연으로 의 감소)는 양극에서 상승(아연 양극의 산화에 의해 아연 이온)이 발생합니다. 아연의 감소를 위한 더 큰 원동력은 음극에 존재하며, Zn2+ 이온 농도가 더 큽니다(E음극 > E양극).
실험실에서 pH 미터, 신경 세포막내의 이온 채널, 인체의 심장 근육 세포는 농도 세포의 원리에 작용한다.
Tags
Concentration CellsCell PotentialRedox ReactionReactantsProductsNickel-silver Galvanic CellStandard ConditionsConcentration GradientElectrochemical CellHalf-reactionsSilver ElectrodesSilver IonsOxidationReductionLe Châtelier’s PrincipleElectron FlowDilute CellConcentrated CellNernst EquationEquilibriumPH Meters
