18.7:
Celdas de Concentración
18.7:
Celdas de Concentración
Una celda de concentración es un tipo de celda voltaica que se construye conectando dos semi-celdas casi idénticas, ambas basadas en la misma semirreacción y utilizando el mismo electrodo, difiriendo sólo en la concentración de una especie redox. El potencial de una celda de concentración, por lo tanto, está determinado sólo por la diferencia de concentración de las especies redox particulares.
Considere la siguiente celda voltaica:
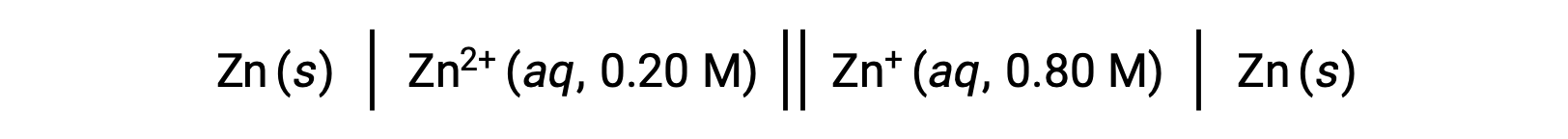
A partir de la información proporcionada, el potencial de esta celda de concentración se puede calcular mediante la ecuación de Nernst:

Sustituyendo en la ecuación de Nernst,
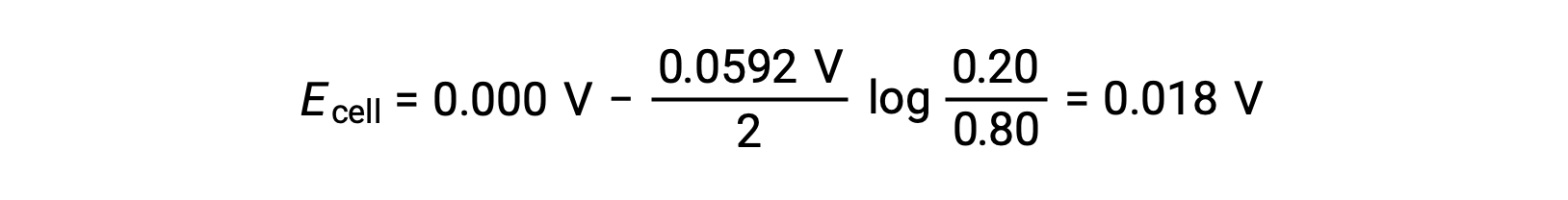
El valor positivo del potencial de celda indica que la reacción total de la celda es espontánea. Esta reacción espontánea ocurre cuando la concentración de iones zinc en el cátodo disminuye (por reducción a zinc elemental) mientras que la del ánodo aumenta (por oxidación del ánodo de zinc a iones zinc). En el cátodo existe una mayor fuerza impulsora para la reducción del zinc, donde la concentración de iones Zn2+ es mayor (Ecátodo > Eánodo).
Los medidores de pH en el laboratorio, los canales iónicos en las membranas de las células nerviosas y las células musculares cardíacas en el cuerpo humano trabajan sobre el principio de las celdas de concentración.
Este texto es adaptado de Openstax, Química 2e, Capítulo 17,4: Potencial, Energía Libre y Equilibrio.
