18.7:
Концентрационные ячейки
18.7:
Концентрационные ячейки
Концентрационная ячейка — это тип гальванического элемента, построенного путём соединения двух почти одинаковых полуэлементов, как на основе одной и той же полуреакции, так и с использованием одного и того же электрода, отличающийся лишь концентрацией одного из участников редокса. Таким образом, потенциал концентрационной ячейки определяется только разницей концентраций конкретного вида редокс.
Рассмотрим следующую объемную ячейку:
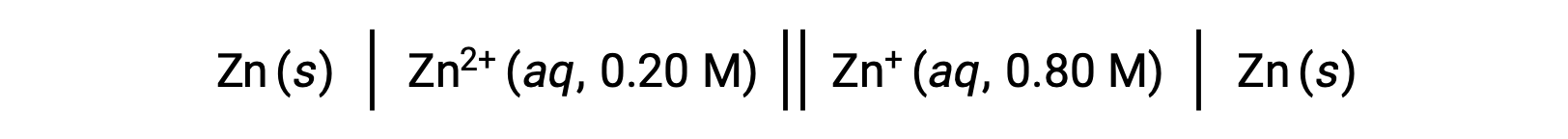
На основании данной информации потенциал ячейки этой ячейки концентрации можно рассчитать с помощью уравнения Нернста:

Подстановка в уравнение Нернста,
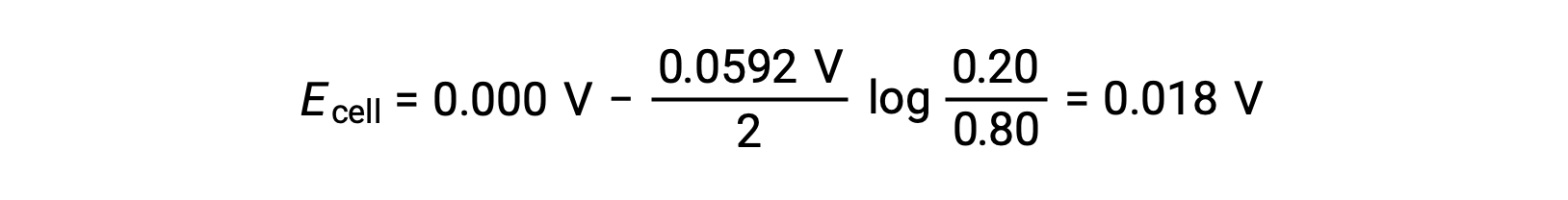
Положительное значение клеточного потенциала указывает на то, что общая клеточная реакция является спонтанной. Эта спонтанная реакция возникает, когда концентрация иона цинка в катоде падает (за счет уменьшения элементарного цинка), а в аноде повышается (за счет окисления анода цинка на ионы цинка). В катоде присутствует большая движущая сила для уменьшения цинка, где концентрация ионов Zn2+ выше (катод > анод).
Счетчики pH в лаборатории, ионные каналы в мембранах нервных клеток и сердечные мышечные клетки в организме человека работают по принципу концентрационных клеток.
Этот текст адаптирован из Openstax,Химия 2е изд.,Глава 17.4: Потенциал, свободная энергия и равновесие.
