18.7:
Piles de concentration
18.7:
Piles de concentration
Une pile de concentration est un type de cellule galvanique construite en connectant deux demi-piles presque identiques, toutes deux basées sur la même demi-réaction et utilisant la même électrode, ne différant que du point de vue de la concentration d’une espèce redox. Par conséquent, le potentiel d’une pile de concentration n’est déterminé que par la différence de concentration de l’espèce redox en particulier.
Examinez la cellule galvanique suivante :
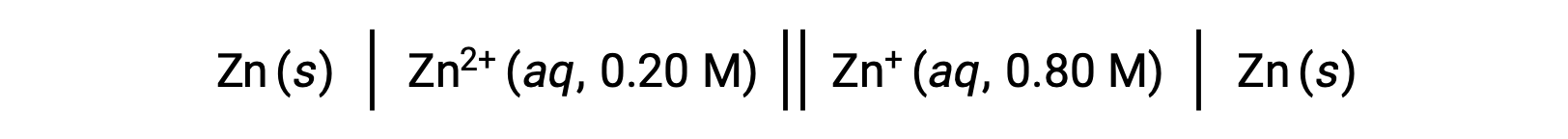
À partir des informations fournies, le potentiel de cellule de cette pile de concentration peut être calculé à l’aide de l’équation de Nernst :

La substitution dans l’équation de Nernst,
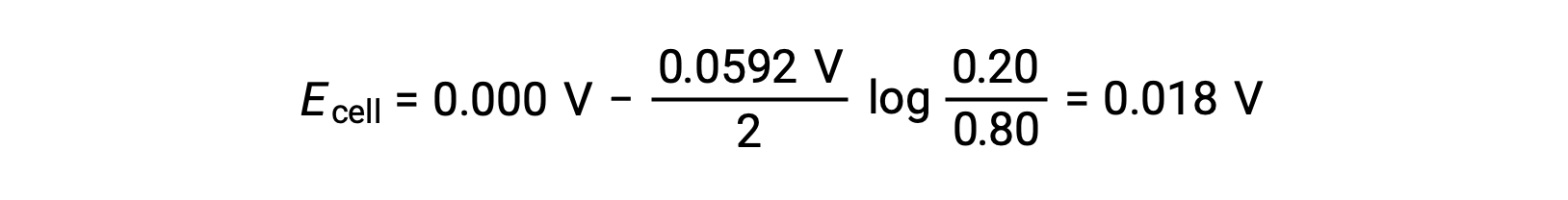
La valeur positive du potentiel de cellule indique que la réaction globale de la pile est spontanée. Cette réaction spontanée se produit lorsque la concentration en ions zinc dans la cathode chute (par réduction en zinc élémentaire) alors que celle dans l’anode augmente (par oxydation de l’anode de zinc en ions zinc). Une force motrice plus importante pour la réduction du zinc est présente à la cathode, où la concentration en ions Zn2+ est plus élevée (Ecathode > Eanode).
Les pH-mètres en laboratoire, les canaux ioniques dans les membranes des cellules nerveuses et les cellules du muscle cardiaque dans le corps humain fonctionnent suivant le principe des piles de concentration.
Ce texte est adapté de Openstax,Chimie 2e,Chapitre 17.4 : Potentiel, énergie libre et équilibre.
