18.7:
Konsantrasyon Hücreleri
18.7:
Konsantrasyon Hücreleri
Bir konsantrasyon hücresi, her ikisi de aynı yarı reaksiyona dayanan ve aynı elektrot kullanılarak, sadece bir redoks türünün konsantrasyonunda farklılık gösteren, hemen hemen aynı iki yarım hücreyi birbirine bağlayarak inşa edilen bir voltaik hücre türüdür. Bu nedenle, bir konsantrasyon hücresinin potansiyeli, yalnızca belirli redoks türlerinin konsantrasyon farkı ile belirlenir.
Aşağıdaki voltaik hücreyi göz önünde bulundurun:
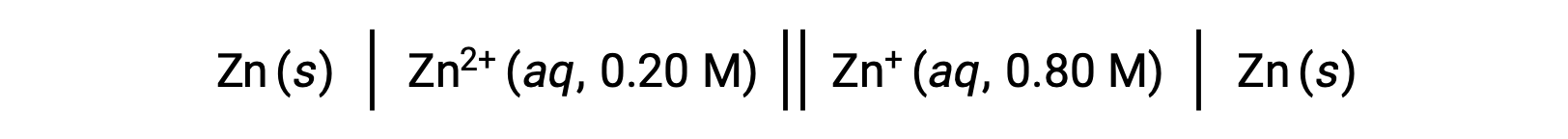
Verilen bilgilerden, bu konsantrasyon hücresinin hücre potansiyeli Nernst denklemi kullanılarak hesaplanabilir:

Nernst denklemine yerleştirme,
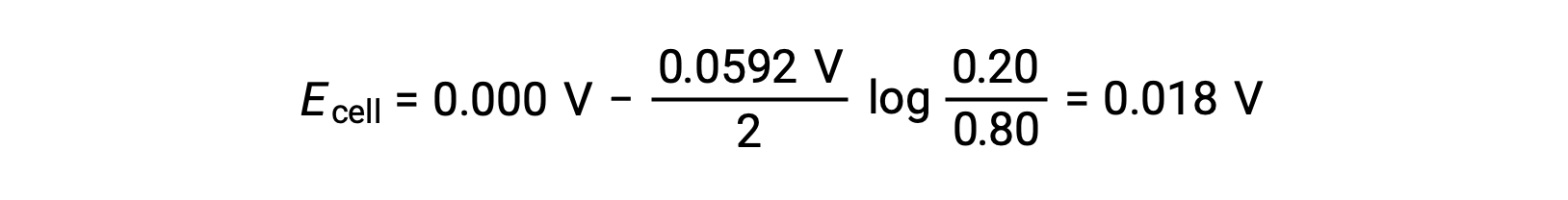
Hücre potansiyelinin pozitif değeri, genel hücre reaksiyonunun spontan olduğunu gösterir. Bu spontan reaksiyon, katottaki çinko iyonu konsantrasyonu düştüğünde (elementel çinkoya indirgenerek), anotta yükseldiğinde (çinko anotunun çinko iyonlarına oksidasyonu ile) meydana gelir. Zn+2 iyon konsantrasyonunun daha büyük olduğu katotta çinkonun azaltılması için daha büyük bir itici kuvvet bulunur (Ekatot > Eanot).
Laboratuardaki pH ölçerler, sinir hücresi zarlarındaki iyon kanalları ve insan vücudundaki kalp kası hücreleri, konsantrasyon hücreleri prensibine göre çalışır.
Bu metin bu kaynaktan uyarlanmıştır: Openstax,Chemistry 2e,Chapter 17.4: Potential, Free Energy, and Equilibrium.
